高中化学选修四--第二章 第三节 化学平衡 (共21张PPT)
文档属性
| 名称 | 高中化学选修四--第二章 第三节 化学平衡 (共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-03 17:53:46 | ||
图片预览



文档简介
(共21张PPT)
例、已知:T℃、Pkpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g) C(g),平衡时C 的体积分数为40℅
①欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 ,②另选一容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为
10V/7
40℅
5V/7
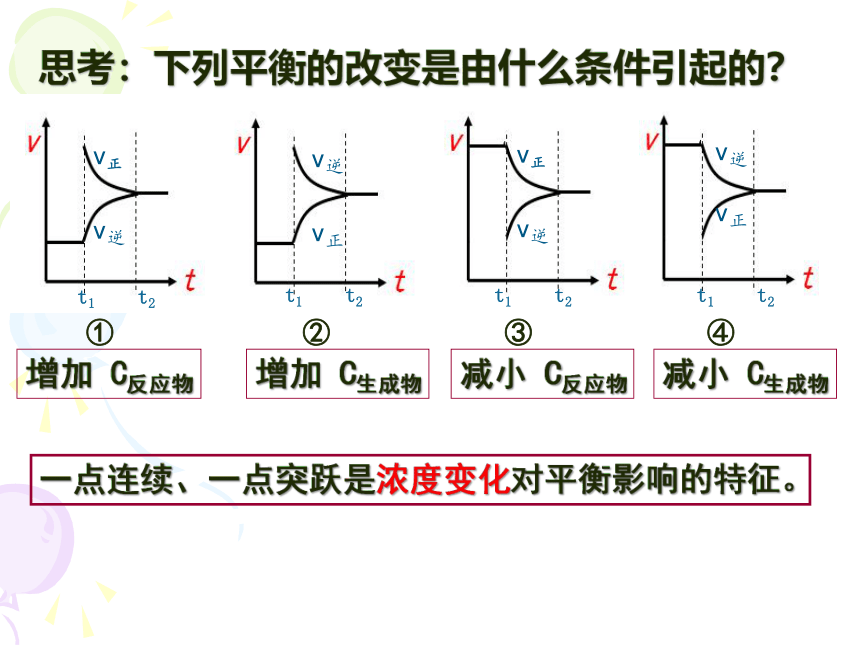
思考:下列平衡的改变是由什么条件引起的?
增加 C反应物
减小 C生成物
减小 C反应物
增加 C生成物
一点连续、一点突跃是浓度变化对平衡影响的特征。
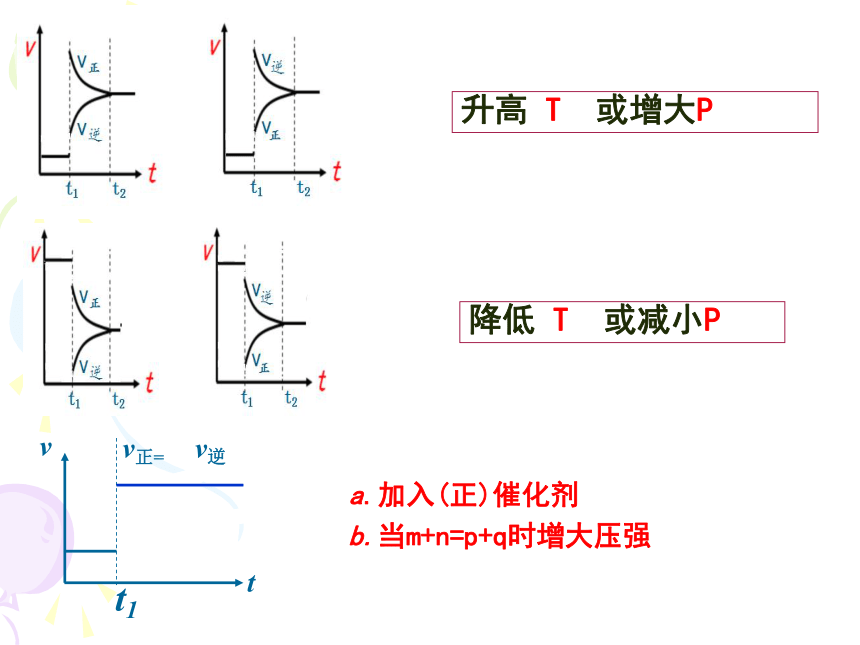
升高 T 或增大P
降低 T 或减小P
a.加入(正)催化剂
b.当m+n=p+q时增大压强
解图像题技巧
勒夏特列原理
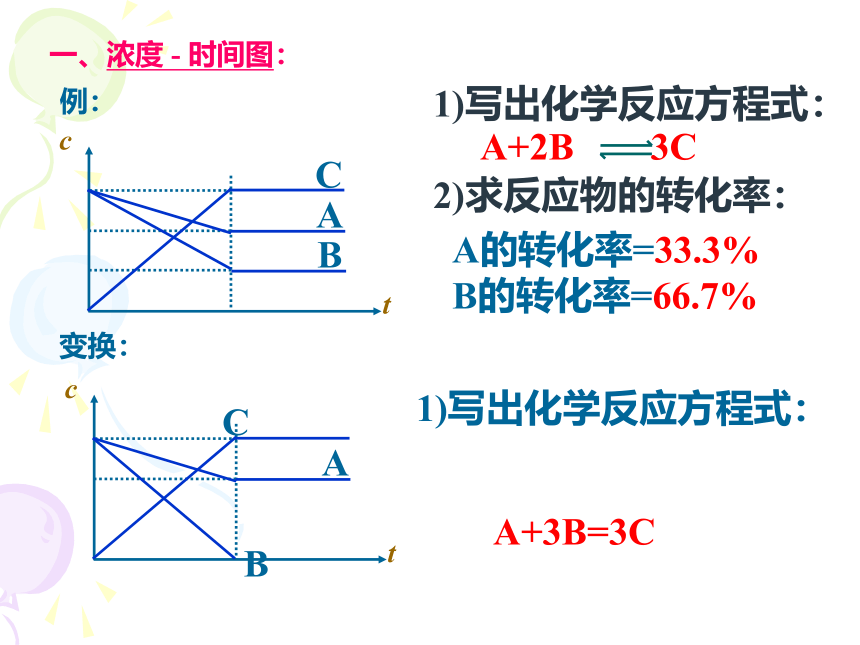
一、浓度 - 时间图:
1)写出化学反应方程式:
2)求反应物的转化率:
A的转化率=33.3%
B的转化率=66.7%
1)写出化学反应方程式:
例:
变换:
A+3B=3C
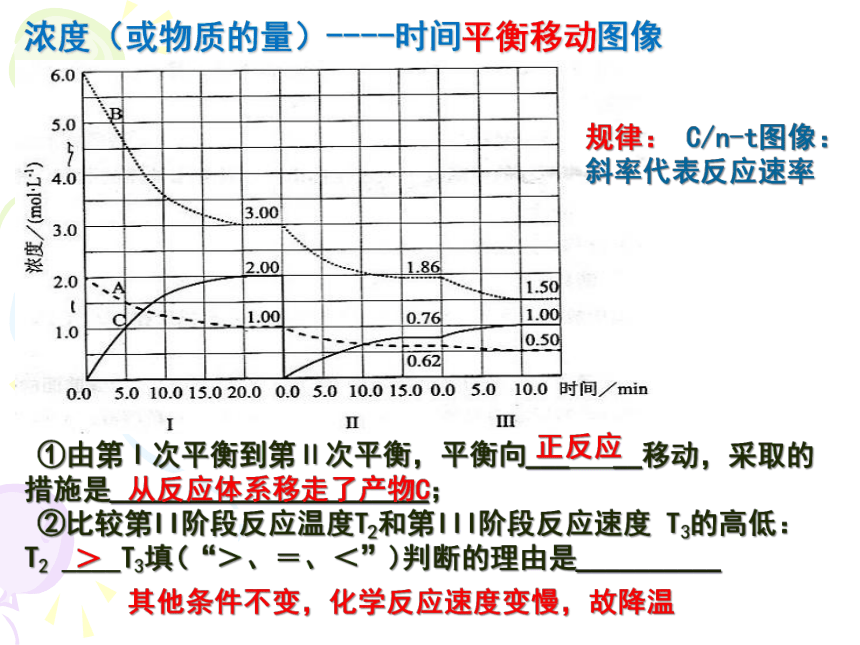
浓度(或物质的量)----时间平衡移动图像
规律: C/n-t图像:斜率代表反应速率
①由第Ⅰ次平衡到第Ⅱ次平衡,平衡向___ __移动,采取的措施是______________________;
②比较第II阶段反应温度T2和第III阶段反应速度 T3的高低: T2 ____T3填(“>、=、<”)判断的理由是__________
正反应
从反应体系移走了产物C
>
其他条件不变,化学反应速度变慢,故降温
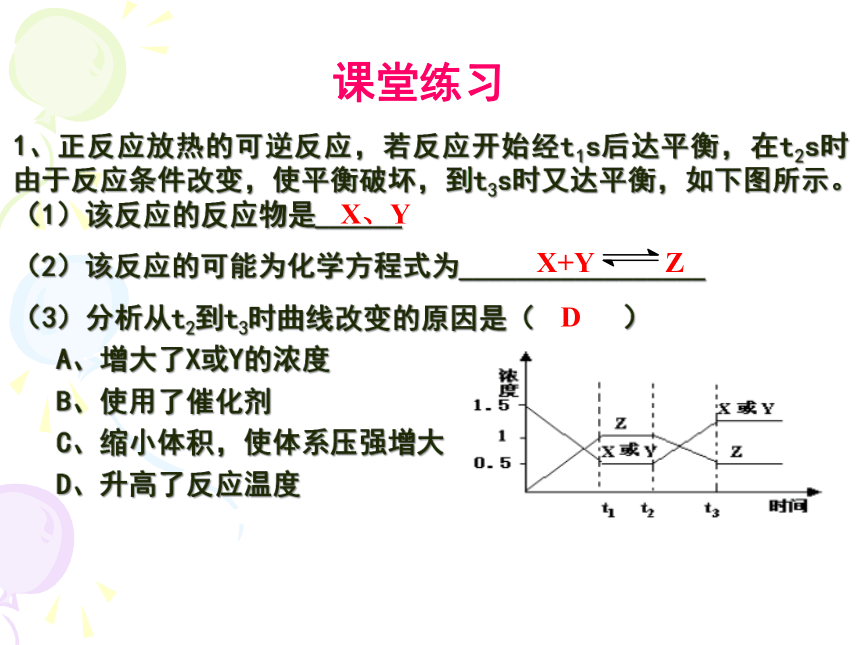
1、正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如下图所示。
(1)该反应的反应物是______
(2)该反应的可能为化学方程式为_________________
(3)分析从t2到t3时曲线改变的原因是( )
A、增大了X或Y的浓度
B、使用了催化剂
C、缩小体积,使体系压强增大
D、升高了反应温度
X、Y
D
课堂练习
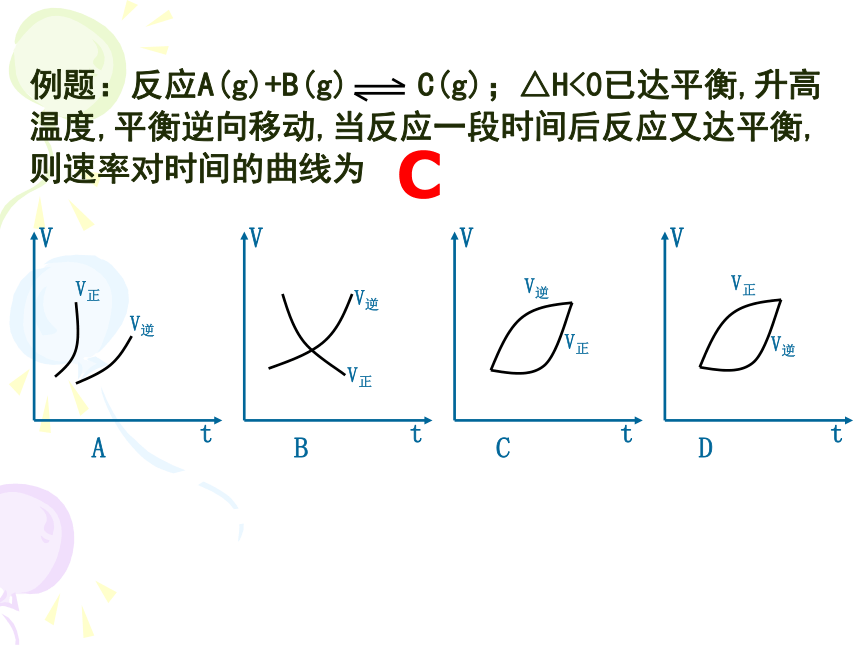
例题:反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为
C
3、某物质的转化率(或百分含量)-时间-温度/压强)图
?对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
?T1____T2, 正反应____热
>
<
放
吸
<
>
【例3 】
=
>
先拐先平,数值大
*
【例4 】对于反应mA(g)+nB(g) pC(g)+qD(g)
?判断压强高低:
P1____P2, m+n____p+q
?判断温度高低:
T1___T2 ,正反应 ___热
>
吸
<
<
4、某物质的转化率(或百分含量)-温度-压强图:
【例1 】 mA(g)+ nB(g) pC(g)+ qD(g)
定一议二
看图技巧:图象中 有三个量时,“定一议二”,再看曲线的变化趋势。
正反应 热
m+n p+q
正反应 热
m+n p+q
放
>
放
<
*
正反应 热
m+n p+q
正反应 热
m+n p+q
吸
吸
>
=
例: mA(g)+ nB(g) pC(g)+ qD(g)
*
练习:可逆反应:aX(s) + bY(g) cZ(g) +dW(g)达到平衡,混合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。
1、当压强不变时,升高温度,
Y的体积分数变 ,
平衡向 方向移动,则正反应是 热反应。
2、当温度不变时,增大压强,Y的体积分数变————,平衡向 ———— 方向移动,则化学方程式中左右两边的系数大小关系是————————。
小
正反应
吸
大
逆反应
b<(c+d)
*
例:混合气体平均相对分子质量(转化率等)—温度(压强)图像
例1:可逆反应2A+B 2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B不可能都是气体
E.A和B可能都是气体
*
2.密闭容器中mA(g)+nB(g) pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如下图。则:
(1)增大压强,A的转化率____
平衡向 移动,
达到平衡后,混合物中C的浓度________。
(2)上述化学方程式中的系数m、n、p的正确关系是 , (3)当降低温度时,C的浓度减小,正反应是____热反应。
增大
m+n>p
增大
吸
A的转化率
P
正反应方向
*
其它:
?正反应吸热
?正反应吸热
?正反应放热
?m+n对于反应mA(g)+nB(g) pC(g)+qD(g)
*
例1.对于反应2A(g) + B(g) 2C(g)在反应过程中C的质量分数随温度变化如图所示,试确定:
(1)T0对应的V正与V逆的关系是 。
(2)正反应为 热反应。
(3)A、B两点正反应速率的大小关系 。
(4)温度T<T0时,Wc逐渐增大的原因是
V正=V逆
放
VA反应还没有到达平衡,正在
正向进行,随着温度升高,
生成的C越来越多
2.下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
注意:曲线上的每一点代表平衡点,曲线上、下方的每一点代表没有达到平衡的点
C点
*
3.在一定条件下,固定容积的密闭容器中反应:
2NO2(g) O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A、当X表示温度时,Y表示NO2的物质的量
B、当X表示压强时,Y表示NO2的转化率
C、当X表示反应时间时,Y表示混合气体的
密度
D、当X表示NO2的物质的量时,Y表示O2的
物质的量
AB
*
4.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
A.t1时,N的浓度是M浓度的2倍
D.t3时,反应达到平衡
B.t2时,正逆反应速率相等,反应达到平衡
C.t3时,正反应速率大于逆反应速率
AD
例、已知:T℃、Pkpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g) C(g),平衡时C 的体积分数为40℅
①欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 ,②另选一容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为
10V/7
40℅
5V/7
思考:下列平衡的改变是由什么条件引起的?
增加 C反应物
减小 C生成物
减小 C反应物
增加 C生成物
一点连续、一点突跃是浓度变化对平衡影响的特征。
升高 T 或增大P
降低 T 或减小P
a.加入(正)催化剂
b.当m+n=p+q时增大压强
解图像题技巧
勒夏特列原理
一、浓度 - 时间图:
1)写出化学反应方程式:
2)求反应物的转化率:
A的转化率=33.3%
B的转化率=66.7%
1)写出化学反应方程式:
例:
变换:
A+3B=3C
浓度(或物质的量)----时间平衡移动图像
规律: C/n-t图像:斜率代表反应速率
①由第Ⅰ次平衡到第Ⅱ次平衡,平衡向___ __移动,采取的措施是______________________;
②比较第II阶段反应温度T2和第III阶段反应速度 T3的高低: T2 ____T3填(“>、=、<”)判断的理由是__________
正反应
从反应体系移走了产物C
>
其他条件不变,化学反应速度变慢,故降温
1、正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如下图所示。
(1)该反应的反应物是______
(2)该反应的可能为化学方程式为_________________
(3)分析从t2到t3时曲线改变的原因是( )
A、增大了X或Y的浓度
B、使用了催化剂
C、缩小体积,使体系压强增大
D、升高了反应温度
X、Y
D
课堂练习
例题:反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为
C
3、某物质的转化率(或百分含量)-时间-温度/压强)图
?对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
?T1____T2, 正反应____热
>
<
放
吸
<
>
【例3 】
=
>
先拐先平,数值大
*
【例4 】对于反应mA(g)+nB(g) pC(g)+qD(g)
?判断压强高低:
P1____P2, m+n____p+q
?判断温度高低:
T1___T2 ,正反应 ___热
>
吸
<
<
4、某物质的转化率(或百分含量)-温度-压强图:
【例1 】 mA(g)+ nB(g) pC(g)+ qD(g)
定一议二
看图技巧:图象中 有三个量时,“定一议二”,再看曲线的变化趋势。
正反应 热
m+n p+q
正反应 热
m+n p+q
放
>
放
<
*
正反应 热
m+n p+q
正反应 热
m+n p+q
吸
吸
>
=
例: mA(g)+ nB(g) pC(g)+ qD(g)
*
练习:可逆反应:aX(s) + bY(g) cZ(g) +dW(g)达到平衡,混合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。
1、当压强不变时,升高温度,
Y的体积分数变 ,
平衡向 方向移动,则正反应是 热反应。
2、当温度不变时,增大压强,Y的体积分数变————,平衡向 ———— 方向移动,则化学方程式中左右两边的系数大小关系是————————。
小
正反应
吸
大
逆反应
b<(c+d)
*
例:混合气体平均相对分子质量(转化率等)—温度(压强)图像
例1:可逆反应2A+B 2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B不可能都是气体
E.A和B可能都是气体
*
2.密闭容器中mA(g)+nB(g) pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如下图。则:
(1)增大压强,A的转化率____
平衡向 移动,
达到平衡后,混合物中C的浓度________。
(2)上述化学方程式中的系数m、n、p的正确关系是 , (3)当降低温度时,C的浓度减小,正反应是____热反应。
增大
m+n>p
增大
吸
A的转化率
P
正反应方向
*
其它:
?正反应吸热
?正反应吸热
?正反应放热
?m+n
*
例1.对于反应2A(g) + B(g) 2C(g)在反应过程中C的质量分数随温度变化如图所示,试确定:
(1)T0对应的V正与V逆的关系是 。
(2)正反应为 热反应。
(3)A、B两点正反应速率的大小关系 。
(4)温度T<T0时,Wc逐渐增大的原因是
V正=V逆
放
VA
正向进行,随着温度升高,
生成的C越来越多
2.下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
注意:曲线上的每一点代表平衡点,曲线上、下方的每一点代表没有达到平衡的点
C点
*
3.在一定条件下,固定容积的密闭容器中反应:
2NO2(g) O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A、当X表示温度时,Y表示NO2的物质的量
B、当X表示压强时,Y表示NO2的转化率
C、当X表示反应时间时,Y表示混合气体的
密度
D、当X表示NO2的物质的量时,Y表示O2的
物质的量
AB
*
4.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
A.t1时,N的浓度是M浓度的2倍
D.t3时,反应达到平衡
B.t2时,正逆反应速率相等,反应达到平衡
C.t3时,正反应速率大于逆反应速率
AD
