高一化学人教版必修二第二章第二节2.2.2化学能与电能 课件(37张)
文档属性
| 名称 | 高一化学人教版必修二第二章第二节2.2.2化学能与电能 课件(37张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-03 17:55:32 | ||
图片预览




文档简介
(共37张PPT)
第二节 化学能与电能
第二、三课时
第二章
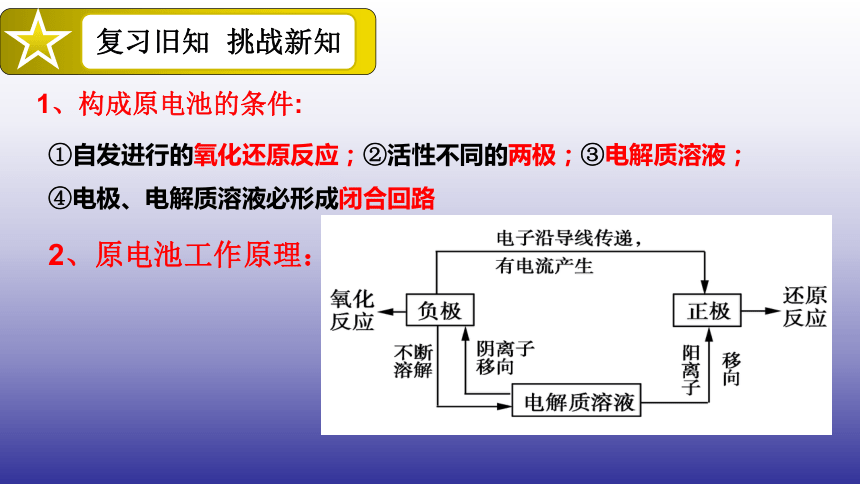
1、构成原电池的条件:
①自发进行的氧化还原反应;②活性不同的两极;③电解质溶液;
④电极、电解质溶液必形成闭合回路
2、原电池工作原理:
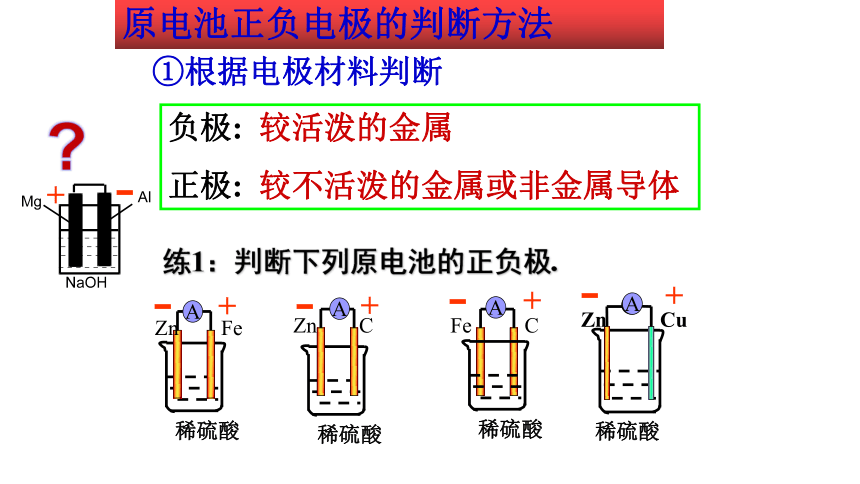
①根据电极材料判断
负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体
-
+
-
+
-
+
-
+
原电池正负电极的判断方法
+
-
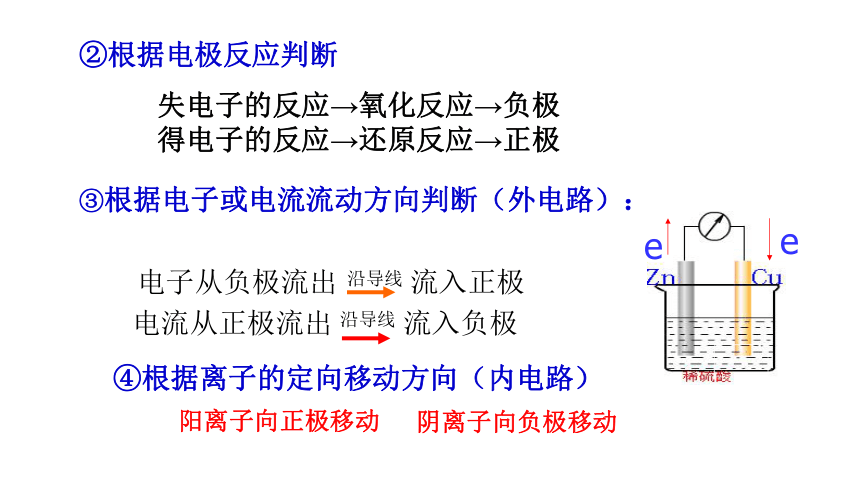
③根据电子或电流流动方向判断(外电路):
④根据离子的定向移动方向(内电路)
阳离子向正极移动
阴离子向负极移动
②根据电极反应判断
失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极
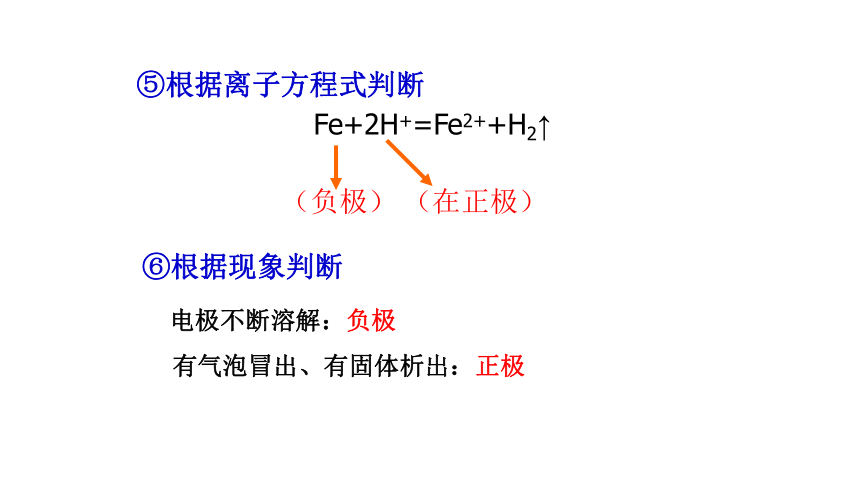
⑥根据现象判断
电极不断溶解:负极
有气泡冒出、有固体析出:正极
⑤根据离子方程式判断
(负极)
(在正极)
二、电极反应式(离子反应式)和原电池总反应式的书写
(1)负极反应式的书写
①活泼金属作负极时,本身失电子,发生氧化反应:
若生成的阳离子不与电解质溶液反应,可直接写成产物为金属阳离子,如Zn-2e-=Zn2+,Cu-2e-=Cu2+ (一般是负极本身失电子)
若生成的金属阳离子与电解质溶液反应,应写成“金属失电子的反应式”与“阳离子与电解质溶液反应的反应式”相叠加的形式。如:Mg-Al(KOH)原电池,负极反应式为:
Al-3e-+4OH-=AlO2-+2H2O
②负极材料本身不反应时,常见书写方法为:
H2-O2(H2SO4)燃料电池,负极反应式为:
H2-2e-=2H+
H2-O2(KOH)燃料电池,负极反应式为:
H2-2e-+2OH-=2H2O
(2)正极反应式的书写
首先根据化合价变化或氧化性强弱判断哪种微粒得电子。
其次确定该微粒得电子后变成哪种形式。
如H2-O2(H2SO4)原电池,正极反应式为:
O2+4e-+4H+=2H2O
H2-O2(KOH)原电池,正极反应式为:
O2+4e-+2H2O=4OH-
(3)原电池反应式的书写
两电极反应式,得失电子数相等时,将两电极反应式相加即得原电池反应式。
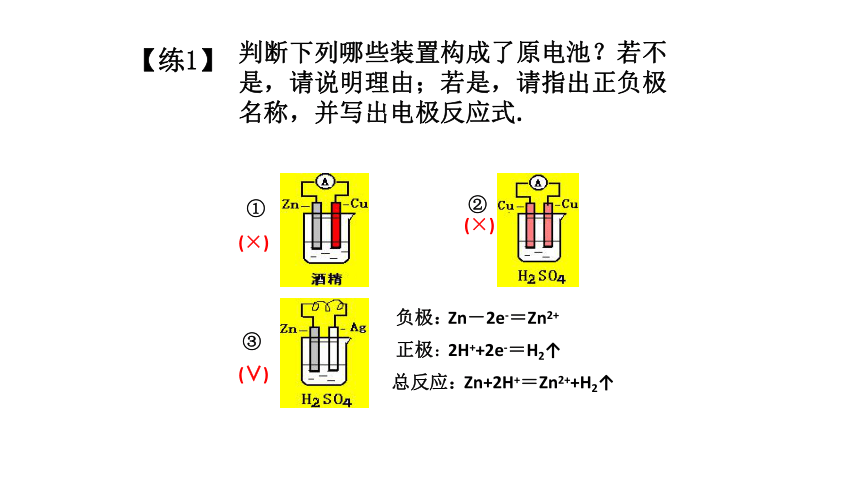
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
【练1】
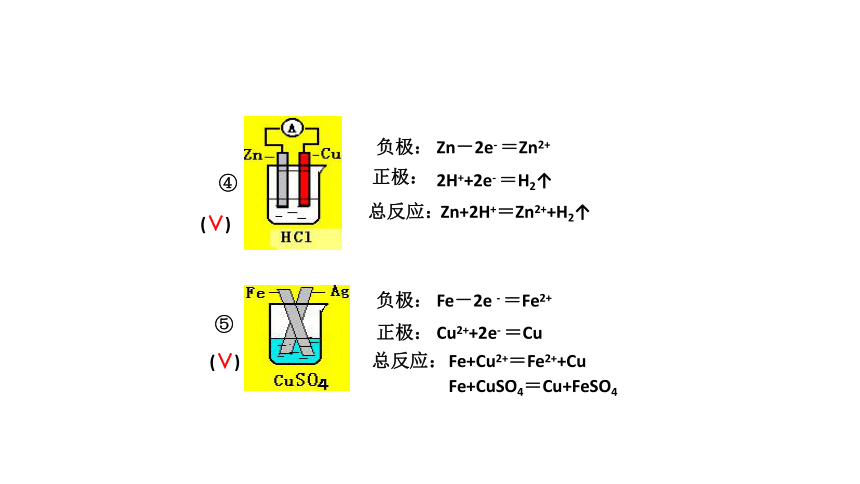
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e- =Zn2+
2H++2e- =H2↑
Zn+2H+=Zn2++H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
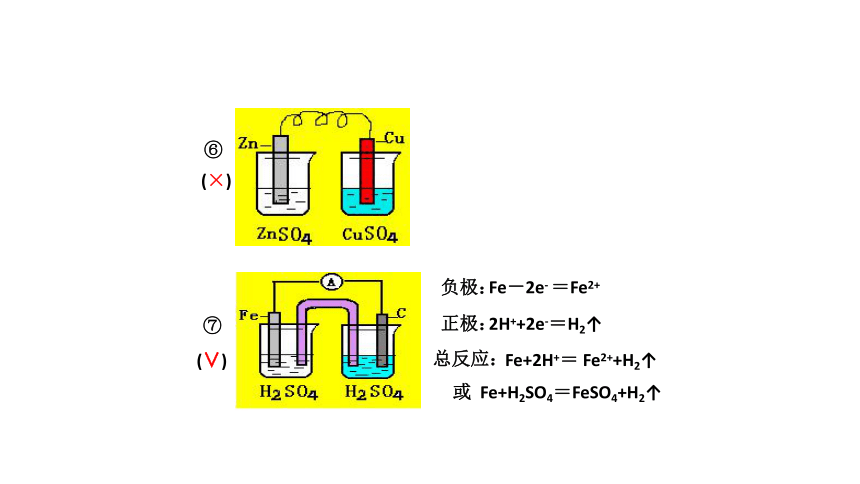
⑦
⑥
(×)
(∨)
负极:
正极:
总反应:
Fe-2e- =Fe2+
2H++2e-=H2↑
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
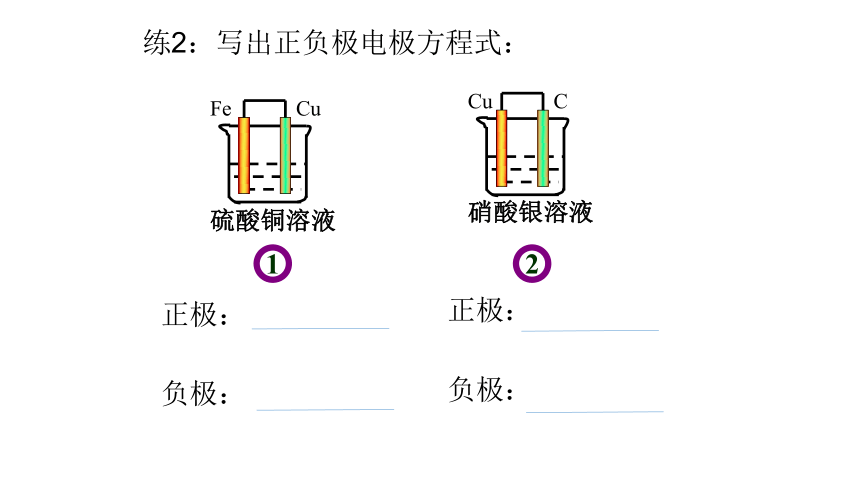
1
2
练2:写出正负极电极方程式:
正极:
负极:
正极:
负极:
1
2
练3:判断下列电池的正负极:
正极:
负极:
正极:
负极:
1
2
练4:判断下列电池的正负极:
正极:
负极:
正极:
负极:
我国自主研发的燃料电池车
1.化学电池有三大类型:
、 、 .
一次性电池 二次电池 燃料电池
2.特点:
①一次电池:不可充电,
如干电池(又称为锌锰电池,是最早使用的化学电池)
②二次电池:可循环利用,
放电过程是将 能转化为 能;
充电过程是将 能转化为 能。
③燃料电池:可不断充入氧化剂、还原剂连续使用,
最理想的燃料是 。
(1)产物为水,无污染
(2)与其它能源比,反应相同质量,放出能量多
(3)来源广
化学 电
电 化学
H2
三、发展中的化学电源
负极(锌筒):
正极(碳棒):
电池反应方程式
2NH4++ Zn=2NH3+H2+Zn2+
2NH4+ + 2e- = 2NH3 + H2
Zn – 2e- = Zn2+
1、锌-锰干电池 (1)酸性电解质溶液
四、常见的化学电源
电解液:NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2
(2)碱性锌锰干电池
随着用电器朝着小型化、多功能化发
展的要求,对电池的发展也提出了小型化、
多功能化发展的要求。
体积小、性能好的碱性锌-锰电池应
运而生。这类电池的重要特征是电解质溶
液由原来的中性变为离子导电性更好的碱
性,负极也由锌片改为锌粉,反应面积成
倍增长,使放电电流大幅度提高。
练习
练5.碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:
2MnO2(s)+H2O(1)+2e- = Mn2O3(s)+2OH- (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
C
练6. 最早使用的化学电源(chemical power source)
是锌锰电池,即大家熟悉的干电池,其结构如图
2?2?5所示。
尽管这种电池的历史悠久,但对于它的化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
F极:Zn-2e-+2NH4Cl=Zn(NH3)2Cl2+2H+
总反应式:
2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
B
2、铅蓄电池(二次电池)
电极:Pb为负极, PbO2为正极.
电解液: 30%的H2SO4溶液
负极(Pb) :Pb+SO42--2e-=PbSO4
正极(PbO2) PbO2+4H++SO42-+2e-=PbSO4+2H2O
总电池反应:PbO2+Pb+2H2SO4=2PbSO4+2H2O
总反应式:
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
镍镉电池
正极材料为__________,负极材料为____,电解质 为______。
NiO(OH)
Cd
KOH
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环
境造成严重的污染。
上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。
“痛痛病”是因镉中毒引起的。
【练7】
铅蓄电池的总反应式为:
Pb + PbO2 + 2H2SO4 PbSO4 + 2H2O
对于铅蓄电池放电时的说法错误的是( )
A. 铅为负极,PbO2 为正极
B. 负极的电极反应式为
Pb - 2e- + SO42- = PbSO4
C. 正极的电极反应式为:
PbO2+ 4H+ +SO42- + 2e-= PbSO4 + 2H2O
D. 电解液的密度不变
D
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
3、锂电池
负极: Li
正极: MnO2
电解质: 锂盐(非水溶液介质)
电极反应:(-) Li – e- = Li+
(+) MnO2 + e- = MnO2-
特点: 高能电池、质轻、电压高 、工作效率高和储存
寿命长。
用途:电脑、照相机、手表、心脏起搏器、火箭等。
【组成】
银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和 Zn, 电解质溶液为KOH溶液。
电极反应式为:
(-) Zn - 2e- + 2OH- =Zn(OH)2
(+)Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为
Zn + Ag2O + H2O = 2Ag + Zn(OH)2
4、银—锌电池(钮扣电池)
银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和 Zn 电解质溶液为 KOH溶液,电极反应式为:
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为:Zn + Ag2O + H2O = 2Ag + Zn(OH)2
下列说法正确的是( )
A.电流由Zn 经外电路流向Ag2O
B.Zn是负极,该电极发生的电极反应是还原反应
C.Ag2O是正极,该电极发生的电极反应是还原反应
D. 工作时,负极区溶液的 pH不断减小,正极区溶液的pH
不断增大
C D
【练8】
原电池电极反应式的书写注意事项:
(1)原负失氧。
(2)要注意溶液的酸碱性,适当的在电极方程式两边添
加H+、OH-、H2O,以遵循电荷守恒和质量守恒。
特殊情况:非水溶液
(3)要注意电极反应产物是否与电解质溶液发生反应。
【小结】
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
5、新型燃料电池
因此,燃料电池是名符其实的把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”。燃料电池的能量转化率很高,可达70%以。氢氧燃料电池除了具有能量转化率高、可持续使用的优点外,而且由于其燃烧产物为水,因此不污染环境。
电极:辅助电极(起导电作用、内疏松多孔可吸附气体)
(1)氢氧燃料电池:2H2+O2= 2H2O
酸性电解质溶液:
负极:
正极:
碱性(KOH)电解质溶液:
负极:
正极:
2H2 -4e- = 4H+
O2 +4e- + 4H+ = 2H2O
2H2 -4e- + 4OH- = 4H2O
O2 +4e- + 2H2O = 4OH-
(2)甲烷燃料电池(电解质溶液为氢氧化钾溶液)
的电极反应式及总方程式:
正极: 2O2 + 8e- + 4H2O = 8OH-
负极: CH4 + 10OH- -8e = CO32- + 7H2O
总反应:CH4 + 2O2 + 2OH- = CO32- + 3H2O
反应后溶液的pH如何变化?
(3)铝-空气燃料电池
电极反应:
(-)Al : 4Al – 12e- = 4Al3+
(+)C (空气): 3O2 + 6H2O +12e- = 12OH-
用作海洋航标灯,用海水作为电解质溶液。
4Al + 3O2 + 6H2O = 4Al(OH)3
【练9】
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应式为:2H2 + O2 =2H2O,是解液是KOH溶液,反应保持在较高温度下使水蒸发,下列叙述正确的是( )
A.工作时,电解质溶液的pH不断增大
B.工作时,能见到浅蓝色火焰
C.工作时,H2为正极,O2为负极
D.电极反应式为:
负极:2H2 + 4OH- - 4e- ====4H2O
正极:O2 +2H2O + 4e- ==== 4OH-
D
练10
第二节 化学能与电能
第二、三课时
第二章
1、构成原电池的条件:
①自发进行的氧化还原反应;②活性不同的两极;③电解质溶液;
④电极、电解质溶液必形成闭合回路
2、原电池工作原理:
①根据电极材料判断
负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体
-
+
-
+
-
+
-
+
原电池正负电极的判断方法
+
-
③根据电子或电流流动方向判断(外电路):
④根据离子的定向移动方向(内电路)
阳离子向正极移动
阴离子向负极移动
②根据电极反应判断
失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极
⑥根据现象判断
电极不断溶解:负极
有气泡冒出、有固体析出:正极
⑤根据离子方程式判断
(负极)
(在正极)
二、电极反应式(离子反应式)和原电池总反应式的书写
(1)负极反应式的书写
①活泼金属作负极时,本身失电子,发生氧化反应:
若生成的阳离子不与电解质溶液反应,可直接写成产物为金属阳离子,如Zn-2e-=Zn2+,Cu-2e-=Cu2+ (一般是负极本身失电子)
若生成的金属阳离子与电解质溶液反应,应写成“金属失电子的反应式”与“阳离子与电解质溶液反应的反应式”相叠加的形式。如:Mg-Al(KOH)原电池,负极反应式为:
Al-3e-+4OH-=AlO2-+2H2O
②负极材料本身不反应时,常见书写方法为:
H2-O2(H2SO4)燃料电池,负极反应式为:
H2-2e-=2H+
H2-O2(KOH)燃料电池,负极反应式为:
H2-2e-+2OH-=2H2O
(2)正极反应式的书写
首先根据化合价变化或氧化性强弱判断哪种微粒得电子。
其次确定该微粒得电子后变成哪种形式。
如H2-O2(H2SO4)原电池,正极反应式为:
O2+4e-+4H+=2H2O
H2-O2(KOH)原电池,正极反应式为:
O2+4e-+2H2O=4OH-
(3)原电池反应式的书写
两电极反应式,得失电子数相等时,将两电极反应式相加即得原电池反应式。
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
【练1】
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e- =Zn2+
2H++2e- =H2↑
Zn+2H+=Zn2++H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
⑦
⑥
(×)
(∨)
负极:
正极:
总反应:
Fe-2e- =Fe2+
2H++2e-=H2↑
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
1
2
练2:写出正负极电极方程式:
正极:
负极:
正极:
负极:
1
2
练3:判断下列电池的正负极:
正极:
负极:
正极:
负极:
1
2
练4:判断下列电池的正负极:
正极:
负极:
正极:
负极:
我国自主研发的燃料电池车
1.化学电池有三大类型:
、 、 .
一次性电池 二次电池 燃料电池
2.特点:
①一次电池:不可充电,
如干电池(又称为锌锰电池,是最早使用的化学电池)
②二次电池:可循环利用,
放电过程是将 能转化为 能;
充电过程是将 能转化为 能。
③燃料电池:可不断充入氧化剂、还原剂连续使用,
最理想的燃料是 。
(1)产物为水,无污染
(2)与其它能源比,反应相同质量,放出能量多
(3)来源广
化学 电
电 化学
H2
三、发展中的化学电源
负极(锌筒):
正极(碳棒):
电池反应方程式
2NH4++ Zn=2NH3+H2+Zn2+
2NH4+ + 2e- = 2NH3 + H2
Zn – 2e- = Zn2+
1、锌-锰干电池 (1)酸性电解质溶液
四、常见的化学电源
电解液:NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2
(2)碱性锌锰干电池
随着用电器朝着小型化、多功能化发
展的要求,对电池的发展也提出了小型化、
多功能化发展的要求。
体积小、性能好的碱性锌-锰电池应
运而生。这类电池的重要特征是电解质溶
液由原来的中性变为离子导电性更好的碱
性,负极也由锌片改为锌粉,反应面积成
倍增长,使放电电流大幅度提高。
练习
练5.碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:
2MnO2(s)+H2O(1)+2e- = Mn2O3(s)+2OH- (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
C
练6. 最早使用的化学电源(chemical power source)
是锌锰电池,即大家熟悉的干电池,其结构如图
2?2?5所示。
尽管这种电池的历史悠久,但对于它的化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
F极:Zn-2e-+2NH4Cl=Zn(NH3)2Cl2+2H+
总反应式:
2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是( )
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
B
2、铅蓄电池(二次电池)
电极:Pb为负极, PbO2为正极.
电解液: 30%的H2SO4溶液
负极(Pb) :Pb+SO42--2e-=PbSO4
正极(PbO2) PbO2+4H++SO42-+2e-=PbSO4+2H2O
总电池反应:PbO2+Pb+2H2SO4=2PbSO4+2H2O
总反应式:
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
镍镉电池
正极材料为__________,负极材料为____,电解质 为______。
NiO(OH)
Cd
KOH
废电池对环境的危害
电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环
境造成严重的污染。
上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。
“痛痛病”是因镉中毒引起的。
【练7】
铅蓄电池的总反应式为:
Pb + PbO2 + 2H2SO4 PbSO4 + 2H2O
对于铅蓄电池放电时的说法错误的是( )
A. 铅为负极,PbO2 为正极
B. 负极的电极反应式为
Pb - 2e- + SO42- = PbSO4
C. 正极的电极反应式为:
PbO2+ 4H+ +SO42- + 2e-= PbSO4 + 2H2O
D. 电解液的密度不变
D
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
3、锂电池
负极: Li
正极: MnO2
电解质: 锂盐(非水溶液介质)
电极反应:(-) Li – e- = Li+
(+) MnO2 + e- = MnO2-
特点: 高能电池、质轻、电压高 、工作效率高和储存
寿命长。
用途:电脑、照相机、手表、心脏起搏器、火箭等。
【组成】
银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和 Zn, 电解质溶液为KOH溶液。
电极反应式为:
(-) Zn - 2e- + 2OH- =Zn(OH)2
(+)Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为
Zn + Ag2O + H2O = 2Ag + Zn(OH)2
4、银—锌电池(钮扣电池)
银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和 Zn 电解质溶液为 KOH溶液,电极反应式为:
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为:Zn + Ag2O + H2O = 2Ag + Zn(OH)2
下列说法正确的是( )
A.电流由Zn 经外电路流向Ag2O
B.Zn是负极,该电极发生的电极反应是还原反应
C.Ag2O是正极,该电极发生的电极反应是还原反应
D. 工作时,负极区溶液的 pH不断减小,正极区溶液的pH
不断增大
C D
【练8】
原电池电极反应式的书写注意事项:
(1)原负失氧。
(2)要注意溶液的酸碱性,适当的在电极方程式两边添
加H+、OH-、H2O,以遵循电荷守恒和质量守恒。
特殊情况:非水溶液
(3)要注意电极反应产物是否与电解质溶液发生反应。
【小结】
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
5、新型燃料电池
因此,燃料电池是名符其实的把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”。燃料电池的能量转化率很高,可达70%以。氢氧燃料电池除了具有能量转化率高、可持续使用的优点外,而且由于其燃烧产物为水,因此不污染环境。
电极:辅助电极(起导电作用、内疏松多孔可吸附气体)
(1)氢氧燃料电池:2H2+O2= 2H2O
酸性电解质溶液:
负极:
正极:
碱性(KOH)电解质溶液:
负极:
正极:
2H2 -4e- = 4H+
O2 +4e- + 4H+ = 2H2O
2H2 -4e- + 4OH- = 4H2O
O2 +4e- + 2H2O = 4OH-
(2)甲烷燃料电池(电解质溶液为氢氧化钾溶液)
的电极反应式及总方程式:
正极: 2O2 + 8e- + 4H2O = 8OH-
负极: CH4 + 10OH- -8e = CO32- + 7H2O
总反应:CH4 + 2O2 + 2OH- = CO32- + 3H2O
反应后溶液的pH如何变化?
(3)铝-空气燃料电池
电极反应:
(-)Al : 4Al – 12e- = 4Al3+
(+)C (空气): 3O2 + 6H2O +12e- = 12OH-
用作海洋航标灯,用海水作为电解质溶液。
4Al + 3O2 + 6H2O = 4Al(OH)3
【练9】
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应式为:2H2 + O2 =2H2O,是解液是KOH溶液,反应保持在较高温度下使水蒸发,下列叙述正确的是( )
A.工作时,电解质溶液的pH不断增大
B.工作时,能见到浅蓝色火焰
C.工作时,H2为正极,O2为负极
D.电极反应式为:
负极:2H2 + 4OH- - 4e- ====4H2O
正极:O2 +2H2O + 4e- ==== 4OH-
D
练10
