实验活动6 酸、碱的化学性质 教案(表格式)
文档属性
| 名称 | 实验活动6 酸、碱的化学性质 教案(表格式) |
|
|
| 格式 | zip | ||
| 文件大小 | 26.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-03 17:02:05 | ||
图片预览


文档简介
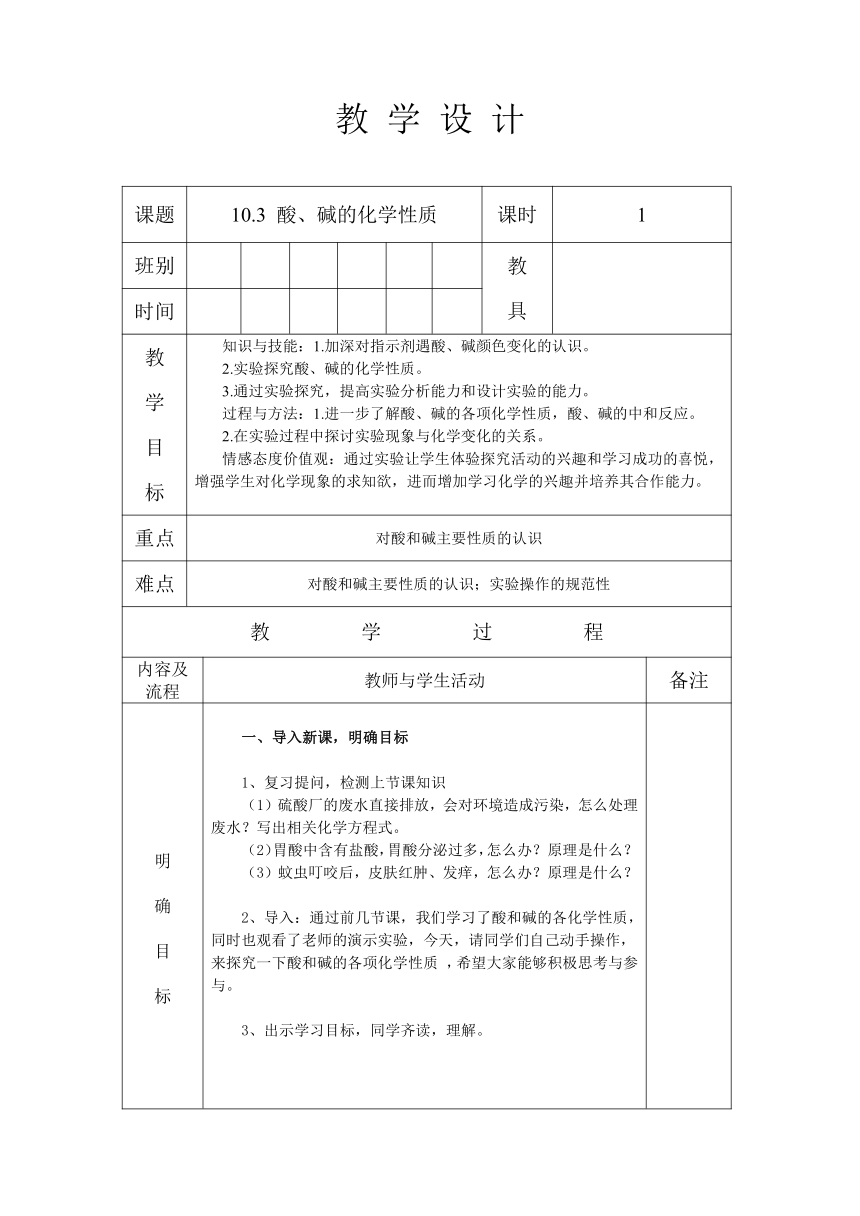
教 学 设 计
课题 10.3 酸、碱的化学性质 课时 1
班别 教 具
时间
教 学 目 标 知识与技能:1.加深对指示剂遇酸、碱颜色变化的认识。 2.实验探究酸、碱的化学性质。 3.通过实验探究,提高实验分析能力和设计实验的能力。 过程与方法:1.进一步了解酸、碱的各项化学性质,酸、碱的中和反应。 2.在实验过程中探讨实验现象与化学变化的关系。 情感态度价值观:通过实验让学生体验探究活动的兴趣和学习成功的喜悦,增强学生对化学现象的求知欲,进而增加学习化学的兴趣并培养其合作能力。
重点 对酸和碱主要性质的认识
难点 对酸和碱主要性质的认识;实验操作的规范性
教 学 过 程
内容及流程 教师与学生活动 备注
明 确 目 标 导入新课,明确目标 1、复习提问,检测上节课知识 (1)硫酸厂的废水直接排放,会对环境造成污染,怎么处理废水?写出相关化学方程式。 (2)胃酸中含有盐酸,胃酸分泌过多,怎么办?原理是什么? (3)蚊虫叮咬后,皮肤红肿、发痒,怎么办?原理是什么? 导入:通过前几节课,我们学习了酸和碱的各化学性质,同时也观看了老师的演示实验,今天,请同学们自己动手操作,来探究一下酸和碱的各项化学性质 ,希望大家能够积极思考与参与。
3、出示学习目标,同学齐读,理解。
内容及流程 教师与学生活动 备注
实 施 目 标 二、自主预习 梳理新知 1.通过本单元的学习,我们认识了“酸”和“碱”请回答下列问题: (1)常见的酸 等,在它们的水溶液里由于存在相同的 (填符号)因此,它们有很多相似的化学性质如: (写两条即可)。 (2)常用的碱有 等 可作某些气体的干燥剂。在它们的水溶液里由于存在相同的 (填符号)因此,它们有很多相似的化学性质如: 。 三、合作探究 生成能力 目标导学一:酸、碱与指示剂的反应 【实验用品】 试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴、白色点滴板。 稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。 合作探究 探究点 酸、碱的化学性质 1.酸的水溶液和碱的水溶液在反应前各有什么离子?反应后又有哪些微粒? 2.中和反应的实质是什么呢? 学生分组讨论交流。 【实验活动1】酸、碱与指示剂的反应 【实验操作】在两个白色点滴板上分别滴入稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液,向一白色点滴板上的酸碱溶液中滴加紫色石蕊溶液,向另一白色点滴板上的酸碱溶液中滴加无色酚酞溶液,观察现象。 【实验现象】 【实验结论】酸能使紫色的石蕊溶液变成红色,使无色的酚酞溶液不变色;碱能使紫色的石蕊溶液变成蓝色,使无色的酚酞溶液变成红色。
内容及流程 教师与学生活动 备注
实 施 目 标 目标导学二: 1、生锈铁钉放入稀盐酸中,现象为铁锈逐渐溶解,溶液变为黄色;反应的化学方程式为Fe2O3+6HCl (=====)2FeCl3+3H2O。若不及时将铁钉从稀盐酸中取出,观察到的现象为有大量气泡产生;反应的化学方程式为Fe+2HCl (=====)FeCl2+H2↑。 2、硫酸铜溶液与氢氧化钠溶液反应的现象为有蓝色沉淀产生;向上述混合液中加入稀盐酸,现象为沉淀溶解,形成蓝色溶液。相关反应的化学方程式为CuSO4+2NaOH (=====)Cu(OH)2↓+Na2SO4、Cu(OH)2+2HCl (=====)CuCl2+2H2O。 3、向滴有几滴酚酞溶液的氢氧化钠溶液里逐滴滴加稀盐酸,边滴边振荡,能说明氢氧化钠与稀盐酸恰好完全反应的现象为溶液颜色恰好由红色变成无色。取恰好完全反应后的溶液1 mL,置于蒸发皿中加热,使液体蒸干,观察到的现象为蒸发皿中留有白色固体。该白色固体是氯化钠,涉及反应的方程式为NaOH+HCl (=====)NaCl+H2O。 4、氢氧化钙性质探究 第Ⅰ步:现象:得到浑浊液体。解释:氢氧化钙微溶于水,在1 mL水中不能完全溶解。 第Ⅱ步:现象:溶液变红。 第Ⅲ步:现象:溶液仍然浑浊,仍然呈红色。 第Ⅳ步:现象:溶液变澄清,由红色变为无色。解释:氢氧化钙与稀盐酸发生中和反应,反应的化学方程式为Ca(OH)2+2HCl (=====)CaCl2+2H2O。 【合作探究】 1.将生锈的铁钉放入试管中时应如何操作? 答:先将试管横放,然后用镊子夹取铁钉放在试管口,再将试管慢慢地竖立起来,使铁钉缓缓地滑到试管底部。 2.对氢氧化钠与稀盐酸反应后的溶液进行蒸发操作时,应注意哪些问题? 答:蒸发过程中应用玻璃棒不断搅拌,防止局部温度过高,导致液滴飞溅;当蒸发皿中出现较多固体时停止加热,利用余热蒸干液体。 3.对于某些没有明显现象的中和反应,应如何确定酸、碱恰好完全反应? 【教师点拨】 1.酸和碱有腐蚀性,实验时应注意安全。 2.酸的化学性质:(1)能与指示剂作用;(2)能与活泼金属反应;(3)能与某些金属氧化物反应;(4)能与碱反应。 3.碱的化学性质:(1)能与指示剂反应;(2)能与某些非金属氧化物反应;(3)能与酸反应。 四、课堂总结 本节课我们探究了酸和碱的化学性质,同时也提高了动手能力。
内容及流程 教师与学生活动 备注
检 测 目 标 小亮在做"盐酸中和氢氧化钠溶液“的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究: 〖探究目的〗探究所得溶液的酸碱性 〖提出猜想〗所得溶液可能呈碱性,也可能呈 性,还可能呈 性。 〖实验验证〗 实验操作实验现象结论 用试管取该溶液1~2ml,滴加1~2滴无色酚酞溶液,振荡。 无色酚酞溶液变 溶液呈碱性 无色酚酞不变色 溶液呈
〖 分析与思考〗: 若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,小芳提出了以下方案: 方案一: 方案二:
板 书 设 计 实验活动6 酸、碱的化学性质 1.酸、碱与指示剂的反应 2.酸与金属氧化物的反应 3.中和反应
领 导 评 课 意 见 学校检查记实
教学后记
课题 10.3 酸、碱的化学性质 课时 1
班别 教 具
时间
教 学 目 标 知识与技能:1.加深对指示剂遇酸、碱颜色变化的认识。 2.实验探究酸、碱的化学性质。 3.通过实验探究,提高实验分析能力和设计实验的能力。 过程与方法:1.进一步了解酸、碱的各项化学性质,酸、碱的中和反应。 2.在实验过程中探讨实验现象与化学变化的关系。 情感态度价值观:通过实验让学生体验探究活动的兴趣和学习成功的喜悦,增强学生对化学现象的求知欲,进而增加学习化学的兴趣并培养其合作能力。
重点 对酸和碱主要性质的认识
难点 对酸和碱主要性质的认识;实验操作的规范性
教 学 过 程
内容及流程 教师与学生活动 备注
明 确 目 标 导入新课,明确目标 1、复习提问,检测上节课知识 (1)硫酸厂的废水直接排放,会对环境造成污染,怎么处理废水?写出相关化学方程式。 (2)胃酸中含有盐酸,胃酸分泌过多,怎么办?原理是什么? (3)蚊虫叮咬后,皮肤红肿、发痒,怎么办?原理是什么? 导入:通过前几节课,我们学习了酸和碱的各化学性质,同时也观看了老师的演示实验,今天,请同学们自己动手操作,来探究一下酸和碱的各项化学性质 ,希望大家能够积极思考与参与。
3、出示学习目标,同学齐读,理解。
内容及流程 教师与学生活动 备注
实 施 目 标 二、自主预习 梳理新知 1.通过本单元的学习,我们认识了“酸”和“碱”请回答下列问题: (1)常见的酸 等,在它们的水溶液里由于存在相同的 (填符号)因此,它们有很多相似的化学性质如: (写两条即可)。 (2)常用的碱有 等 可作某些气体的干燥剂。在它们的水溶液里由于存在相同的 (填符号)因此,它们有很多相似的化学性质如: 。 三、合作探究 生成能力 目标导学一:酸、碱与指示剂的反应 【实验用品】 试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴、白色点滴板。 稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。 合作探究 探究点 酸、碱的化学性质 1.酸的水溶液和碱的水溶液在反应前各有什么离子?反应后又有哪些微粒? 2.中和反应的实质是什么呢? 学生分组讨论交流。 【实验活动1】酸、碱与指示剂的反应 【实验操作】在两个白色点滴板上分别滴入稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液,向一白色点滴板上的酸碱溶液中滴加紫色石蕊溶液,向另一白色点滴板上的酸碱溶液中滴加无色酚酞溶液,观察现象。 【实验现象】 【实验结论】酸能使紫色的石蕊溶液变成红色,使无色的酚酞溶液不变色;碱能使紫色的石蕊溶液变成蓝色,使无色的酚酞溶液变成红色。
内容及流程 教师与学生活动 备注
实 施 目 标 目标导学二: 1、生锈铁钉放入稀盐酸中,现象为铁锈逐渐溶解,溶液变为黄色;反应的化学方程式为Fe2O3+6HCl (=====)2FeCl3+3H2O。若不及时将铁钉从稀盐酸中取出,观察到的现象为有大量气泡产生;反应的化学方程式为Fe+2HCl (=====)FeCl2+H2↑。 2、硫酸铜溶液与氢氧化钠溶液反应的现象为有蓝色沉淀产生;向上述混合液中加入稀盐酸,现象为沉淀溶解,形成蓝色溶液。相关反应的化学方程式为CuSO4+2NaOH (=====)Cu(OH)2↓+Na2SO4、Cu(OH)2+2HCl (=====)CuCl2+2H2O。 3、向滴有几滴酚酞溶液的氢氧化钠溶液里逐滴滴加稀盐酸,边滴边振荡,能说明氢氧化钠与稀盐酸恰好完全反应的现象为溶液颜色恰好由红色变成无色。取恰好完全反应后的溶液1 mL,置于蒸发皿中加热,使液体蒸干,观察到的现象为蒸发皿中留有白色固体。该白色固体是氯化钠,涉及反应的方程式为NaOH+HCl (=====)NaCl+H2O。 4、氢氧化钙性质探究 第Ⅰ步:现象:得到浑浊液体。解释:氢氧化钙微溶于水,在1 mL水中不能完全溶解。 第Ⅱ步:现象:溶液变红。 第Ⅲ步:现象:溶液仍然浑浊,仍然呈红色。 第Ⅳ步:现象:溶液变澄清,由红色变为无色。解释:氢氧化钙与稀盐酸发生中和反应,反应的化学方程式为Ca(OH)2+2HCl (=====)CaCl2+2H2O。 【合作探究】 1.将生锈的铁钉放入试管中时应如何操作? 答:先将试管横放,然后用镊子夹取铁钉放在试管口,再将试管慢慢地竖立起来,使铁钉缓缓地滑到试管底部。 2.对氢氧化钠与稀盐酸反应后的溶液进行蒸发操作时,应注意哪些问题? 答:蒸发过程中应用玻璃棒不断搅拌,防止局部温度过高,导致液滴飞溅;当蒸发皿中出现较多固体时停止加热,利用余热蒸干液体。 3.对于某些没有明显现象的中和反应,应如何确定酸、碱恰好完全反应? 【教师点拨】 1.酸和碱有腐蚀性,实验时应注意安全。 2.酸的化学性质:(1)能与指示剂作用;(2)能与活泼金属反应;(3)能与某些金属氧化物反应;(4)能与碱反应。 3.碱的化学性质:(1)能与指示剂反应;(2)能与某些非金属氧化物反应;(3)能与酸反应。 四、课堂总结 本节课我们探究了酸和碱的化学性质,同时也提高了动手能力。
内容及流程 教师与学生活动 备注
检 测 目 标 小亮在做"盐酸中和氢氧化钠溶液“的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究: 〖探究目的〗探究所得溶液的酸碱性 〖提出猜想〗所得溶液可能呈碱性,也可能呈 性,还可能呈 性。 〖实验验证〗 实验操作实验现象结论 用试管取该溶液1~2ml,滴加1~2滴无色酚酞溶液,振荡。 无色酚酞溶液变 溶液呈碱性 无色酚酞不变色 溶液呈
〖 分析与思考〗: 若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,小芳提出了以下方案: 方案一: 方案二:
板 书 设 计 实验活动6 酸、碱的化学性质 1.酸、碱与指示剂的反应 2.酸与金属氧化物的反应 3.中和反应
领 导 评 课 意 见 学校检查记实
教学后记
同课章节目录
