高一苏教化学必修2专题2第二单元 化学反应中的热量(共20张PPT)
文档属性
| 名称 | 高一苏教化学必修2专题2第二单元 化学反应中的热量(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-03 20:22:38 | ||
图片预览






文档简介
(共20张PPT)
*
镁条的燃烧
闪电时产生氮氧化物
石油气的燃烧
高温冶炼铁
原电池放电
实验一:向一支试管中放入用砂纸打磨光亮的镁条,加入5mL 2mol/L的盐酸,用手触摸试管外壁
实验二:打开夹子,将Ba(OH)2 晶体和NH4Cl 晶体在袋中混合均匀,触摸塑料袋
感受热量
吸热反应:有吸收热量的化学反应。
放热反应:有热量放出的化学反应。
一、放热反应和吸热反应
1.放热反应和吸热反应
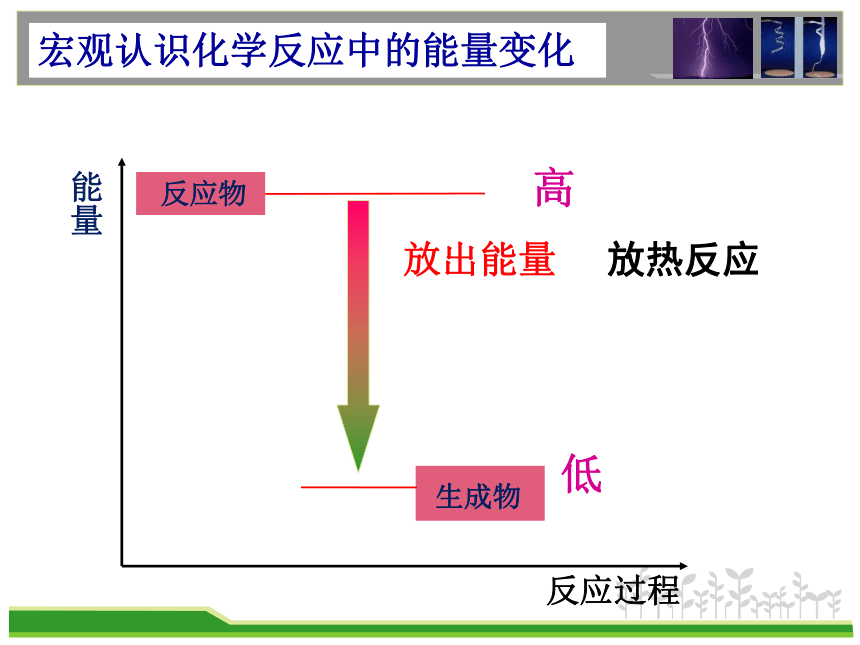
能量
反应过程
放出能量
放热反应
高
低
宏观认识化学反应中的能量变化
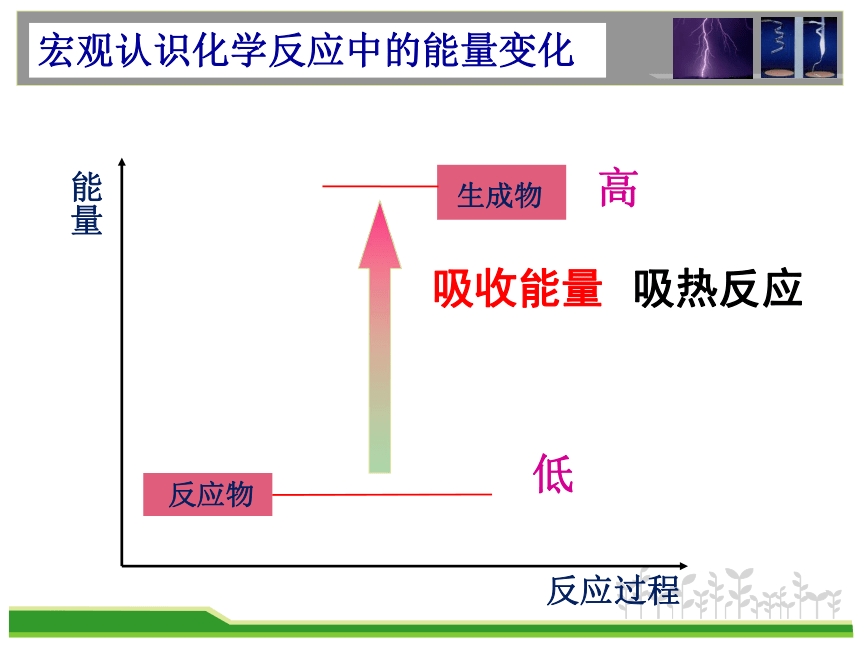
能量
反应过程
吸收能量
吸热反应
高
低
宏观认识化学反应中的能量变化
下列反应是放热反应?还是吸热反应?
①镁条的燃烧
②高温煅烧石灰石
③氧化钙与水的反应
④盐酸与氢氧化钠的中和反应
交流与讨论
放热反应
吸热反应
放出热量的化学反应
吸收热量的化学反应
①燃烧反应
②缓慢氧化
③金属与酸的反应
④酸碱中和反应
⑤铝热反应
⑥大部分化合反应
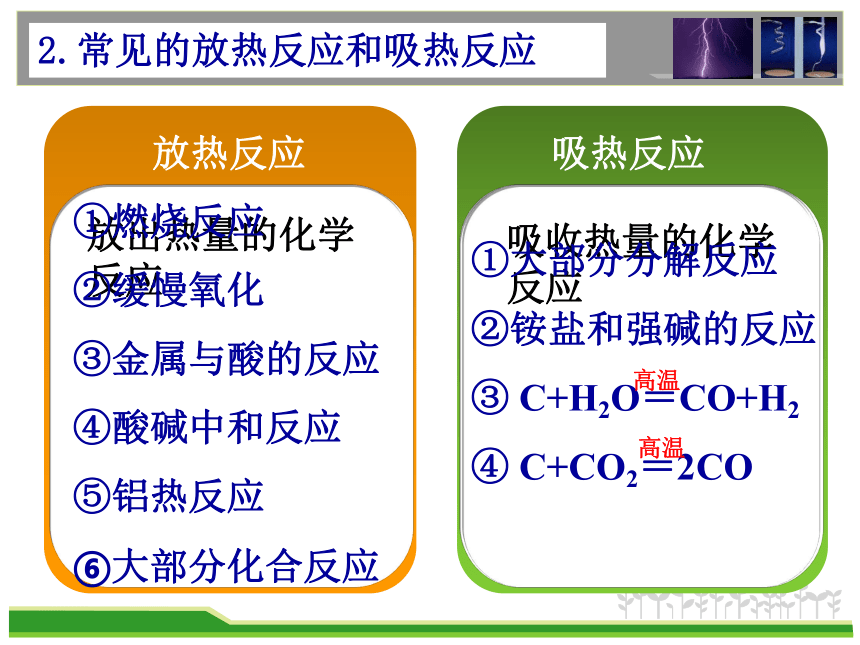
2.常见的放热反应和吸热反应
微观认识化学反应中的能量变化
为什么在化学反应中会有热量的放出和吸收?
微观认识化学反应中的能量变化
断键吸收总能量:436.4kJ+242.7kJ=679.1kJ
成键放出总能量:431.8×2=863.6kJ
放出能量:863.6kJ-679.1kJ=184.5kJ
放热反应
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。你能根据以上所给的数据判断反应:
2H2+O2=2H2O 是放热反应吗?
1.定义: 表示化学反应中放出或吸收的热量的化学方程式称为热化学方程式。
表达化学反应中的热量变化
CaCO3(s) = CaO(s) + CO2(g) △H = + 178.5kJ/mol
不仅表明了化学反应中的物质变化,也表明了化学反应中的热量变化
二、热化学方程式
2.意义:
1. 2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
2. H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
3. 2H2O(l) =2H2(g) + O2(g) △H = + 571.6 kJ /mol
4. H2(g) +1/2 O2(g) =H2O(g) △H =-241.8 kJ /mol
仔细观察分析所给四个热化学方程式,找出热化学方程式与化学方程式的差别
交流与讨论
(1)既表示物质变化,又表示能量变化(反应热)。
(2)反应物和生成物均标明了聚集状态,用g、l、s、aq分别代表气态、液态、固态、水溶液。
(3)反应体系的温度和压强要注明。
(4)省略反应条件、沉淀符号↓、气体符号↑。
(5)化学计量数可以是整数或分数。
(6)△H表示反应热,“—”表示放热,“+”表示吸热△H 的值与计量数成正比,单位始终为kJ/mol。
3.书写热化学方程式的注意事项:
你学会了吗?
已知1g氢气和氧气反应生成液态的水放出143kJ的能量,写出该反应的热化学方程式。
课堂巩固
1. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
2. 下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
3.已知每1mol碳在氧气中完全燃烧生成二氧化碳时,放出393.5kJ热量,请写出该反应的热化学方程式?
4.已知每1molSO2在气体氧气中完全燃烧生成SO3气体时,放出98.3kJ热量,请写出该反应的热化学方程式?
5.对热化学方程式H2(g)+ I2(g)=2HI(g);△H =
+26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需
吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量
*
镁条的燃烧
闪电时产生氮氧化物
石油气的燃烧
高温冶炼铁
原电池放电
实验一:向一支试管中放入用砂纸打磨光亮的镁条,加入5mL 2mol/L的盐酸,用手触摸试管外壁
实验二:打开夹子,将Ba(OH)2 晶体和NH4Cl 晶体在袋中混合均匀,触摸塑料袋
感受热量
吸热反应:有吸收热量的化学反应。
放热反应:有热量放出的化学反应。
一、放热反应和吸热反应
1.放热反应和吸热反应
能量
反应过程
放出能量
放热反应
高
低
宏观认识化学反应中的能量变化
能量
反应过程
吸收能量
吸热反应
高
低
宏观认识化学反应中的能量变化
下列反应是放热反应?还是吸热反应?
①镁条的燃烧
②高温煅烧石灰石
③氧化钙与水的反应
④盐酸与氢氧化钠的中和反应
交流与讨论
放热反应
吸热反应
放出热量的化学反应
吸收热量的化学反应
①燃烧反应
②缓慢氧化
③金属与酸的反应
④酸碱中和反应
⑤铝热反应
⑥大部分化合反应
2.常见的放热反应和吸热反应
微观认识化学反应中的能量变化
为什么在化学反应中会有热量的放出和吸收?
微观认识化学反应中的能量变化
断键吸收总能量:436.4kJ+242.7kJ=679.1kJ
成键放出总能量:431.8×2=863.6kJ
放出能量:863.6kJ-679.1kJ=184.5kJ
放热反应
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。你能根据以上所给的数据判断反应:
2H2+O2=2H2O 是放热反应吗?
1.定义: 表示化学反应中放出或吸收的热量的化学方程式称为热化学方程式。
表达化学反应中的热量变化
CaCO3(s) = CaO(s) + CO2(g) △H = + 178.5kJ/mol
不仅表明了化学反应中的物质变化,也表明了化学反应中的热量变化
二、热化学方程式
2.意义:
1. 2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
2. H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
3. 2H2O(l) =2H2(g) + O2(g) △H = + 571.6 kJ /mol
4. H2(g) +1/2 O2(g) =H2O(g) △H =-241.8 kJ /mol
仔细观察分析所给四个热化学方程式,找出热化学方程式与化学方程式的差别
交流与讨论
(1)既表示物质变化,又表示能量变化(反应热)。
(2)反应物和生成物均标明了聚集状态,用g、l、s、aq分别代表气态、液态、固态、水溶液。
(3)反应体系的温度和压强要注明。
(4)省略反应条件、沉淀符号↓、气体符号↑。
(5)化学计量数可以是整数或分数。
(6)△H表示反应热,“—”表示放热,“+”表示吸热△H 的值与计量数成正比,单位始终为kJ/mol。
3.书写热化学方程式的注意事项:
你学会了吗?
已知1g氢气和氧气反应生成液态的水放出143kJ的能量,写出该反应的热化学方程式。
课堂巩固
1. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
2. 下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
3.已知每1mol碳在氧气中完全燃烧生成二氧化碳时,放出393.5kJ热量,请写出该反应的热化学方程式?
4.已知每1molSO2在气体氧气中完全燃烧生成SO3气体时,放出98.3kJ热量,请写出该反应的热化学方程式?
5.对热化学方程式H2(g)+ I2(g)=2HI(g);△H =
+26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需
吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量
