高一 苏教化学必修2专题2第三单元 化学能与电能的转化 课件 (共15张PPT)
文档属性
| 名称 | 高一 苏教化学必修2专题2第三单元 化学能与电能的转化 课件 (共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 874.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-03 20:24:53 | ||
图片预览






文档简介
(共15张PPT)
*
*
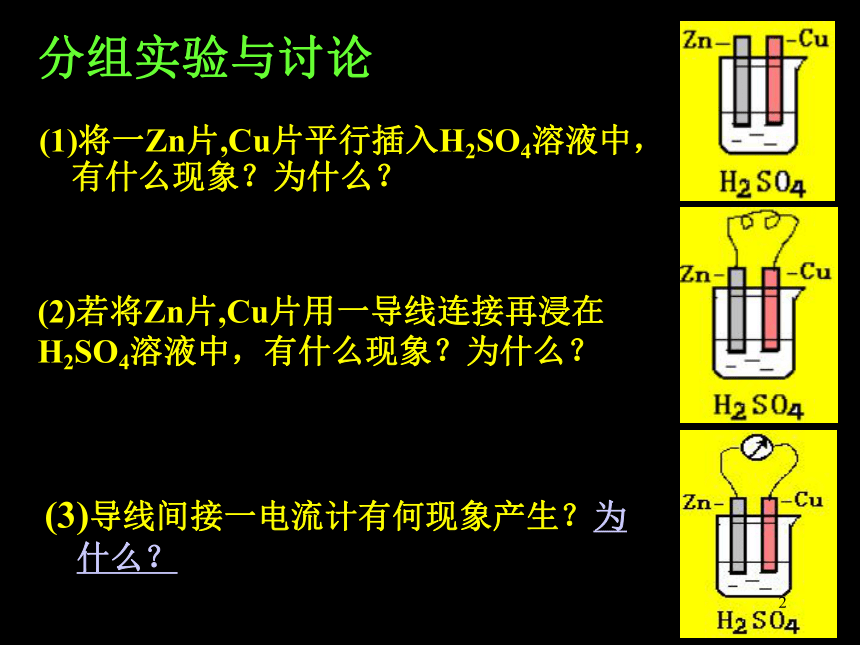
(2)若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?
(3)导线间接一电流计有何现象产生?为什么?
(1)将一Zn片,Cu片平行插入H2SO4溶液中,有什么现象?为什么?
分组实验与讨论
*
*
讨论:怎样才能制作出一个原电池?
*
*
1 .原电池
-----把化学能转变为电能的装置
2.构成原电池的条件
(1)有两个相连的电极
?导体;
?相连的形式可以多种多样的;
?电极材料可以多种多样。
两种活泼性不同的金属
一种金属与一种非金属(如石墨)
*
*
(3)在电极表面上能发生自发进行的氧化还原反应。
(必定是放热反应)
正极、负极、电解质溶液构成闭合回路
(2)两电极都接触电解质溶液(酸、碱、盐)
把化学能转化为电能的装置。
闭合电路
电极相连
接触电解质溶液
自发的氧化还原反应分两处进行
*
*
3、简单原电池的正负极和电子流向如何判断?
负极(–):
电 子
电 流
(相对不活泼金属或非金属)
正极(+):
(相对活泼金属)
失去电子
发生氧化反应
得到电子
要用到金属活动性顺序表:
注意:
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au…
活泼性,还原性依次 减弱。
发生还原反应
思考:将Mg片、Al片用导线连接,分别平行插入盛有HCl溶液和NaOH溶液的烧杯中,形成原电池,判断电极的正负极?
不活泼是相对的,活泼也是相对的
*
*
4、原电池的工作原理
1800年3月20第一个“人造电源”--- 伏打电池问世
*
*
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e- ,沿导线传递,有电流产生
还原反应
2H++2e- =H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
*
*
1。判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称
*
*
2. X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为
_________________
Z>Y>X>W
*
*
她的病因是什么?
*格林太太,漂亮、开朗、乐观,身体健康,脸上有着“永恒的微笑”。只是她在开怀大笑的时候,人们才可以发现她一口整齐而洁白的牙齿中镶有两颗假牙:其中一颗是黄金的—这是格林太太富有的标志;另一颗是不锈钢做的—这是一次车祸后留下的痕迹。令人百思不解的是,打从车祸以后,格林太太经常头痛,夜间失眠,心情烦躁……
能为她开一个处方吗?
*
*
市场上出售的“热敷袋”,其主要成分是:铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前,需要塑料袋与空气隔绝。使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出。当使用完后还会发现有铁锈生成。
热敷袋
思考下列问题:
(1)热敷袋产生的热量来源是?
(2)炭粉的主要作用是 ?
(3)加入NaCl的作用是 ?
*
*
本节要点:
1,原电池概念。
2,构成原电池的条件。
3,原电池的正负极和电子流向判断。
4,原电池的工作原理。
小 结
*
*
②正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
③原电池反应跟直接反应差别:
反应速率加快;一般只有一个电极直接参加反应。
①原电池的工作原理是将氧化还原反应分在正(氧化)、负(还原)两极进行,负极上失去的电子流入正极,从而产生电流。
明确以下几点
④利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。
*
*
作业
利用家庭常见用品自制一个水果电池
*
*
*
*
(2)若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?
(3)导线间接一电流计有何现象产生?为什么?
(1)将一Zn片,Cu片平行插入H2SO4溶液中,有什么现象?为什么?
分组实验与讨论
*
*
讨论:怎样才能制作出一个原电池?
*
*
1 .原电池
-----把化学能转变为电能的装置
2.构成原电池的条件
(1)有两个相连的电极
?导体;
?相连的形式可以多种多样的;
?电极材料可以多种多样。
两种活泼性不同的金属
一种金属与一种非金属(如石墨)
*
*
(3)在电极表面上能发生自发进行的氧化还原反应。
(必定是放热反应)
正极、负极、电解质溶液构成闭合回路
(2)两电极都接触电解质溶液(酸、碱、盐)
把化学能转化为电能的装置。
闭合电路
电极相连
接触电解质溶液
自发的氧化还原反应分两处进行
*
*
3、简单原电池的正负极和电子流向如何判断?
负极(–):
电 子
电 流
(相对不活泼金属或非金属)
正极(+):
(相对活泼金属)
失去电子
发生氧化反应
得到电子
要用到金属活动性顺序表:
注意:
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au…
活泼性,还原性依次 减弱。
发生还原反应
思考:将Mg片、Al片用导线连接,分别平行插入盛有HCl溶液和NaOH溶液的烧杯中,形成原电池,判断电极的正负极?
不活泼是相对的,活泼也是相对的
*
*
4、原电池的工作原理
1800年3月20第一个“人造电源”--- 伏打电池问世
*
*
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e- ,沿导线传递,有电流产生
还原反应
2H++2e- =H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
*
*
1。判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称
*
*
2. X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为
_________________
Z>Y>X>W
*
*
她的病因是什么?
*格林太太,漂亮、开朗、乐观,身体健康,脸上有着“永恒的微笑”。只是她在开怀大笑的时候,人们才可以发现她一口整齐而洁白的牙齿中镶有两颗假牙:其中一颗是黄金的—这是格林太太富有的标志;另一颗是不锈钢做的—这是一次车祸后留下的痕迹。令人百思不解的是,打从车祸以后,格林太太经常头痛,夜间失眠,心情烦躁……
能为她开一个处方吗?
*
*
市场上出售的“热敷袋”,其主要成分是:铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前,需要塑料袋与空气隔绝。使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出。当使用完后还会发现有铁锈生成。
热敷袋
思考下列问题:
(1)热敷袋产生的热量来源是?
(2)炭粉的主要作用是 ?
(3)加入NaCl的作用是 ?
*
*
本节要点:
1,原电池概念。
2,构成原电池的条件。
3,原电池的正负极和电子流向判断。
4,原电池的工作原理。
小 结
*
*
②正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
③原电池反应跟直接反应差别:
反应速率加快;一般只有一个电极直接参加反应。
①原电池的工作原理是将氧化还原反应分在正(氧化)、负(还原)两极进行,负极上失去的电子流入正极,从而产生电流。
明确以下几点
④利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。
*
*
作业
利用家庭常见用品自制一个水果电池
*
*
