课题1 常见的酸和碱——常见的酸 课件(共24张PPT)
文档属性
| 名称 | 课题1 常见的酸和碱——常见的酸 课件(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-03 22:11:42 | ||
图片预览








文档简介
(共24张PPT)
第十单元 酸和碱
(第2课时)
1.几种常见的酸
观察浓硫酸和浓盐酸的颜色和状态;比较它们与同体积水的质量大小;打开瓶塞,观察发生的现象;闻一闻是否有气味?
无色液体
无色黏稠、
油状液体
有白雾出现
无现象
有刺激性气味
无气味
1.19g/mL
1.84g/mL
(难挥发)
98%
37%
浓盐酸 浓硫酸
颜色状态
打开瓶盖后的现象
气 味
密 度
溶质的质量分数
盐酸的用途
人体胃液中含有盐酸,可帮助消化。
硫酸的用途
浓硫酸有吸水性,在实验室中常用它作干燥剂。
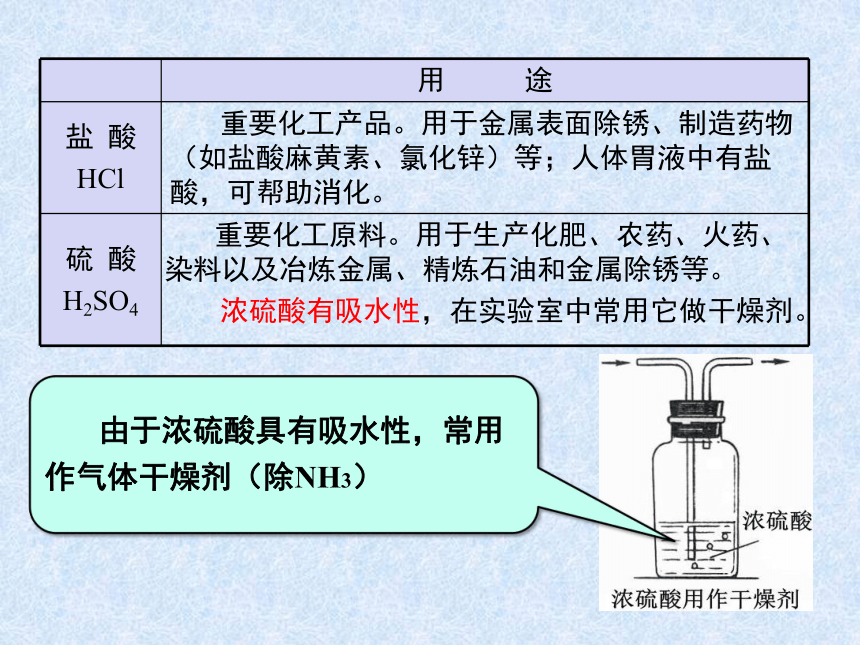
用 途
盐 酸
HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸
H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
思考: 如果不小心将浓硫酸和浓盐酸露置于空气中很长时间,你能从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?
不变
变小
变大
不变
变小
变小
变大
变小
溶质 溶剂 溶液 溶质的
质量分数
浓硫酸
浓盐酸
在实验室和化工生产中常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。另外,生活中常见的许多物质中也含有酸。
2.浓硫酸的腐蚀性
浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的“水分” ( 氢、氧元素 )生成黑色的炭和水。
化学变化
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
滴有浓硫酸的部位变黑甚至烧成洞
为什么会产生这些现象?你受到哪些启发?
实 验 放置一会儿后的现象 脱水性
“白水”写黑字
木棍变黑
水滴布穿
如何稀释浓硫酸?
发热或烫
浓硫酸溶于水放出大量的热
【实验10-4】将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅拌,并用手触碰烧杯外壁,有什么感觉?
手的感觉
分 析
在稀释浓硫
酸时,一定要把
浓硫酸沿器壁慢
慢注入水里,并
不断搅拌。切不
可将水倒入浓硫
酸。
注意
如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?
应立即用大量水冲洗,然后涂上3%—5%的碳酸氢钠溶液。
用大量的水冲洗。
三、酸的化学性质
活动与探究
(1) 酸溶液能与指示剂反应:
变红色
变红色
不变色
不变色
结论:
石蕊试液遇酸溶液变成红色,酚酞试液遇酸溶液不变色。
加紫色
石蕊溶液 加无色
酚酞溶液
稀盐酸
稀硫酸
(2)酸溶液与活泼金属反应:(请回忆并填表)
Mg+2HCl=MgCl2 +H2 ↑
Zn+2HCl=ZnCl2 +H2 ↑
Fe+2HCl=FeCl2 +H2↑
Mg+H2SO4=MgSO4+H2 ↑
Zn+H2SO4=ZnSO4+H2 ↑
Fe+H2SO4=FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
结论:
酸 + 活泼金属 → 盐 + 氢气
注意:
(1)酸:指HCl、稀硫酸
(2)活泼金属 :指金属活动顺序表中,H前的金属
(3)铁+酸:生成浅绿色的亚铁盐(+2价)
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
(3)酸溶液与金属氧化物反应:
①铁锈逐渐溶解
②溶液由无色溶液变黄色
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:①上面反应的生成物有什么共同之处?
上述反应的生成物之一都是水,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 金属氧化物→盐 + 水
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
不能长时间浸在酸中,因为酸会与金属继续反应,造成金属制品的腐蚀。
讨论:②出去金属制品表面的铁锈时,能不能把生锈的金属长时间浸在酸溶液中?
思考:
硫酸厂有一辆运输过浓硫酸的铁罐车(常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应),某新上岗的工人违反操作规定,边吸烟边用水冲洗该铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因?
稀盐酸和稀硫酸相似的化学性质:
③稀硫酸、盐酸都能与金属氧化物
反应,并生成水
①稀硫酸、稀盐酸都能与指示剂作用
②稀硫酸、稀盐酸都能与活动性较强
的金属发生置换反应,放出氢气
酸的化学性质
小 结
④
⑤
盐酸和硫酸为什么有这些相似的化学性质?
交流讨论
练习:
1.如图所示.密闭容器中盛有甲、乙两烧杯,乙烧杯中盛有紫色石蕊试液,当甲烧杯中盛有下列何种试剂时,过一会儿乙烧杯中石蕊试液由紫色变为红色 ( )
A.浓硫酸 B.氢氧化钠溶液
C.浓盐酸 D.氨水
2.如上图所示.密闭容器中盛有甲、乙两烧杯,乙烧杯中盛有无色酚酞试液,当甲烧杯中盛有下列何种试剂时,过一会儿乙烧杯中酚酞试液由无色变为红色 ( )
C
D
练习:
3.下列叙述错误的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
4.下列物质可以利用金属和稀盐酸直接制取的是( )
A.MgCl2 B.FeCl2 C.CuCl2 D.FeCl3
×
A
铜与盐酸不反应
生成FeCl2
AB
练习:
5.初中化学教材中常用下列词语描述物质的性质:a.氧化性 b.还原性 c.可燃性 d.毒性 e.吸水性 f.溶解性 g.酸碱性 h.腐蚀性
请你选择合理的序号(a--h)填写下列空格:
⑴浓硫酸可用作干燥剂,是因为它有___;
⑵氢气可用高能燃料,是因为它有____; ⑶氧气在燃烧反应中一般表现出_____;
⑷用CO冶炼铁,是利用它的_____;
⑸石蕊和酚酞可用来检验溶液的_____; ⑹H2SO4和HCl等对人的皮肤有____。
e
c
a
b
g
h
1.指示剂遇到酸和碱的颜色变化是什么?
遇酸变红,遇碱变蓝
遇酸不变色,遇碱变红色
2.浓盐酸和浓硫酸的物理性质及用途。
3.浓硫酸的腐蚀性及其稀释。
4 .酸的化学性质。
课堂小结
第十单元 酸和碱
(第2课时)
1.几种常见的酸
观察浓硫酸和浓盐酸的颜色和状态;比较它们与同体积水的质量大小;打开瓶塞,观察发生的现象;闻一闻是否有气味?
无色液体
无色黏稠、
油状液体
有白雾出现
无现象
有刺激性气味
无气味
1.19g/mL
1.84g/mL
(难挥发)
98%
37%
浓盐酸 浓硫酸
颜色状态
打开瓶盖后的现象
气 味
密 度
溶质的质量分数
盐酸的用途
人体胃液中含有盐酸,可帮助消化。
硫酸的用途
浓硫酸有吸水性,在实验室中常用它作干燥剂。
用 途
盐 酸
HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸
H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
思考: 如果不小心将浓硫酸和浓盐酸露置于空气中很长时间,你能从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?
不变
变小
变大
不变
变小
变小
变大
变小
溶质 溶剂 溶液 溶质的
质量分数
浓硫酸
浓盐酸
在实验室和化工生产中常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。另外,生活中常见的许多物质中也含有酸。
2.浓硫酸的腐蚀性
浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的“水分” ( 氢、氧元素 )生成黑色的炭和水。
化学变化
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
滴有浓硫酸的部位变黑甚至烧成洞
为什么会产生这些现象?你受到哪些启发?
实 验 放置一会儿后的现象 脱水性
“白水”写黑字
木棍变黑
水滴布穿
如何稀释浓硫酸?
发热或烫
浓硫酸溶于水放出大量的热
【实验10-4】将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅拌,并用手触碰烧杯外壁,有什么感觉?
手的感觉
分 析
在稀释浓硫
酸时,一定要把
浓硫酸沿器壁慢
慢注入水里,并
不断搅拌。切不
可将水倒入浓硫
酸。
注意
如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?
应立即用大量水冲洗,然后涂上3%—5%的碳酸氢钠溶液。
用大量的水冲洗。
三、酸的化学性质
活动与探究
(1) 酸溶液能与指示剂反应:
变红色
变红色
不变色
不变色
结论:
石蕊试液遇酸溶液变成红色,酚酞试液遇酸溶液不变色。
加紫色
石蕊溶液 加无色
酚酞溶液
稀盐酸
稀硫酸
(2)酸溶液与活泼金属反应:(请回忆并填表)
Mg+2HCl=MgCl2 +H2 ↑
Zn+2HCl=ZnCl2 +H2 ↑
Fe+2HCl=FeCl2 +H2↑
Mg+H2SO4=MgSO4+H2 ↑
Zn+H2SO4=ZnSO4+H2 ↑
Fe+H2SO4=FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
结论:
酸 + 活泼金属 → 盐 + 氢气
注意:
(1)酸:指HCl、稀硫酸
(2)活泼金属 :指金属活动顺序表中,H前的金属
(3)铁+酸:生成浅绿色的亚铁盐(+2价)
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
(3)酸溶液与金属氧化物反应:
①铁锈逐渐溶解
②溶液由无色溶液变黄色
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:①上面反应的生成物有什么共同之处?
上述反应的生成物之一都是水,另一生成物是金属离子与酸根离子构成的化合物(盐)
酸 + 金属氧化物→盐 + 水
现 象 化学方程式
铁锈+盐酸
铁锈+硫酸
不能长时间浸在酸中,因为酸会与金属继续反应,造成金属制品的腐蚀。
讨论:②出去金属制品表面的铁锈时,能不能把生锈的金属长时间浸在酸溶液中?
思考:
硫酸厂有一辆运输过浓硫酸的铁罐车(常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应),某新上岗的工人违反操作规定,边吸烟边用水冲洗该铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因?
稀盐酸和稀硫酸相似的化学性质:
③稀硫酸、盐酸都能与金属氧化物
反应,并生成水
①稀硫酸、稀盐酸都能与指示剂作用
②稀硫酸、稀盐酸都能与活动性较强
的金属发生置换反应,放出氢气
酸的化学性质
小 结
④
⑤
盐酸和硫酸为什么有这些相似的化学性质?
交流讨论
练习:
1.如图所示.密闭容器中盛有甲、乙两烧杯,乙烧杯中盛有紫色石蕊试液,当甲烧杯中盛有下列何种试剂时,过一会儿乙烧杯中石蕊试液由紫色变为红色 ( )
A.浓硫酸 B.氢氧化钠溶液
C.浓盐酸 D.氨水
2.如上图所示.密闭容器中盛有甲、乙两烧杯,乙烧杯中盛有无色酚酞试液,当甲烧杯中盛有下列何种试剂时,过一会儿乙烧杯中酚酞试液由无色变为红色 ( )
C
D
练习:
3.下列叙述错误的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
4.下列物质可以利用金属和稀盐酸直接制取的是( )
A.MgCl2 B.FeCl2 C.CuCl2 D.FeCl3
×
A
铜与盐酸不反应
生成FeCl2
AB
练习:
5.初中化学教材中常用下列词语描述物质的性质:a.氧化性 b.还原性 c.可燃性 d.毒性 e.吸水性 f.溶解性 g.酸碱性 h.腐蚀性
请你选择合理的序号(a--h)填写下列空格:
⑴浓硫酸可用作干燥剂,是因为它有___;
⑵氢气可用高能燃料,是因为它有____; ⑶氧气在燃烧反应中一般表现出_____;
⑷用CO冶炼铁,是利用它的_____;
⑸石蕊和酚酞可用来检验溶液的_____; ⑹H2SO4和HCl等对人的皮肤有____。
e
c
a
b
g
h
1.指示剂遇到酸和碱的颜色变化是什么?
遇酸变红,遇碱变蓝
遇酸不变色,遇碱变红色
2.浓盐酸和浓硫酸的物理性质及用途。
3.浓硫酸的腐蚀性及其稀释。
4 .酸的化学性质。
课堂小结
同课章节目录
