金属活动性顺序应用专题复习 课件(23张PPT)
文档属性
| 名称 | 金属活动性顺序应用专题复习 课件(23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 310.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-04 11:39:35 | ||
图片预览






文档简介
(共23张PPT)
人教五·四学制2011课标版
第八单元 金属和金属材料
单元复习
金属活动性顺序的应用
专题复习——
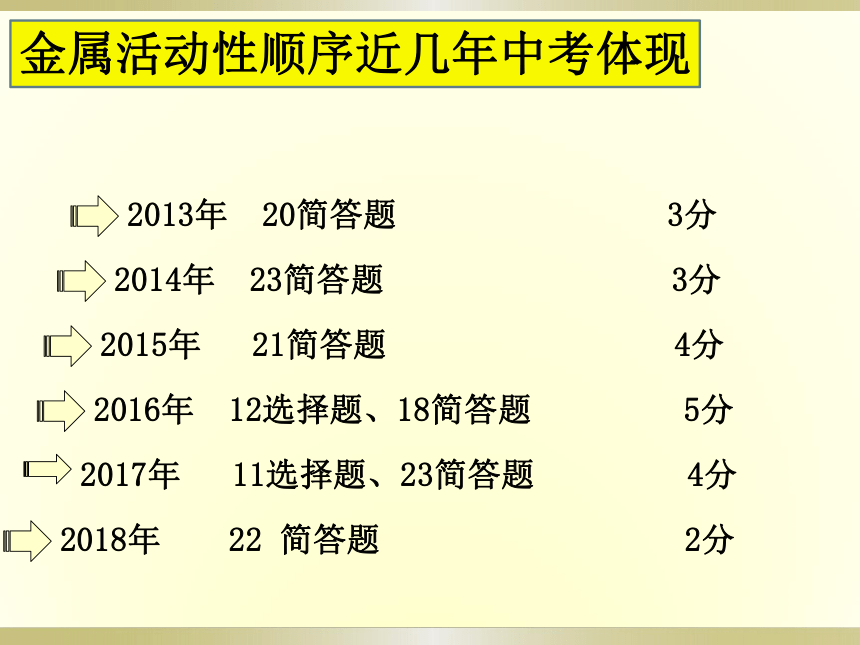
2013年 20简答题 3分
2014年 23简答题 3分
2015年 21简答题 4分
2016年 12选择题、18简答题 5分
2017年 11选择题、23简答题 4分
2018年 22 简答题 2分
金属活动性顺序近几年中考体现
1、能熟练运用金属活动顺序判断金属跟酸能否发生置换反应及其反应的快慢;
2、能熟练判断金属跟盐溶液能否发生置换反应及相关反应产物的分析;
3、能够设计实验探究金属活动性顺序;
学习目标
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由
强逐渐减弱
知识回顾:金属活动性顺序
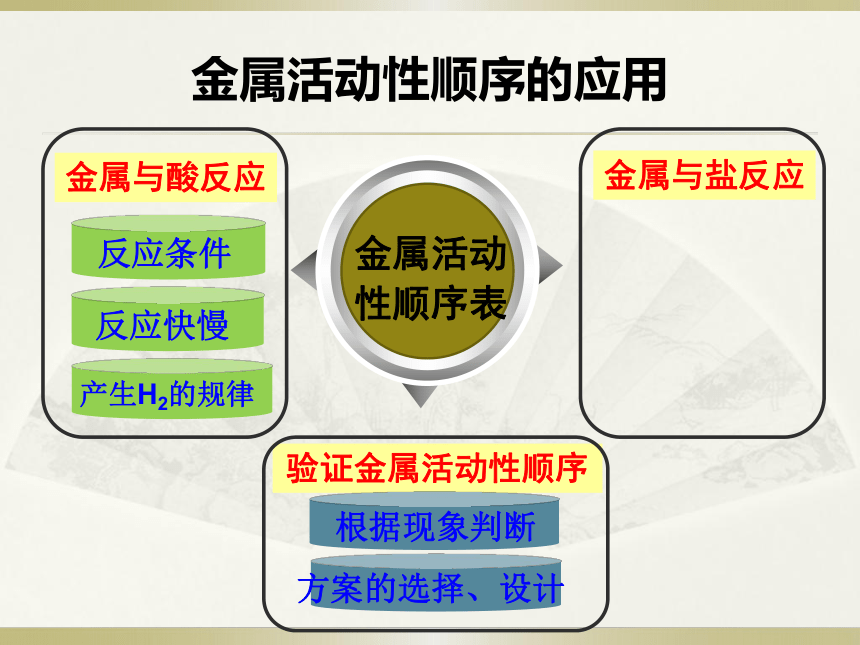
金属活动性顺序的应用
金属与酸反应
金属活动性顺序表
金属与盐反应
验证金属活动性顺序
根据现象判断
方案的选择、设计
1.X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将X和Z浸入硝酸银溶液中,X表面有银析出而Z无变化。
①判断X、Y、Z和银四种金属的活动性由强到弱的顺序。
②具体确定一种X后,写出X与硝酸银溶液反应的化学方程式
Y > X > Ag> Z
Cu+2AgNO3=2Ag+Cu(NO3)2
一、验证金属活动性顺序
考点:在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;位于氢前面的金属能置换出盐酸、稀硫酸中的氢;前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来。
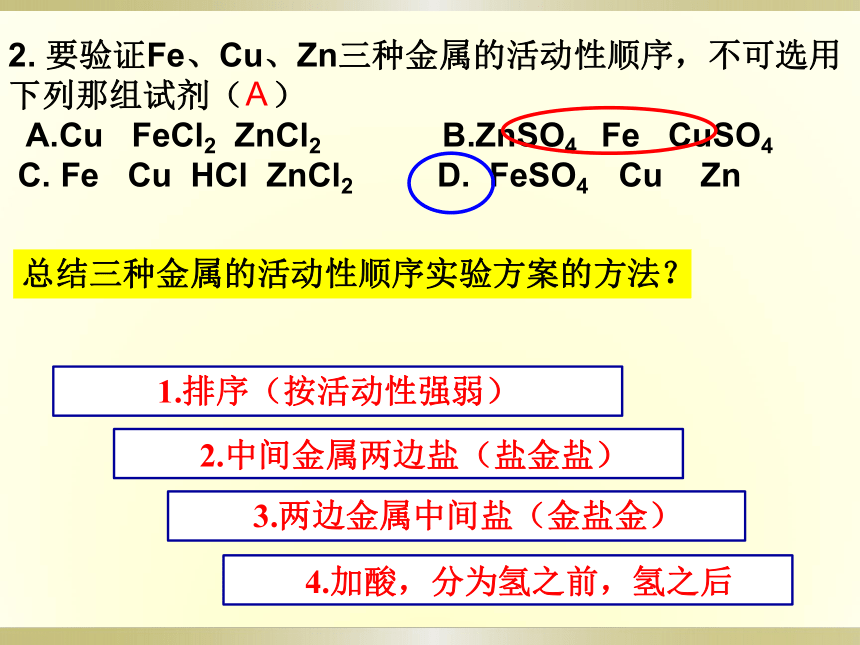
2. 要验证Fe、Cu、Zn三种金属的活动性顺序,不可选用下列那组试剂( )
A.Cu FeCl2 ZnCl2 B.ZnSO4 Fe CuSO4
C. Fe Cu HCl ZnCl2 D. FeSO4 Cu Zn
A
1.排序(按活动性强弱)
2.中间金属两边盐(盐金盐)
3.两边金属中间盐(金盐金)
4.加酸,分为氢之前,氢之后
总结三种金属的活动性顺序实验方案的方法?
金属活动性顺序的应用
反应条件
反应快慢
产生H2的规律
金属与酸反应
金属活动性顺序表
金属与盐反应
验证金属活动性顺序
根据现象判断
方案的选择、设计
金属 + 酸
氢前金属
(钾钙钠除外)
盐酸、稀硫酸
特别注意:铁生成亚铁盐
应用一、金属与酸反应
盐 + 氢气
二、金属与酸反应
1.能由金属跟稀硫酸直接反应制得的物质是
A. CuSO4 B. ZnSO4 C. Al(NO3)3 D. Fe2(SO4)3
B
考点1
2,将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成氢气的质量与反应时间的关系如图所示。根据下图中所提供的信息,得出的结论正确的是(已知:在生成物中均为+2价) ( )
A.放出H2的质量是A>B>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是A>B>C
A
(1)等质量的金属跟足量的酸反应(金属反应完)
金属(+2价)的相对原子质量越小,生成氢气____。曲线越陡,反应速率越快,金属的活动性____。
越强
越多
考点2:产生H2的规律(图像关系)
A
C
)
A
B
C
反应时间
判断:
1 活动性最强的金属是
2 活动性最弱的金属是
3 反应速率最快的是
(
(
)
生
成
H2
质
量
(2)等质量的酸跟足量的金属反应(酸反应完)
1.曲线越陡,反应速率越快,金属的活动性越强。
2. 产生的氢气一样多。
(
)
A
3.相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是( )
D
4. 向等质量、等浓度的稀盐酸反应,分别逐渐加入镁粉和铁粉,请绘制生成H2的质量和金属的质量的关系图
2011.南昌市中考题
注意:一定要分清图像X、Y轴所表示的意义。
金属质量
合作探究
金属活动性顺序的应用
反应条件
反应快慢
产生H2的规律
反应条件
滤渣滤液的成分
金属与酸反应
金属活动性顺序表
与混合盐溶液反应
金属与盐反应
验证金属活动性顺序
根据现象判断
方案的选择、设计
B
1.下列反应的化学方程式中,正确的是
A. Cu+2AgCl=2Ag+CuCl2
B. Zn+2AgNO3=2Ag+Zn(NO3)2
C. 2Na+CuSO4=Cu+Na2SO4
D. 2Fe+3CuCl2=2FeCl3+3Cu
三、金属与盐溶液反应
考点1
金属 + 盐
新金属 + 新盐
前换后
(钾钙钠除外)
可溶盐
特别注意:铁生成亚铁盐
考点2、 判断金属与盐溶液反应后滤液、滤渣成分的判断。
3. 在CuCl2和ZnCl2 的混合溶液中,加入一定量的铁粉,充分反应后过滤,推测所得固体成分。
2. 在CuCl2和ZnCl2 的混合溶液中,加入过量的铁粉,充分反应后过滤,所得固体为 。
Cu、Fe
一定有Cu、可能有Fe
4. 探究实验:分别将不同量的锌加入到一定量的Mg(NO3)2、Cu(NO3)2、AgNO3混合溶液中,充分反应后过滤,以下是不同情况下对固体或滤液成分的探究。
滤液中有AgNO3时,一定也有Cu(NO3)2,因为锌先与AgNO3反应
后与Cu(NO3)2反应。
③ 猜想滤液滤渣的成分可能有哪些?(合作探究)
Zn、Cu、Ag
滤液
滤渣
加入Zn的量
Mg(NO3)2
Zn(NO3)2
Cu(NO3)2
AgNO3
Zn、Cu、Ag
Ag、Cu
Ag
Ag
Ag、Cu
Mg(NO3)2
Zn(NO3)2
Mg(NO3)2
Zn(NO3)2
Cu(NO3)2
Mg(NO3)2
Zn(NO3)2
Cu(NO3)2
Mg(NO3)2
Zn(NO3)2
①若向所得固体上滴加盐酸,有气泡产生,则该固体含有的金属为 。
②猜想:滤液中含有的溶质为Mg(NO3)2、Zn(NO3)2、AgNO3,请分析该猜想不合理的原因。
(2017B)11.(1分)下列验证Zn、Cu、Ag 三种金属活动性顺序的试剂不正确的一组是 【 】
A.Zn(NO3)2溶液、Cu、AgNO3溶液
B.Zn、Ag、CuSO4溶液
C.Zn、Cu、H2SO4、AgNO3溶液
D.Zn、Cu、AgNO3溶液
直击中考-快速做答
(2015)21.(1分)农业上不能用铁制容器配制波尔多液(含硫酸铜),请用化学方程式解释。
D
Fe+CuSO4=Cu+FeSO4
(2016)12.(1分)相同质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气质量(直接用各金属表示)大小关系有以下几种猜测:①Mg>Al>Zn;
②Al>Mg>Zn;③Al=Mg=Zn;④Al=Mg>Zn;⑤Al=Zn>Mg;⑥Al>Mg=Zn。其中合理的个数为
A.5个 B.4个 C.3个 D. 2个
C
1、当HCl量在0-M 1之间,产生氢气质量相等。
2、当HCl量在M 1 -M 2之间,产生氢气质量铝=镁>锌。
3、当HCl量大于M 2时,产生氢气质量铝> 镁>锌。
(2017)23.(3分)在一定质量Cu(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入过量的Zn,充分反应后,过滤,得到固体和溶液。
(1)请写出一个有关反应的化学方程式。
(2)向所得固体上滴加盐酸,可观察到什么现象?
(3)反应后所得溶液的质量与反应前相比,可能保持不变,为什么?
(1)Zn+2AgNO3=Zn(NO3)2+2Ag(或 Zn+Cu(NO3)2=Zn(NO3)2+Cu)?
(2)有气泡产生??
(3)锌与硝酸银反应使溶液质量减少,与硝酸铜反应时使溶液质量增加,所以溶液质量可能不变。?
(2017B)22.(3分)向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图。请回答:
(1)写出a点所发生反应的化学方程式。
(2)d 点对应的溶液中的金属离子有哪些?
(3)当加入锌的质量在b g~c g时,溶液的质量为什么会增加?
24.(1)4 (2)Al3+、Zn2+
(3)当加入锌的质量在b g~c g时,参加反应的溶质硝酸铜的质量小于生成物硝酸锌的质量,所以溶液的质量增加
(2018)22.(2分)将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液
和固体。
(1)写出会导致溶液质量变小的有关反应的化学方程式。
(2)若所得溶液中只含有一种溶质,请分析所得固体的成分。
Zn+2AgNO3=Zn(NO3)2+2Ag
一定含有Ag和Cu,可能含有Zn
人教五·四学制2011课标版
第八单元 金属和金属材料
单元复习
金属活动性顺序的应用
专题复习——
2013年 20简答题 3分
2014年 23简答题 3分
2015年 21简答题 4分
2016年 12选择题、18简答题 5分
2017年 11选择题、23简答题 4分
2018年 22 简答题 2分
金属活动性顺序近几年中考体现
1、能熟练运用金属活动顺序判断金属跟酸能否发生置换反应及其反应的快慢;
2、能熟练判断金属跟盐溶液能否发生置换反应及相关反应产物的分析;
3、能够设计实验探究金属活动性顺序;
学习目标
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由
强逐渐减弱
知识回顾:金属活动性顺序
金属活动性顺序的应用
金属与酸反应
金属活动性顺序表
金属与盐反应
验证金属活动性顺序
根据现象判断
方案的选择、设计
1.X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将X和Z浸入硝酸银溶液中,X表面有银析出而Z无变化。
①判断X、Y、Z和银四种金属的活动性由强到弱的顺序。
②具体确定一种X后,写出X与硝酸银溶液反应的化学方程式
Y > X > Ag> Z
Cu+2AgNO3=2Ag+Cu(NO3)2
一、验证金属活动性顺序
考点:在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;位于氢前面的金属能置换出盐酸、稀硫酸中的氢;前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来。
2. 要验证Fe、Cu、Zn三种金属的活动性顺序,不可选用下列那组试剂( )
A.Cu FeCl2 ZnCl2 B.ZnSO4 Fe CuSO4
C. Fe Cu HCl ZnCl2 D. FeSO4 Cu Zn
A
1.排序(按活动性强弱)
2.中间金属两边盐(盐金盐)
3.两边金属中间盐(金盐金)
4.加酸,分为氢之前,氢之后
总结三种金属的活动性顺序实验方案的方法?
金属活动性顺序的应用
反应条件
反应快慢
产生H2的规律
金属与酸反应
金属活动性顺序表
金属与盐反应
验证金属活动性顺序
根据现象判断
方案的选择、设计
金属 + 酸
氢前金属
(钾钙钠除外)
盐酸、稀硫酸
特别注意:铁生成亚铁盐
应用一、金属与酸反应
盐 + 氢气
二、金属与酸反应
1.能由金属跟稀硫酸直接反应制得的物质是
A. CuSO4 B. ZnSO4 C. Al(NO3)3 D. Fe2(SO4)3
B
考点1
2,将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成氢气的质量与反应时间的关系如图所示。根据下图中所提供的信息,得出的结论正确的是(已知:在生成物中均为+2价) ( )
A.放出H2的质量是A>B>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是A>B>C
A
(1)等质量的金属跟足量的酸反应(金属反应完)
金属(+2价)的相对原子质量越小,生成氢气____。曲线越陡,反应速率越快,金属的活动性____。
越强
越多
考点2:产生H2的规律(图像关系)
A
C
)
A
B
C
反应时间
判断:
1 活动性最强的金属是
2 活动性最弱的金属是
3 反应速率最快的是
(
(
)
生
成
H2
质
量
(2)等质量的酸跟足量的金属反应(酸反应完)
1.曲线越陡,反应速率越快,金属的活动性越强。
2. 产生的氢气一样多。
(
)
A
3.相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是( )
D
4. 向等质量、等浓度的稀盐酸反应,分别逐渐加入镁粉和铁粉,请绘制生成H2的质量和金属的质量的关系图
2011.南昌市中考题
注意:一定要分清图像X、Y轴所表示的意义。
金属质量
合作探究
金属活动性顺序的应用
反应条件
反应快慢
产生H2的规律
反应条件
滤渣滤液的成分
金属与酸反应
金属活动性顺序表
与混合盐溶液反应
金属与盐反应
验证金属活动性顺序
根据现象判断
方案的选择、设计
B
1.下列反应的化学方程式中,正确的是
A. Cu+2AgCl=2Ag+CuCl2
B. Zn+2AgNO3=2Ag+Zn(NO3)2
C. 2Na+CuSO4=Cu+Na2SO4
D. 2Fe+3CuCl2=2FeCl3+3Cu
三、金属与盐溶液反应
考点1
金属 + 盐
新金属 + 新盐
前换后
(钾钙钠除外)
可溶盐
特别注意:铁生成亚铁盐
考点2、 判断金属与盐溶液反应后滤液、滤渣成分的判断。
3. 在CuCl2和ZnCl2 的混合溶液中,加入一定量的铁粉,充分反应后过滤,推测所得固体成分。
2. 在CuCl2和ZnCl2 的混合溶液中,加入过量的铁粉,充分反应后过滤,所得固体为 。
Cu、Fe
一定有Cu、可能有Fe
4. 探究实验:分别将不同量的锌加入到一定量的Mg(NO3)2、Cu(NO3)2、AgNO3混合溶液中,充分反应后过滤,以下是不同情况下对固体或滤液成分的探究。
滤液中有AgNO3时,一定也有Cu(NO3)2,因为锌先与AgNO3反应
后与Cu(NO3)2反应。
③ 猜想滤液滤渣的成分可能有哪些?(合作探究)
Zn、Cu、Ag
滤液
滤渣
加入Zn的量
Mg(NO3)2
Zn(NO3)2
Cu(NO3)2
AgNO3
Zn、Cu、Ag
Ag、Cu
Ag
Ag
Ag、Cu
Mg(NO3)2
Zn(NO3)2
Mg(NO3)2
Zn(NO3)2
Cu(NO3)2
Mg(NO3)2
Zn(NO3)2
Cu(NO3)2
Mg(NO3)2
Zn(NO3)2
①若向所得固体上滴加盐酸,有气泡产生,则该固体含有的金属为 。
②猜想:滤液中含有的溶质为Mg(NO3)2、Zn(NO3)2、AgNO3,请分析该猜想不合理的原因。
(2017B)11.(1分)下列验证Zn、Cu、Ag 三种金属活动性顺序的试剂不正确的一组是 【 】
A.Zn(NO3)2溶液、Cu、AgNO3溶液
B.Zn、Ag、CuSO4溶液
C.Zn、Cu、H2SO4、AgNO3溶液
D.Zn、Cu、AgNO3溶液
直击中考-快速做答
(2015)21.(1分)农业上不能用铁制容器配制波尔多液(含硫酸铜),请用化学方程式解释。
D
Fe+CuSO4=Cu+FeSO4
(2016)12.(1分)相同质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气质量(直接用各金属表示)大小关系有以下几种猜测:①Mg>Al>Zn;
②Al>Mg>Zn;③Al=Mg=Zn;④Al=Mg>Zn;⑤Al=Zn>Mg;⑥Al>Mg=Zn。其中合理的个数为
A.5个 B.4个 C.3个 D. 2个
C
1、当HCl量在0-M 1之间,产生氢气质量相等。
2、当HCl量在M 1 -M 2之间,产生氢气质量铝=镁>锌。
3、当HCl量大于M 2时,产生氢气质量铝> 镁>锌。
(2017)23.(3分)在一定质量Cu(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入过量的Zn,充分反应后,过滤,得到固体和溶液。
(1)请写出一个有关反应的化学方程式。
(2)向所得固体上滴加盐酸,可观察到什么现象?
(3)反应后所得溶液的质量与反应前相比,可能保持不变,为什么?
(1)Zn+2AgNO3=Zn(NO3)2+2Ag(或 Zn+Cu(NO3)2=Zn(NO3)2+Cu)?
(2)有气泡产生??
(3)锌与硝酸银反应使溶液质量减少,与硝酸铜反应时使溶液质量增加,所以溶液质量可能不变。?
(2017B)22.(3分)向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图。请回答:
(1)写出a点所发生反应的化学方程式。
(2)d 点对应的溶液中的金属离子有哪些?
(3)当加入锌的质量在b g~c g时,溶液的质量为什么会增加?
24.(1)4 (2)Al3+、Zn2+
(3)当加入锌的质量在b g~c g时,参加反应的溶质硝酸铜的质量小于生成物硝酸锌的质量,所以溶液的质量增加
(2018)22.(2分)将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液
和固体。
(1)写出会导致溶液质量变小的有关反应的化学方程式。
(2)若所得溶液中只含有一种溶质,请分析所得固体的成分。
Zn+2AgNO3=Zn(NO3)2+2Ag
一定含有Ag和Cu,可能含有Zn
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
