实验活动6 酸、碱的化学性质 课件(16张PPT)
文档属性
| 名称 | 实验活动6 酸、碱的化学性质 课件(16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 17.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-04 16:22:50 | ||
图片预览






文档简介
(共16张PPT)
紫色石蕊遇酸变红,遇碱变蓝;
无色酚酞遇酸不变色,遇碱变红色。
性质1:酸、碱能与指示剂反应
真的没有托儿
酸、碱与指示剂
酸与金属、金属氧化物
探究酸与碱反应
学习目标
阅读学导案,并思考以下问题:
1.酸具有哪些化学性质?
2.实验过程的正确操作步骤及注意事项?
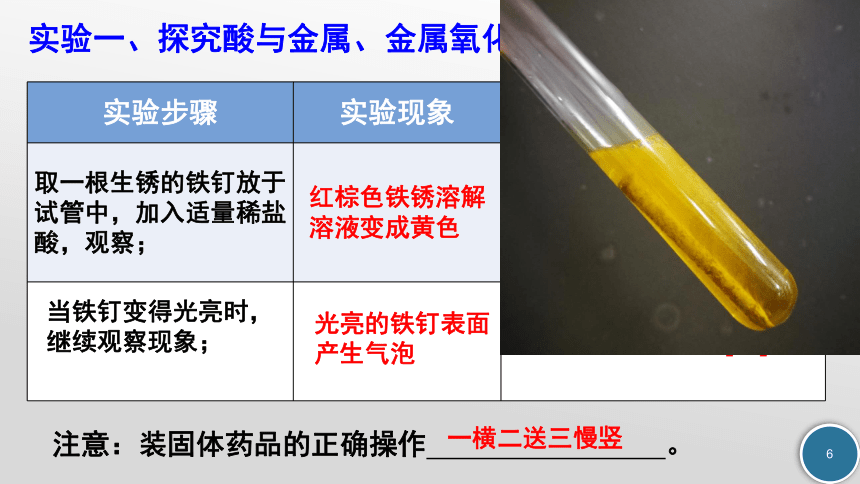
实验一、探究酸与金属、金属氧化物的作用
红棕色铁锈溶解
溶液变成黄色
光亮的铁钉表面产生气泡
6HCl+Fe2O3 ═ 2FeCl3+3H2O
Fe+2HCl ═ FeCl2+H2↑
注意:装固体药品的正确操作 。
一横二送三慢竖
实验步骤 实验现象 化学方程式
取一根生锈的铁钉放于试管中,加入适量稀盐酸,观察;
当铁钉变得光亮时,
继续观察现象;
2.在工业生产中用稀硫酸除铁锈时,能否把铁制品长时间浸泡在酸溶液中?为什么?
【联系生活】
1.生活中除铁锈可以选择厨房中的哪种物质?
【实验结论】
1.酸能与金属氧化物反应;
2.酸能与金属反应,排在氢前面的金属;
食醋
不能长时间泡在酸中,防止腐蚀铁制品
产生蓝色沉淀
蓝色沉淀溶解
【方案一】
二、探究酸和碱之间的反应
CuSO4+2NaOH ═ Cu(OH)2 + Na2SO4
Cu(OH)2+2HCl ═ CuCl2+H2O
【实验结论】
酸遇碱能发生反应,称之为中和反应
实验步骤 实验现象 实验原理
1.在试管中加入约2mL硫酸铜溶液,再滴入几滴NaOH溶液 ,观察;
2.再向试管中加入稀盐酸 ,观察;
溶液由红色
变无色
溶液由无色
变红色
【方案一】
实验二、探究酸和碱之间的反应
NaOH+HCl ═ NaCl+H2O
酚酞遇碱变红色
温馨提醒:胶头滴管的正确使用方式 。
垂直悬空滴加
实验步骤 实验现象 实验原理
1.在试管中加入适量的NaOH溶液,滴入几滴酚酞溶液,观察;
2.边用滴管逐滴滴入稀盐酸边不断振荡试管,至溶液颜色改变为止。
1、农业上改良酸性土壤;
2、工业上处理工业废水;
3、医疗上中和胃酸过多;
4、生活上中和蚊虫叮咬产生的蚁酸;
1.下列不属于中和反应在生活中应用的是( )
(若属于,请写出相应的化学反应方程式)
A.土壤酸化后(盐酸酸化)加入熟石灰改良
B.胃酸过多的病人服用某些含有Al(OH)3的药物
C.金属表面锈蚀后,可用稀盐酸清洗
D.用氢氧化钠溶液洗涤石油产品中的残余硫酸
C
酸能使紫色石蕊变红
酸
酸的化学性质
酸+碱 盐+水
酸+金属氧化物 盐+水
酸+金属 盐+氢气
2.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别逐滴滴加氢氧化钠稀溶液和稀盐酸。说法正确的是( )
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液 一定呈无色
C
3.右图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)A不可能是 。
A. Mg B. Fe
C. Ag D. Zn
(2)若B为铁锈的主要成分,B与盐酸反应的
实验现象为 ,
化学方程式为 。
(3) D与盐酸反应的化学方程式为 。
C
铁锈逐渐溶解,溶液由无色变成黄色
6HCl+Fe2O3══2FeCl3+3H2O
NaOH+HCl═NaCl+H2O
4.(2016·广东) 查阅资料可知,米酒味道变酸是因为米酒中产生的醋酸杆菌使乙醇(C2H5OH)和氧气发生反应生成了醋酸(CH3COOH)和另一种常见的液体。回答下列问题:
(1)食物变质是一种__________氧化反应(选填“剧烈”或“缓慢”)。
(2)米酒变酸的化学方程式为_________________________ ;
可用____________________ 验证米酒味道变酸生成了醋酸。
缓慢
酸碱指示剂或氢前金属
紫色石蕊遇酸变红,遇碱变蓝;
无色酚酞遇酸不变色,遇碱变红色。
性质1:酸、碱能与指示剂反应
真的没有托儿
酸、碱与指示剂
酸与金属、金属氧化物
探究酸与碱反应
学习目标
阅读学导案,并思考以下问题:
1.酸具有哪些化学性质?
2.实验过程的正确操作步骤及注意事项?
实验一、探究酸与金属、金属氧化物的作用
红棕色铁锈溶解
溶液变成黄色
光亮的铁钉表面产生气泡
6HCl+Fe2O3 ═ 2FeCl3+3H2O
Fe+2HCl ═ FeCl2+H2↑
注意:装固体药品的正确操作 。
一横二送三慢竖
实验步骤 实验现象 化学方程式
取一根生锈的铁钉放于试管中,加入适量稀盐酸,观察;
当铁钉变得光亮时,
继续观察现象;
2.在工业生产中用稀硫酸除铁锈时,能否把铁制品长时间浸泡在酸溶液中?为什么?
【联系生活】
1.生活中除铁锈可以选择厨房中的哪种物质?
【实验结论】
1.酸能与金属氧化物反应;
2.酸能与金属反应,排在氢前面的金属;
食醋
不能长时间泡在酸中,防止腐蚀铁制品
产生蓝色沉淀
蓝色沉淀溶解
【方案一】
二、探究酸和碱之间的反应
CuSO4+2NaOH ═ Cu(OH)2 + Na2SO4
Cu(OH)2+2HCl ═ CuCl2+H2O
【实验结论】
酸遇碱能发生反应,称之为中和反应
实验步骤 实验现象 实验原理
1.在试管中加入约2mL硫酸铜溶液,再滴入几滴NaOH溶液 ,观察;
2.再向试管中加入稀盐酸 ,观察;
溶液由红色
变无色
溶液由无色
变红色
【方案一】
实验二、探究酸和碱之间的反应
NaOH+HCl ═ NaCl+H2O
酚酞遇碱变红色
温馨提醒:胶头滴管的正确使用方式 。
垂直悬空滴加
实验步骤 实验现象 实验原理
1.在试管中加入适量的NaOH溶液,滴入几滴酚酞溶液,观察;
2.边用滴管逐滴滴入稀盐酸边不断振荡试管,至溶液颜色改变为止。
1、农业上改良酸性土壤;
2、工业上处理工业废水;
3、医疗上中和胃酸过多;
4、生活上中和蚊虫叮咬产生的蚁酸;
1.下列不属于中和反应在生活中应用的是( )
(若属于,请写出相应的化学反应方程式)
A.土壤酸化后(盐酸酸化)加入熟石灰改良
B.胃酸过多的病人服用某些含有Al(OH)3的药物
C.金属表面锈蚀后,可用稀盐酸清洗
D.用氢氧化钠溶液洗涤石油产品中的残余硫酸
C
酸能使紫色石蕊变红
酸
酸的化学性质
酸+碱 盐+水
酸+金属氧化物 盐+水
酸+金属 盐+氢气
2.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别逐滴滴加氢氧化钠稀溶液和稀盐酸。说法正确的是( )
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液 一定呈无色
C
3.右图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)A不可能是 。
A. Mg B. Fe
C. Ag D. Zn
(2)若B为铁锈的主要成分,B与盐酸反应的
实验现象为 ,
化学方程式为 。
(3) D与盐酸反应的化学方程式为 。
C
铁锈逐渐溶解,溶液由无色变成黄色
6HCl+Fe2O3══2FeCl3+3H2O
NaOH+HCl═NaCl+H2O
4.(2016·广东) 查阅资料可知,米酒味道变酸是因为米酒中产生的醋酸杆菌使乙醇(C2H5OH)和氧气发生反应生成了醋酸(CH3COOH)和另一种常见的液体。回答下列问题:
(1)食物变质是一种__________氧化反应(选填“剧烈”或“缓慢”)。
(2)米酒变酸的化学方程式为_________________________ ;
可用____________________ 验证米酒味道变酸生成了醋酸。
缓慢
酸碱指示剂或氢前金属
同课章节目录
