根据化学方程式的简单计算习题(课件 32张ppt)
文档属性
| 名称 | 根据化学方程式的简单计算习题(课件 32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-04-04 21:03:56 | ||
图片预览










文档简介
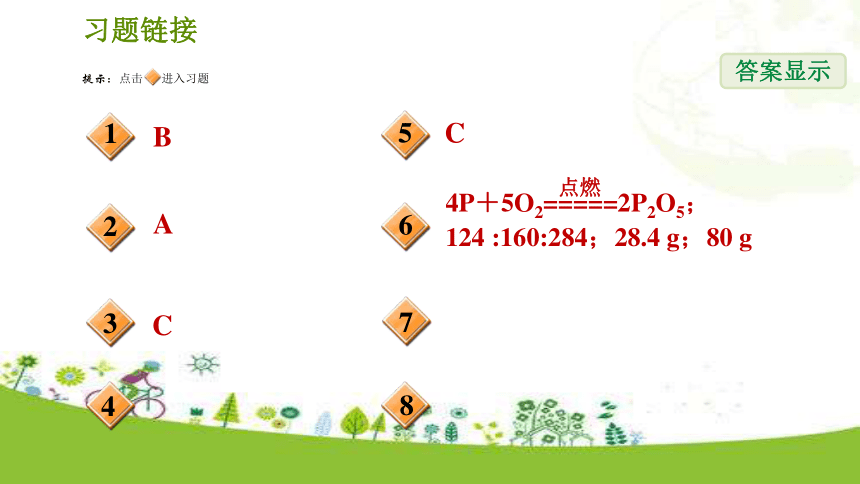
课件32张PPT。第4节 根据化学方程式的简单计算第一章 化学反应 华师版 九年级答案显示习题链接BACC答案显示习题链接DCB1.(中考?广州)从2H2+O2=====2H2O中获取的信息错误的是( )
A.在反应前后,元素的种类没有变化
B.在常温下氢气与氧气混合就可以发生反应
C.4 g氢气与32 g氧气完全反应,生成36 g水
D.在反应前后,氢原子和氧原子的数目都没有改变B【 解析】氢气和氧气的反应在点燃条件下才可以发生,故B错误。点燃2.关于化学方程式3Fe+2O2=====点燃Fe3O4,四位同学表达了如图所示的四种说法,其中错误的是( )【 解析】3:2:1不是质量比,是各物质的化学计量数之比,故A选项错误。【答案】A3.(中考?张家界)汽车安装使用催化净化装置是减少汽车尾气对空气污染的有效方法之一。其主要发生反应的化学方程式为:2NO+2CO=====2CO2+N2。下列对该化学反应的说法不正确的是( )
A.反应物都属于氧化物
B.该反应使有害气体转化为无害物质
C.反应前后元素的种类、原子和分子个数都不变
D.化学方程式中所表示的反应物和生成物中只有一种物质是单质催化剂C4.(中考?衡阳)化学方程式是重要的化学用语。观察化学方程式可得到很多信息。请你根据化学方程式:
4HNO3(浓)=====光照或△4NO2↑+O2↑+2H2O写出你得到的三点信息。
(1)_____________________________________________________________________________________________。反应物是浓硝酸,反应条件是光照或加热,生成物是二氧化氮、氧气、水4.(中考?衡阳)化学方程式是重要的化学用语。观察化学方程式可得到很多信息。请你根据化学方程式:
4HNO3(浓)=====光照或△4NO2↑+O2↑+2H2O写出你得到的三点信息。
(2)_____________________________________________________________________________________________。在光照或加热条件下,4个硝酸分子分解生成4个二氧化氮分子、1个氧分子和2个水分子4.(中考?衡阳)化学方程式是重要的化学用语。观察化学方程式可得到很多信息。请你根据化学方程式:
4HNO3(浓)=====光照或△4NO2↑+O2↑+2H2O写出你得到的三点信息。
(3)___________________________________________________________________________________________________________________________________________。每252份质量的硝酸在光照或加热条件下,生成184份质量的二氧化氮、32份质量的氧气、36份质量的水(合理即可)5.碳酸氢铵受热分解(NH4HCO3=====NH3↑+H2O+CO2↑),生成二氧化碳4.4 g,那么同时生成氨气的质量为( )
A.7.9 g B.1.8 g C.1.7 g D.3.5 gC△6.磷在氧气中燃烧反应的化学方程式为________________________,其中P、O2、P2O5的质量比是____________。若参加反应的P的质量为12.4 g,则生成的P2O5的质量为________;若生成的P2O5的质量为142 g,则参加反应的氧气的质量为________。124:160 :28480 g28.4 g7.(中考?泉州)氮化铝(AlN)被广泛应用于集成电路生产领域。在氮气(N2)流中由氧化铝与焦炭在高温条件下制得氮化铝:Al2O3+N2+3C=====2AlN+3CO。若有14 kg氮气参加反应,可生成氮化铝的质量为多少?高温8.(中考?桂林)为测定某过氧化钠样品的纯度,将2 g该样品与足量水发生如下反应(杂质不参与反应):2Na2O2+2H2O===4NaOH+O2↑。生成气体质量与时间的关系如图所示。回答问题:
(1)生成氧气的质量是________g。
(2)列式计算该样品中过氧化钠的
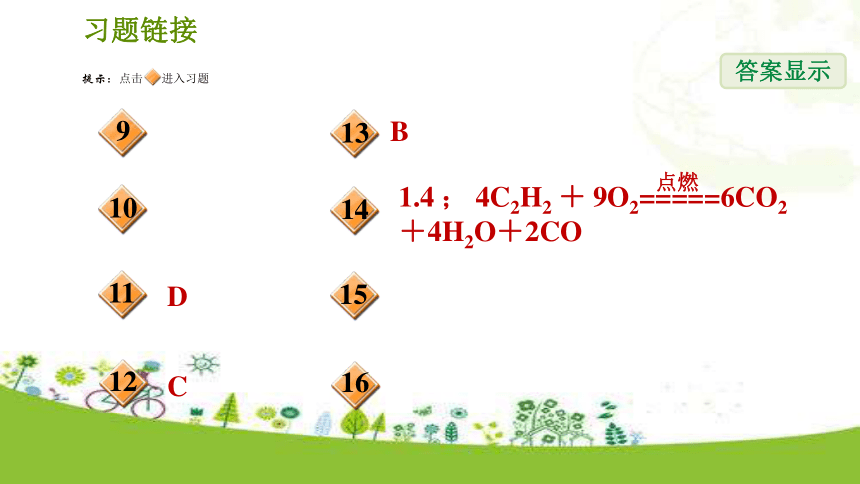
质量分数。0.329.(中考?西宁)小红同学将未知浓度的过氧化氢溶液34 g,加入盛有0.5 g二氧化锰的烧杯中,待完全反应后,称得烧杯中剩余物质的质量为33.7 g。计算该过氧化氢溶液中溶质的质量分数。【 解析】解答此类题目常因代入数据有误导致计算结果错误,解题时应注意:过氧化氢溶液、烧杯中的剩余物质都是混合物,其质量不能直接代入化学方程式计算,应根据质量守恒定律求得生成氧气的质量,然后代入化学方程式计算。10.(中考?天津)在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生成C和D的质量比为11:9,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36【答案】C11.在M+RO2===2N的反应中,RO2为氧化物,相对分子质量是44。已知1.2 g M与RO2完全反应生成5.6 g N。下列有关说法中错误的是( )
A.R的相对原子质量为12
B.N的相对分子质量是28
C.参加反应的RO2的质量为4.4 g
D.2.4 g M与5 g RO2反应生成7.4 g ND12.在化学反应2A+5B===2C+4D中,已知C、D的相对分子质量之比为9:22。若2.6 g A与B恰好完全反应后,生成8.8 g D。则此反应中B与D的质量比为( )
A.4:9 B.8:11
C.10:11 D.31:44【 解析】由题意可知,反应中C和D的质量比为(2×9): (4×22)=9: 44,因此,当生成8.8 g D时,生成C的质量为8.8 g×9/44=1.8 g,则参加反应的B的质量为:8.8 g+1.8 g-2.6 g=8 g,所以反应中B和D的质量比为8 g: 8.8 g=10: 11,故C正确。【答案】C13.将25 g A物质与5 g B物质充分反应后,收集到的物质有10 g A和11 g C,还有一定量的D。若A、B、C、D的相对分子质量分别为30、20、44、18,则下列反应的化学方程式正确的是( )
A.A+B===C+D B.2A+B===C+2D
C.2A+B===2C+D D.A+2B===2C+D【 解析】解这类题,不能把加入的各物质简单地理解为全部反应,应考虑过量问题。根据题意,反应物是A和B,生成物是C和D,由于反应后混合物中有10 g A,说明参加反应的A的质量为15 g,B全部参加反应,根据质量守恒定律,生成D的质量为20 g-11 g=9 g,由于A、B、C、D的相对分子质量分别为30、20、44、18,故化学方程式为:2A+B===C+2D。故选B。【答案】B14.(中考?河南)在点燃条件下,2.6 g C2H2与7.2 g O2恰好完全反应,生成6.6 g CO2、1.8 g H2O和x g CO,则x=________,化学方程式为____________________________________________。1.415.(中考?湖州节选)电解水实验中,为了增强水的导电性,可在水中加入一定量的稀硫酸。
某次实验中,将10 g 10.8%的稀硫酸倒入盛有98 g水的烧杯中混合均匀得A溶液。将A溶液全部倒入电解水装置,当通电反应到所剩溶液中含水量为98%时,可制得多少克氢气?16.金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B=====A2B。某校一课外小组的甲、乙、丙三位同学分别在实验室内做该实验,充分反应时,所用A和B的质量a、b各不相同,但总质量相等,都是8.0 g,有关实验数据记录如下。试求丙同学的实验中a:b的值可能是多少?△解:利用质量守恒定律,可判断生成5.0 g A2B时消耗B的质量为1.0 g,消耗A的质量为4.0 g,则两物质恰好完全反应时,A、B两物质的质量比为4:1;丙同学实验中生成A2B的质量为3.0 g,若加入A的质量=3.0 g×4/5=2.4 g,则加入B的质量=8.0 g-2.4 g=5.6 g;若加入B的质量=3.0 g×1/5=0.6 g,则加入A的质量=8.0 g-0.6 g=7.4 g;因此丙同学的实验中a:b 的值为2.4:5.6=3:7或7.4:0.6=37:3。
答:略。谢谢!
A.在反应前后,元素的种类没有变化
B.在常温下氢气与氧气混合就可以发生反应
C.4 g氢气与32 g氧气完全反应,生成36 g水
D.在反应前后,氢原子和氧原子的数目都没有改变B【 解析】氢气和氧气的反应在点燃条件下才可以发生,故B错误。点燃2.关于化学方程式3Fe+2O2=====点燃Fe3O4,四位同学表达了如图所示的四种说法,其中错误的是( )【 解析】3:2:1不是质量比,是各物质的化学计量数之比,故A选项错误。【答案】A3.(中考?张家界)汽车安装使用催化净化装置是减少汽车尾气对空气污染的有效方法之一。其主要发生反应的化学方程式为:2NO+2CO=====2CO2+N2。下列对该化学反应的说法不正确的是( )
A.反应物都属于氧化物
B.该反应使有害气体转化为无害物质
C.反应前后元素的种类、原子和分子个数都不变
D.化学方程式中所表示的反应物和生成物中只有一种物质是单质催化剂C4.(中考?衡阳)化学方程式是重要的化学用语。观察化学方程式可得到很多信息。请你根据化学方程式:
4HNO3(浓)=====光照或△4NO2↑+O2↑+2H2O写出你得到的三点信息。
(1)_____________________________________________________________________________________________。反应物是浓硝酸,反应条件是光照或加热,生成物是二氧化氮、氧气、水4.(中考?衡阳)化学方程式是重要的化学用语。观察化学方程式可得到很多信息。请你根据化学方程式:
4HNO3(浓)=====光照或△4NO2↑+O2↑+2H2O写出你得到的三点信息。
(2)_____________________________________________________________________________________________。在光照或加热条件下,4个硝酸分子分解生成4个二氧化氮分子、1个氧分子和2个水分子4.(中考?衡阳)化学方程式是重要的化学用语。观察化学方程式可得到很多信息。请你根据化学方程式:
4HNO3(浓)=====光照或△4NO2↑+O2↑+2H2O写出你得到的三点信息。
(3)___________________________________________________________________________________________________________________________________________。每252份质量的硝酸在光照或加热条件下,生成184份质量的二氧化氮、32份质量的氧气、36份质量的水(合理即可)5.碳酸氢铵受热分解(NH4HCO3=====NH3↑+H2O+CO2↑),生成二氧化碳4.4 g,那么同时生成氨气的质量为( )
A.7.9 g B.1.8 g C.1.7 g D.3.5 gC△6.磷在氧气中燃烧反应的化学方程式为________________________,其中P、O2、P2O5的质量比是____________。若参加反应的P的质量为12.4 g,则生成的P2O5的质量为________;若生成的P2O5的质量为142 g,则参加反应的氧气的质量为________。124:160 :28480 g28.4 g7.(中考?泉州)氮化铝(AlN)被广泛应用于集成电路生产领域。在氮气(N2)流中由氧化铝与焦炭在高温条件下制得氮化铝:Al2O3+N2+3C=====2AlN+3CO。若有14 kg氮气参加反应,可生成氮化铝的质量为多少?高温8.(中考?桂林)为测定某过氧化钠样品的纯度,将2 g该样品与足量水发生如下反应(杂质不参与反应):2Na2O2+2H2O===4NaOH+O2↑。生成气体质量与时间的关系如图所示。回答问题:
(1)生成氧气的质量是________g。
(2)列式计算该样品中过氧化钠的
质量分数。0.329.(中考?西宁)小红同学将未知浓度的过氧化氢溶液34 g,加入盛有0.5 g二氧化锰的烧杯中,待完全反应后,称得烧杯中剩余物质的质量为33.7 g。计算该过氧化氢溶液中溶质的质量分数。【 解析】解答此类题目常因代入数据有误导致计算结果错误,解题时应注意:过氧化氢溶液、烧杯中的剩余物质都是混合物,其质量不能直接代入化学方程式计算,应根据质量守恒定律求得生成氧气的质量,然后代入化学方程式计算。10.(中考?天津)在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生成C和D的质量比为11:9,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36【答案】C11.在M+RO2===2N的反应中,RO2为氧化物,相对分子质量是44。已知1.2 g M与RO2完全反应生成5.6 g N。下列有关说法中错误的是( )
A.R的相对原子质量为12
B.N的相对分子质量是28
C.参加反应的RO2的质量为4.4 g
D.2.4 g M与5 g RO2反应生成7.4 g ND12.在化学反应2A+5B===2C+4D中,已知C、D的相对分子质量之比为9:22。若2.6 g A与B恰好完全反应后,生成8.8 g D。则此反应中B与D的质量比为( )
A.4:9 B.8:11
C.10:11 D.31:44【 解析】由题意可知,反应中C和D的质量比为(2×9): (4×22)=9: 44,因此,当生成8.8 g D时,生成C的质量为8.8 g×9/44=1.8 g,则参加反应的B的质量为:8.8 g+1.8 g-2.6 g=8 g,所以反应中B和D的质量比为8 g: 8.8 g=10: 11,故C正确。【答案】C13.将25 g A物质与5 g B物质充分反应后,收集到的物质有10 g A和11 g C,还有一定量的D。若A、B、C、D的相对分子质量分别为30、20、44、18,则下列反应的化学方程式正确的是( )
A.A+B===C+D B.2A+B===C+2D
C.2A+B===2C+D D.A+2B===2C+D【 解析】解这类题,不能把加入的各物质简单地理解为全部反应,应考虑过量问题。根据题意,反应物是A和B,生成物是C和D,由于反应后混合物中有10 g A,说明参加反应的A的质量为15 g,B全部参加反应,根据质量守恒定律,生成D的质量为20 g-11 g=9 g,由于A、B、C、D的相对分子质量分别为30、20、44、18,故化学方程式为:2A+B===C+2D。故选B。【答案】B14.(中考?河南)在点燃条件下,2.6 g C2H2与7.2 g O2恰好完全反应,生成6.6 g CO2、1.8 g H2O和x g CO,则x=________,化学方程式为____________________________________________。1.415.(中考?湖州节选)电解水实验中,为了增强水的导电性,可在水中加入一定量的稀硫酸。
某次实验中,将10 g 10.8%的稀硫酸倒入盛有98 g水的烧杯中混合均匀得A溶液。将A溶液全部倒入电解水装置,当通电反应到所剩溶液中含水量为98%时,可制得多少克氢气?16.金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B=====A2B。某校一课外小组的甲、乙、丙三位同学分别在实验室内做该实验,充分反应时,所用A和B的质量a、b各不相同,但总质量相等,都是8.0 g,有关实验数据记录如下。试求丙同学的实验中a:b的值可能是多少?△解:利用质量守恒定律,可判断生成5.0 g A2B时消耗B的质量为1.0 g,消耗A的质量为4.0 g,则两物质恰好完全反应时,A、B两物质的质量比为4:1;丙同学实验中生成A2B的质量为3.0 g,若加入A的质量=3.0 g×4/5=2.4 g,则加入B的质量=8.0 g-2.4 g=5.6 g;若加入B的质量=3.0 g×1/5=0.6 g,则加入A的质量=8.0 g-0.6 g=7.4 g;因此丙同学的实验中a:b 的值为2.4:5.6=3:7或7.4:0.6=37:3。
答:略。谢谢!
