人教版初中化学九年级下册第九单元《溶液》单元检测题(含答案)
文档属性
| 名称 | 人教版初中化学九年级下册第九单元《溶液》单元检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 94.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-04 21:40:42 | ||
图片预览


文档简介
《溶液》单元检测题
一、单选题
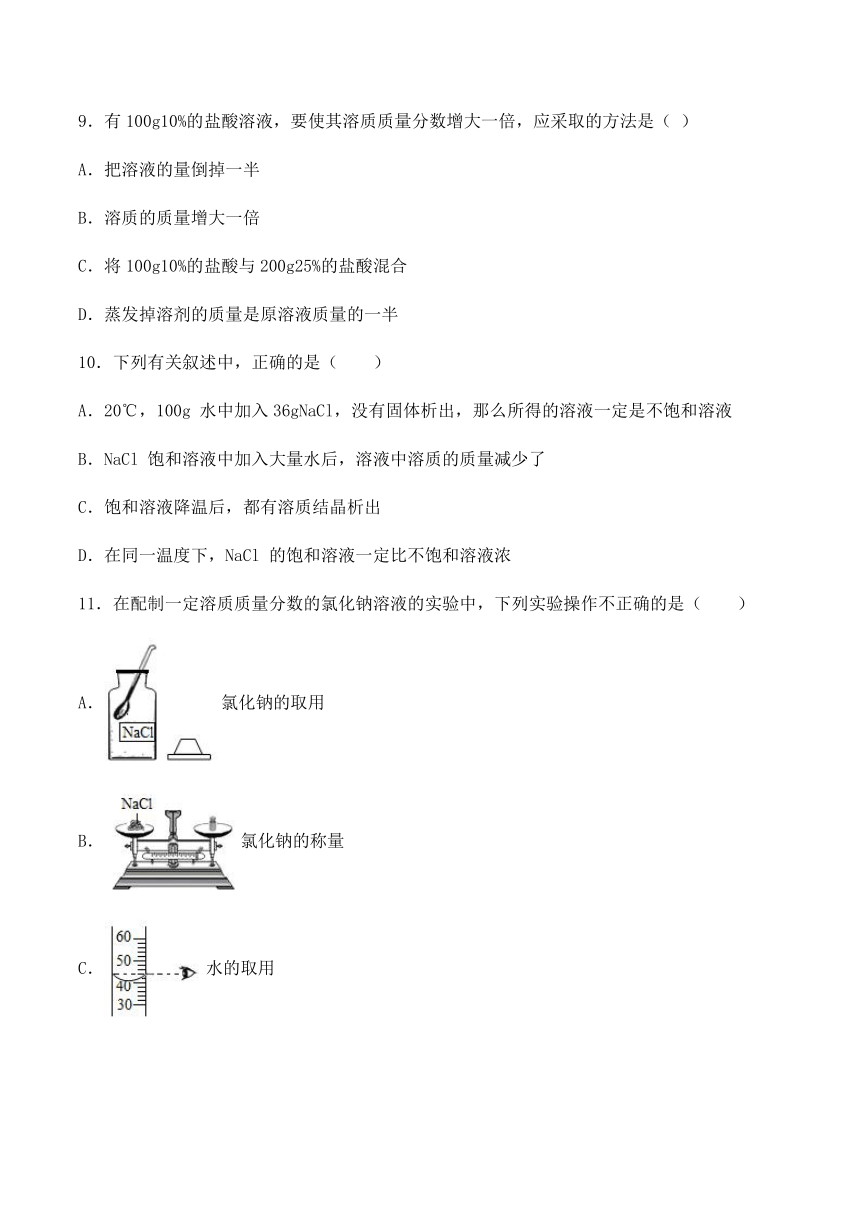
1.下图是甲、乙、丙三种物质(不含结晶水)的溶解度曲线,下列说法下不正确的是( )
A.在t1℃时,三种物质的溶解度由大到小的顺序是:乙>甲>丙
B.在t2℃时,甲、乙两物质的饱和溶液恒温蒸发等质量的水(不蒸干),析出的晶体质量相等
C.t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃,溶质的质量分数大小顺序为:甲=乙>丙
D.当甲中含有少量乙时,可采用降温结晶的方法提纯甲
2.根据如图的溶解度曲线,下列说法不正确的是
A.a点表示,t2℃时100g水中最多溶解甲物质25g
B.甲物质的的溶解度随温度的升高而增大
C.t1℃时,甲、乙两物质的饱和溶液中含溶质的质量肯定相等
D.t1℃时,甲、乙两物质的溶解度相等
3.推理和归纳是化学学习和研究中常用的思维方法,下列推理正确的是( )
A.稀有气体可做保护气,可做保护气的一定是稀有气体
B.离子是带电荷的粒子,所以带电荷的粒子一定是离子
C.厨房洗涤剂对油污有乳化作用,汽油去油污利用的也是乳化作用
D.化合物是由不同种元素组成的纯净物,则只含有一种元素的物质一定不是化合物
4.将60℃饱和的硝酸钾溶液降温至20℃,没有发生变化的是( )
A.溶液的质量 B.溶液里溶质的质量
C.溶液里溶剂的质量 D.溶液里溶质的质量分数
5.下列溶液中,溶剂不是水的是( )
A.高锰酸钾溶液 B.食盐水 C.稀硫酸 D.碘酒
6.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是( )
①称量的氯化钠固体中含有不溶性杂质②用量筒量取水时俯视读数
③往烧杯中加水时有水洒出④将配制好的溶液装入试剂瓶中时有少量溅出
A.①② B.②③ C.③④ D.①④
7.下列物质的鉴别方法不正确的是
A.用水鉴别蔗糖和硝酸铵 B.用闻气味的方法鉴别水和酒精
C.用肥皂水鉴别硬水和软水 D.用燃烧的木条鉴别二氧化碳和氮气
8.下列液体中,不属于溶液的是( )
A.蒸馏水 B.蔗糖水 C.食盐水 D.白酒
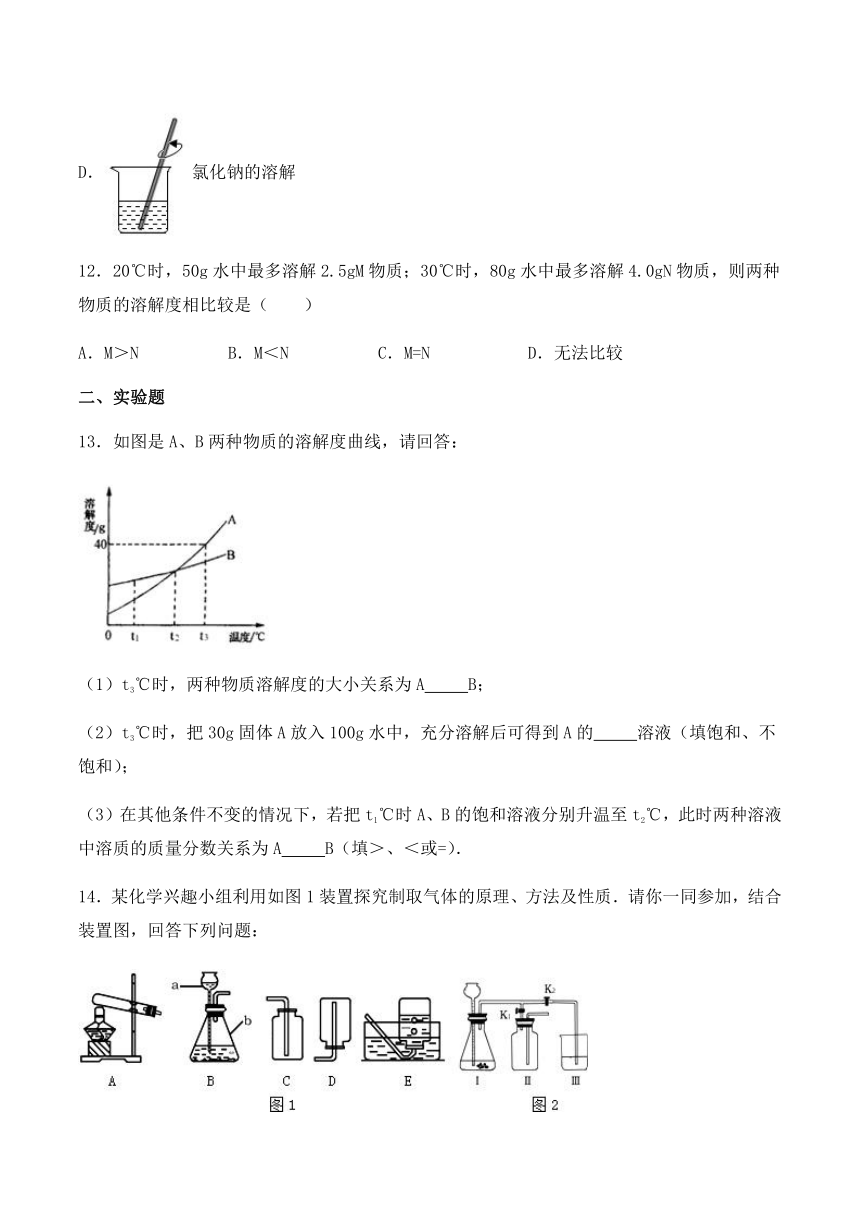
9.有100g10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100g10%的盐酸与200g25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半
10.下列有关叙述中,正确的是( )
A.20℃,100g 水中加入36gNaCl,没有固体析出,那么所得的溶液一定是不饱和溶液
B.NaCl 饱和溶液中加入大量水后,溶液中溶质的质量减少了
C.饱和溶液降温后,都有溶质结晶析出
D.在同一温度下,NaCl 的饱和溶液一定比不饱和溶液浓
11.在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
A.氯化钠的取用
B.氯化钠的称量
C.水的取用
D.氯化钠的溶解
12.20℃时,50g水中最多溶解2.5gM物质;30℃时,80g水中最多溶解4.0gN物质,则两种物质的溶解度相比较是( )
A.M>N B.M<N C.M=N D.无法比较
二、实验题
13.如图是A、B两种物质的溶解度曲线,请回答:
(1)t3℃时,两种物质溶解度的大小关系为A B;
(2)t3℃时,把30g固体A放入100g水中,充分溶解后可得到A的 溶液(填饱和、不饱和);
(3)在其他条件不变的情况下,若把t1℃时A、B的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数关系为A B(填>、<或=).
14.某化学兴趣小组利用如图1装置探究制取气体的原理、方法及性质.请你一同参加,结合装置图,回答下列问题:
(1)写出图中标号仪器的名称:a ,b .
(2)用双氧水和二氧化锰制取氧气时,可选用的发生装置是 (填图1字母),可选用C装置收集氧气,其原因是 .
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),NH3极易溶于水,密度比空气小,则可选择的装置组合是 (填图1字母).
(4)该小组设计了图2所示的实验装置,既可用于制取气体,又可用于探究物质的性质.
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是 (填字母).
a.大理石与稀盐酸反应制取二氧化碳;
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用I、Ⅲ装置制取二氧化碳并验证其有关性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入 ,写出此反应的化学方程式 .
(5)实验室用浓盐酸(溶质质量分数为37%,密度为1.18g?mL﹣1)配制100g溶质质量分数为10%的稀盐酸.
①计算:需要浓盐酸 mL,水 mL.(结果保留小数点后一位).
②量取:用规格为 mL的量筒(从50mL、100mL中选择)量取浓盐酸,倒入烧杯中,再量取水.
③稀释.
三、推断题
15.同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有_____(填写化学式,下同),可能含有_____;
②滤渣中一定含有_____,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_____(填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
16.A、B、C、D是初中化学常见的物质,它们之间的转化关系如图所示:
(1)若该反应为高温下进行的置换反应,且A、C为黑色固体,A具有磁性,D在常温常压下为无色无味的气体,反应的化学方程式为_______________________________.
(2)若该反应为A燃烧不充分的反应,且A由两种元素组成,质量比为3:1,B可供给动物呼吸,常温下C为气体,反应的化学方程式为_____________________________.
(3)若在20℃时,将B溶于乙醇中配成饱和溶液,通入适量A发生反应,且A是参与光合作用的气体,B为碱,C为纯碱,则在乙醇中该反应的化学方程式为_________________________.
20℃时,B、C在水中和乙醇中的溶解度
物质 水中的溶解度 乙醇中的溶解度
B 109g 17.3g
C 21.8g <0.01g
四、计算题
17.将20 g黄铜(铜和锌的合金)与93.7 g稀硫酸放入烧杯中恰好完全反应,反应后烧杯中物质的质量为113.5g,求:
(1)产生氢气的质量___。
(2)反应后烧杯里溶液中溶质的质量分数___。
18.把100克98%的浓硫酸稀释成10%的稀硫酸,需加水多少克?
19.取一定量浓度为5%的氢氧化钠溶液,加热蒸发掉108 g水后变为30 mL浓度为20%的氢氧化钠溶液。求:
(1)原氢氧化钠溶液的质量是____克,其中含有溶质____克;
(2)剩余溶液的密度是____g/cm3。
参考答案
1.C 2.C 3.D 4.C 5.D 6.B 7.D 8.A 9.C 10.D 11.C 12.D
13.(1)>;(2)不饱和;(3)<.
14.(1)长颈漏斗、锥形瓶;
(2)B、氧气的密度比空气大;
(3)AD;(4)b;CO2+H2O═H2CO3、紫色石蕊试液;
(5)a.22.7、70.3;b.50.
15.Zn(NO3)2 Fe(NO3)2 Ag、Fe Zn Ag、Fe 小于
16.Fe3O4+2C3Fe+2CO2↑ 2CH4+3O22CO+4H2O 2NaOH+CO2=Na2CO3↓+H2O
17.0.2g 16.1%
18.880g
19.(1)144g、7.2g(2)1.2g/cm3
同课章节目录
