仁爱版初中化学九年级下册专题7 《初识酸、碱和盐》检测题(含答案)
文档属性
| 名称 | 仁爱版初中化学九年级下册专题7 《初识酸、碱和盐》检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 146.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-04 21:45:00 | ||
图片预览


文档简介
《初识酸、碱和盐》检测题
一、单选题
1.下列实验操作不能达到实验目的是( )
选项
实验目的
主要操作
A
检验馒头中含有淀粉
取样,滴加碘水或碘酒
B
探究分子之间有间隙
将水、酒精各50mL倒入100mL量筒中
C
区别硝酸铵和氧化钙固体]
取样,分别加水,测量变化前后的温度
D
除去氢气中的氯化氢气体
先通过饱和碳酸氢钠溶液,再通过浓硫酸
A.A B.B C.C D.D
2.下列实验现象正确的是( )
A.往铁锈中加入足量的稀盐酸,溶液变浅绿色,产生无色气泡
B.将CO通往灼热氧化铜,红色固体变黑色
C.打开浓盐酸瓶盖,瓶口冒白雾
D.电解水时,正极气体是负极气体体积的2倍
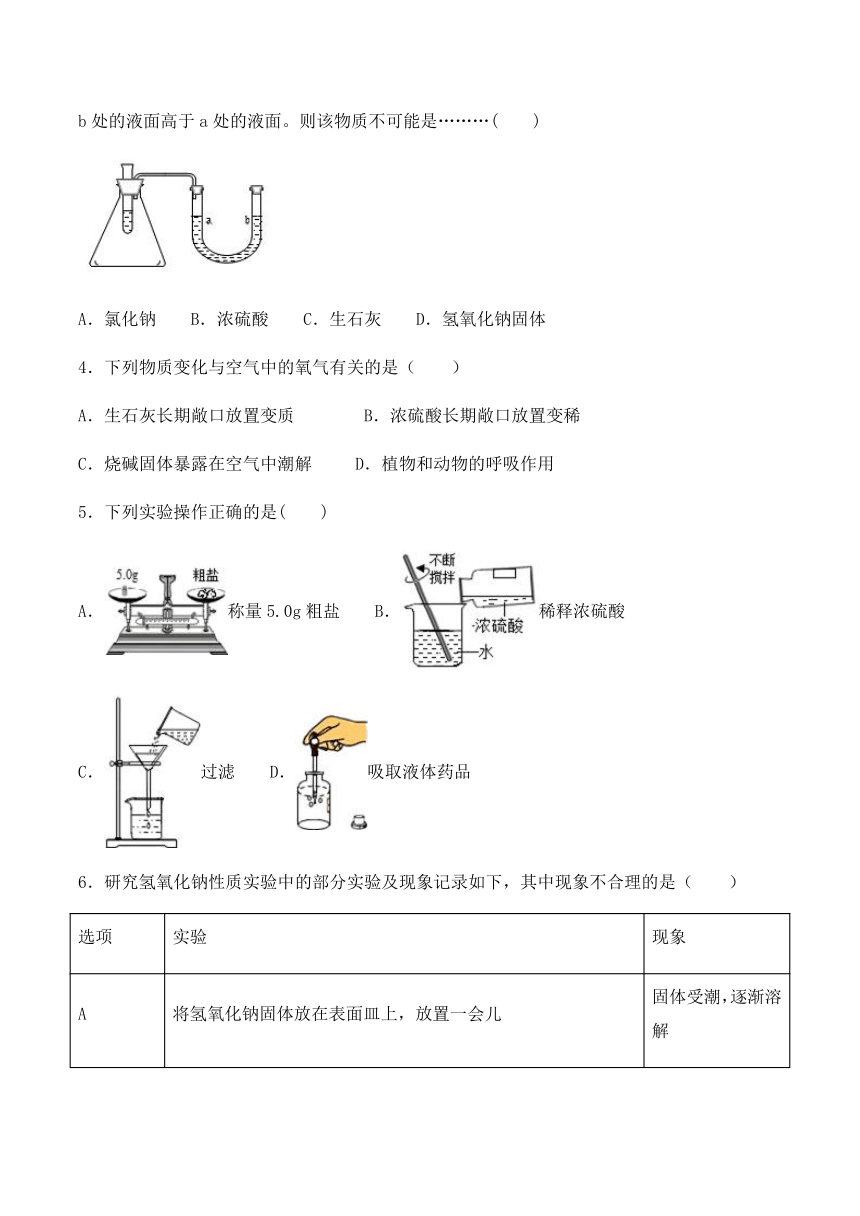
3.下图的锥形瓶内是空气,试管中盛有部分水,现向试管中加入某种物质后,会使U形管内b处的液面高于a处的液面。则该物质不可能是………( )
A.氯化钠 B.浓硫酸 C.生石灰 D.氢氧化钠固体
4.下列物质变化与空气中的氧气有关的是( )
A.生石灰长期敞口放置变质 B.浓硫酸长期敞口放置变稀
C.烧碱固体暴露在空气中潮解 D.植物和动物的呼吸作用
5.下列实验操作正确的是( )
A.称量5.0g粗盐 B.稀释浓硫酸
C.过滤 D.吸取液体药品
6.研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )
选项 实验 现象
A 将氢氧化钠固体放在表面皿上,放置一会儿 固体受潮,逐渐溶解
B 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 溶液变红
C 向盛有氢氧化钠溶液的试管中加入一根头发丝,加热煮沸 头发丝无任何变化
D 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 有蓝色沉淀生成
A.A B.B C.C D.D
7.下列有关化学知识的描述正确的是
A.催化剂不仅能改变化学反应速率,而且会增加生成物的质量
B.物质和氧气发生的反应是氧化反应,所以氧化反应一定有氧气参加
C.二氧化碳通入紫色石蕊试液,溶液变红色,说明二氧化碳具有酸性
D.含有不同种元素的纯净物一定是化合物
8.下列各物质的名称、俗名、化学式在表示同一物质的是( )
A.硫酸铜、纯碱、CuSO4 B.氯化氢、盐酸、NaCI
C.甲烷、酒精、CH4 D.氧化钙、生石灰、CaO
9.火星的土壤呈弱碱性。如果火星具备作物生长条件,则下列作物适宜在火星种植的是( )
作物 茶树 棉花 水稻 甘草
适宜生长的pH 5.0~5.5 6.0~6.8 6.0~7.0 7.2~8.5
A.棉花 B.甘草 C.水稻 D.茶树
10.为保障“舌尖上的安全”,下列做法合理的是( )
A.霉变大米煮后食用 B.做蛋糕时加入少量的小苏打,使它更松软
C.大量采用油炸方式制作食物 D.用甲醛溶液浸泡荔枝,以保鲜防腐
11.晓明发现自家的农田出现土壤酸化板结现象,经查阅资料得知:是因为该农田长期施用化肥——硫酸铵[(NH4)2SO4]的缘故。硫酸铵属于
A.氮肥 B.磷肥 C.钾肥 D.复合肥
12.下列溶液混合后,不能发生复分解反应的一组是( )
A.HCl和NaOH B.Na2CO3和H2SO4
C.KNO3和NaCl D.NaOH和FeCl3
二、实验题
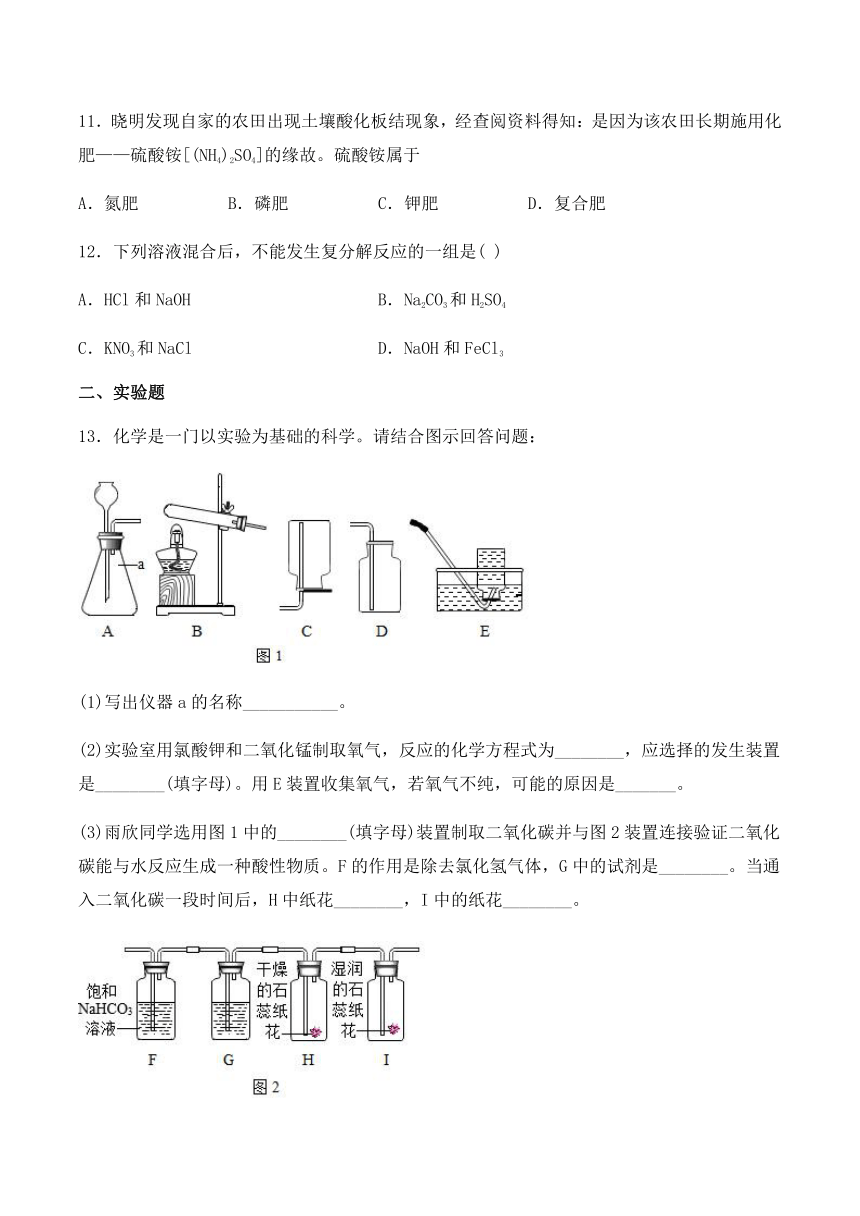
13.化学是一门以实验为基础的科学。请结合图示回答问题:
(1)写出仪器a的名称___________。
(2)实验室用氯酸钾和二氧化锰制取氧气,反应的化学方程式为________,应选择的发生装置是________(填字母)。用E装置收集氧气,若氧气不纯,可能的原因是_______。
(3)雨欣同学选用图1中的________(填字母)装置制取二氧化碳并与图2装置连接验证二氧化碳能与水反应生成一种酸性物质。F的作用是除去氯化氢气体,G中的试剂是________。当通入二氧化碳一段时间后,H中纸花________,I中的纸花________。
14.NaOH是化学实验中常用的试剂.
(1)将某NaOH溶液逐滴滴人一定量的某盐酸中,上边图像合理的是__(填“甲”或“乙”).
(2)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因.______________
(3)向足量某NaOH溶液中通入CO2,反应后溶液中的溶质可能只有Na2CO3,也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论.______(提示:Na2CO3溶液呈碱性)
三、推断题
15.2018年元月,我省遭遇大范围雨雪降温,给交通带来不便.撒融雪剂可以使雪很快融化,有效的缓解交通压力.某种融雪剂可能是由NaCl、Ca2Cl、NaNO3、FeSO4中的一种或两种物质组成,小明为探究其成分,做了以下实验:
根据以上实验,请你推断:
(1)融雪剂能使冰雪融化的原因___________________________________
(2)该融雪剂一定不含有_______________理由是______________________________有同学认为通过以上实验证明融雪剂中一定含有氯化钠,你是否同意该观点______理由是______________________________
?(3)写出第Ⅱ步反应的化学方程式______________________________
?(4)融雪剂的大量使用会给环境带来一些危害.请你写出融雪剂对环境的一种危害或提出道路除雪的一条合理化建议______________________________
16.已知A﹣F是初中化学常见的物质,B在农业上常用于改良酸性土壤,C是胃酸的主要成分,它们之间的转化关系如图所示。(“→”表示由一种物质可以 转化为另一种物质,“﹣”表示相邻的物质间可以相互反应,其中部分反应物和生成物及反应条件已略去)。 请回答下列问题:
(1)A的化学式为_____B的化学式为_____;
(2)物质C的一种用途为_____;
(3)D和F反应的基本类型为_____;
(4)B和E反应的化学方程式为_____(写一个即可)。
17.如图是常见物质的转换关系图.其中A、B常温下都为液体且组成元素相同,A、B、X、Y、E都为氧化物,X、E都为黑色固体,F为白色沉淀,I为蓝色絮状沉淀.
请回答下列问题:
(1)E的化学式 _________ ;F的化学式 _________ ;
(2)反应⑥的化学方程式 _________ ;
(3)反应①﹣⑥涉及的基本反应类型有 _________ 种.
四、计算题
18.化学实验小组的同学为了研究某公共场所铁制护栏锈蚀程度,取12.8g已生锈的铁护栏(假设其成分只有Fe和Fe2O3,不含其它杂质),加入到120g一定浓度的稀盐酸中,充分反应,测得产生气体质量与稀盐酸质量关系如图所示。请回答问题:
(1)发生复分解反应的化学方程式为_____。
(2)根据已知信息列出求解参加反应的铁的质量(X)的比例式_____。
(3)铁护栏中氧化铁的质量分数为_____。
(4)若用质量分数36.5%的浓盐酸配制120g上述稀盐酸,需要浓盐酸与水的质量比为_____。
(5)配制该稀盐酸时应尽量减小实验误差,需要选择的实验仪器有_____(填字母)。
A玻璃棒 B烧杯 C 50mL量筒 D托盘天平 E 100mL量筒 F胶头滴管
19.某碳酸钠样品含有少量的氯化钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到100 g质量分数为7. 3%的盐酸溶液中,恰好完全反应,生成的气体全部逸出后,将溶液蒸干,得到15.6g氯化钠。请计算:
(1)原样品中碳酸钠的质量分数____________(计算结果保留至0.1% )。
(2)反应后溶液中氯化钠的质量分数_________________(计算结果保留至0. 1% )。
20.实验室中有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8克10%的氢氧化钠溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
(1)配制8克10%的氢氧化钠溶液,需要水的质量为______g;
(2)计算该盐酸的溶质质量分数;__________(写出计算过程)
(3)当滴入4克盐酸时,烧杯内溶液中钠元素的质量为_______g。
参考答案
1.D 2.C 3.A 4.D 5.B 6.C 7.D 8.D 9.B 10.B 11.A 12.C
13.锥形瓶 2KClO32KCl+3O2↑ B 刚有气泡冒出就立刻收集 A 浓硫酸 不变色 变红
14.乙 氢氧化钠和空气中的二氧化碳反应生成了碳酸钠,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳 实验步骤、现象和结论分别是:取反应后的溶液,加入足量CaCl2溶液(或BaCl2溶液等),产生白色沉淀,静置,取上层清液滴加酚酞溶液。若溶液变成红色,则溶质为Na2CO3和NaOH;若溶液没有变成红色,则溶质只有Na2CO3
15. 降低了水的凝固点 FeSO4 其溶液呈浅绿色 否 氯化钙与碳酸钠反应生成了氯化钠,加入硝酸银也会产生白色沉淀 CaCl2+Na2CO3=== CaCO3↓+2NaCl 合理除雪
16.H2O Ca(OH)2 金属除锈 置换反应 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
17.(1)CuO;CaCO3;(2)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;(3)3
18.Fe2O3+6HCl═2FeCl3+3H2O 12.5% 2:3 ABCEF
19.73.1% 8.0%
20.7.2 7.3% 0.46
