苏教化学必修2专题3第二单元食品中的有机化合物 (共16张PPT)
文档属性
| 名称 | 苏教化学必修2专题3第二单元食品中的有机化合物 (共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 881.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-05 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
请大家,从颜色、气味、状态、水溶性等方面观察总结说说乙醇的物理性质。
一、乙醇的物理性质
颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
和水可以以任意比互溶
能够溶解多种无机物和有机物
沸点78℃,易挥发
工业制备无水乙醇:加生石灰(CaO)蒸馏
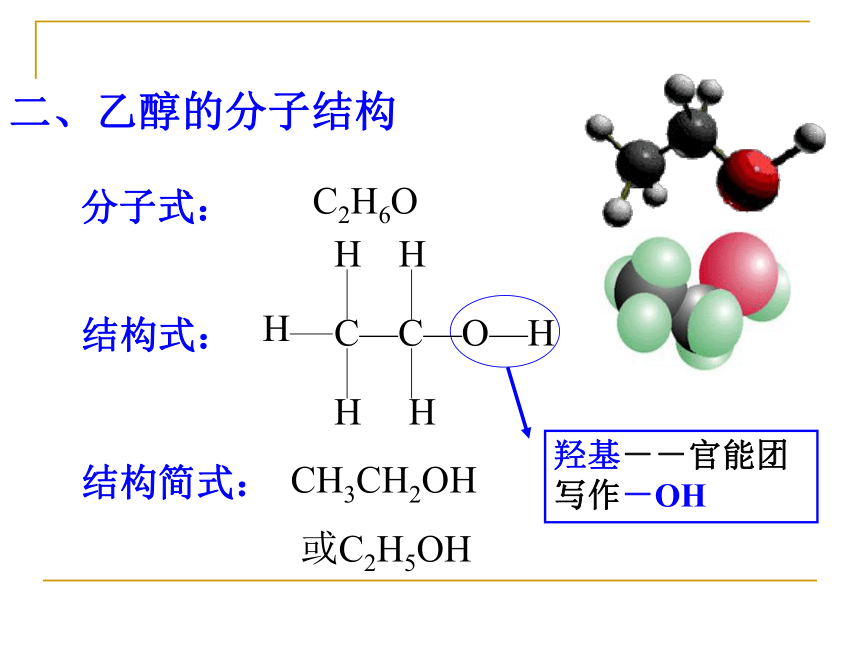
二、乙醇的分子结构
羟基--官能团
写作-OH
思考1:我们知道金属钠保存在煤油中,钠与煤油是否发生反应?
思考2:从课本实验1知道,钠与无水乙醇能发生反应,与钠与水反应是否相同?
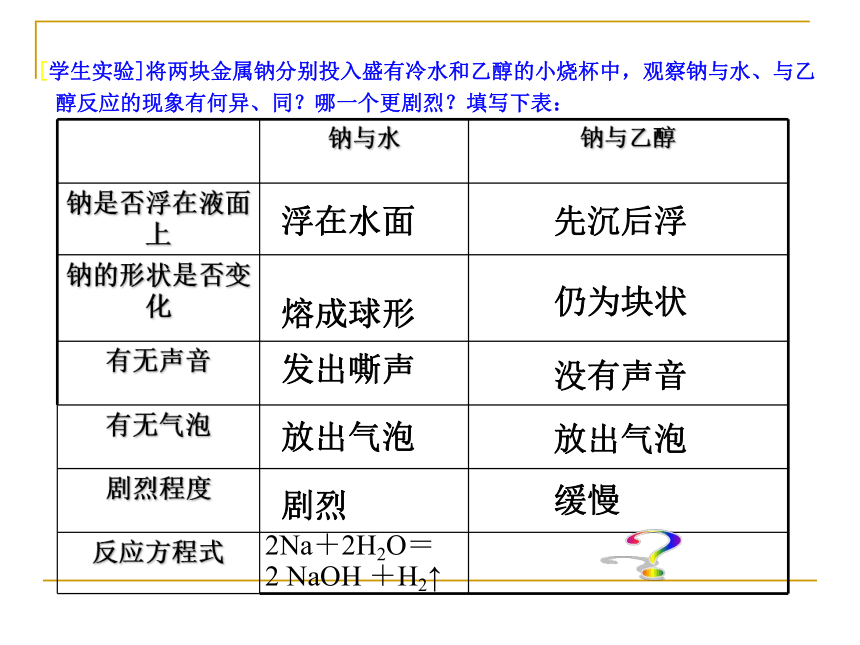
[学生实验]将两块金属钠分别投入盛有冷水和乙醇的小烧杯中,观察钠与水、与乙醇反应的现象有何异、同?哪一个更剧烈?填写下表:
浮在水面
熔成球形
发出嘶声
放出气泡
剧烈
先沉后浮
仍为块状
没有声音
放出气泡
缓慢
2Na+2H2O=
2 NaOH +H2↑
钠与水 钠与乙醇
钠是否浮在液面上
钠的形状是否变化
有无声音
有无气泡
剧烈程度
反应方程式
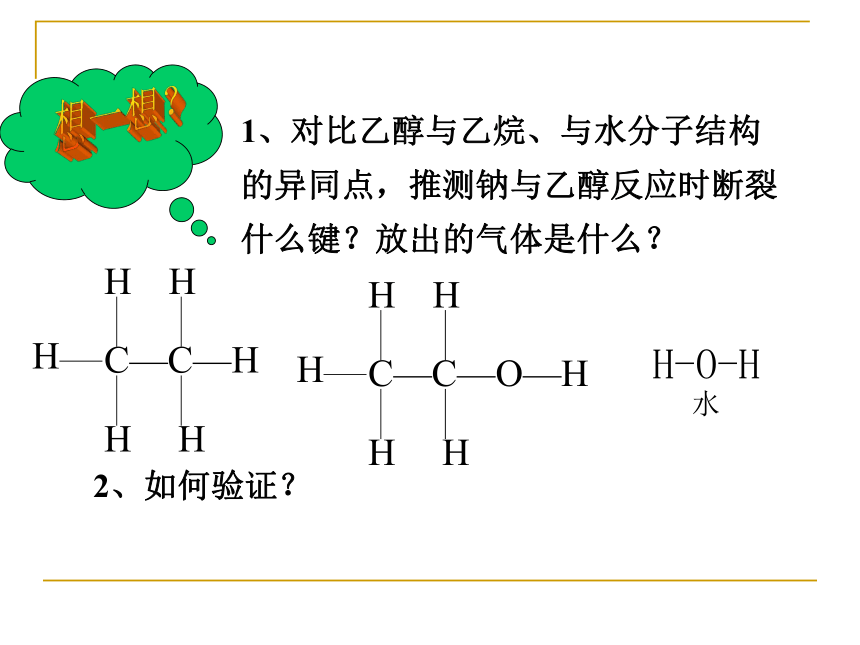
1、对比乙醇与乙烷、与水分子结构
的异同点,推测钠与乙醇反应时断裂
什么键?放出的气体是什么?
H-O-H
水
2、如何验证?
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
其它活泼金属如钾、钙、镁等也可与乙醇反应
三、乙醇的化学性质
1、乙醇与钠的反应
练习:写出乙醇与镁反应的化学方程式
2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑
钠与水、与乙醇反应对比
1、从二者均能反应放出氢气,可得出什么结论?
2、从二者反应剧烈程度不同分析,乙醇 和水分子的羟基中的H原子哪个较活泼?乙基对乙醇的性质有无影响?
[结论]?1、羟基决定乙醇能和钠反应生成氢气
2、羟基中的H原子的活泼性:醇<水
2、乙醇的氧化反应
(1)乙醇在空气中燃烧?:
现象:产生淡蓝色火焰,同时放出大量热。
[学生实验:乙醇的催化氧化]
①用小试管取2mL无水乙醇
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管底部
④反复操作几次,观察铜丝颜色和液体气味的变化。
a.铜丝红色→黑色→红色反复变化
[思考]铜丝在此实验中起什么作用?
[实验现象]
b.在试管口可以闻到刺激性气味
红色→黑色
黑色→红色
总反应方程式:
乙醛
刺激性气味液体
铜丝在实验中作催化剂
(2)乙醇催化氧化:
工业上利用此原理生产乙醛
Cu或Ag
C2H6O
C2H4O
①与活泼金属反应
②氧化反应——燃烧
——催化氧化
分子结构:
物理性质:
化学性质:
官能团-OH
1、能用来检验酒精中是否含有水的
试剂是( )
A: CuSO4·5H2O
C: 浓硫酸
B:CuSO4
D:金属钠
练 习 题
√
练 习 题
2.用工业酒精(95.57%,含水4.43%)制备无水乙醇(99.5 % ),可选用的方法是( )
A. 加入足量金属钠,反应完后再蒸馏
B. 加入生石灰再蒸馏
C. 加入浓硫酸,再加热,蒸出乙醇
D. 直接加热蒸馏
√
请大家,从颜色、气味、状态、水溶性等方面观察总结说说乙醇的物理性质。
一、乙醇的物理性质
颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
和水可以以任意比互溶
能够溶解多种无机物和有机物
沸点78℃,易挥发
工业制备无水乙醇:加生石灰(CaO)蒸馏
二、乙醇的分子结构
羟基--官能团
写作-OH
思考1:我们知道金属钠保存在煤油中,钠与煤油是否发生反应?
思考2:从课本实验1知道,钠与无水乙醇能发生反应,与钠与水反应是否相同?
[学生实验]将两块金属钠分别投入盛有冷水和乙醇的小烧杯中,观察钠与水、与乙醇反应的现象有何异、同?哪一个更剧烈?填写下表:
浮在水面
熔成球形
发出嘶声
放出气泡
剧烈
先沉后浮
仍为块状
没有声音
放出气泡
缓慢
2Na+2H2O=
2 NaOH +H2↑
钠与水 钠与乙醇
钠是否浮在液面上
钠的形状是否变化
有无声音
有无气泡
剧烈程度
反应方程式
1、对比乙醇与乙烷、与水分子结构
的异同点,推测钠与乙醇反应时断裂
什么键?放出的气体是什么?
H-O-H
水
2、如何验证?
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
其它活泼金属如钾、钙、镁等也可与乙醇反应
三、乙醇的化学性质
1、乙醇与钠的反应
练习:写出乙醇与镁反应的化学方程式
2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑
钠与水、与乙醇反应对比
1、从二者均能反应放出氢气,可得出什么结论?
2、从二者反应剧烈程度不同分析,乙醇 和水分子的羟基中的H原子哪个较活泼?乙基对乙醇的性质有无影响?
[结论]?1、羟基决定乙醇能和钠反应生成氢气
2、羟基中的H原子的活泼性:醇<水
2、乙醇的氧化反应
(1)乙醇在空气中燃烧?:
现象:产生淡蓝色火焰,同时放出大量热。
[学生实验:乙醇的催化氧化]
①用小试管取2mL无水乙醇
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管底部
④反复操作几次,观察铜丝颜色和液体气味的变化。
a.铜丝红色→黑色→红色反复变化
[思考]铜丝在此实验中起什么作用?
[实验现象]
b.在试管口可以闻到刺激性气味
红色→黑色
黑色→红色
总反应方程式:
乙醛
刺激性气味液体
铜丝在实验中作催化剂
(2)乙醇催化氧化:
工业上利用此原理生产乙醛
Cu或Ag
C2H6O
C2H4O
①与活泼金属反应
②氧化反应——燃烧
——催化氧化
分子结构:
物理性质:
化学性质:
官能团-OH
1、能用来检验酒精中是否含有水的
试剂是( )
A: CuSO4·5H2O
C: 浓硫酸
B:CuSO4
D:金属钠
练 习 题
√
练 习 题
2.用工业酒精(95.57%,含水4.43%)制备无水乙醇(99.5 % ),可选用的方法是( )
A. 加入足量金属钠,反应完后再蒸馏
B. 加入生石灰再蒸馏
C. 加入浓硫酸,再加热,蒸出乙醇
D. 直接加热蒸馏
√
