仁爱版初中化学九年级下册专题8《金属和金属材料》检测题(含答案)
文档属性
| 名称 | 仁爱版初中化学九年级下册专题8《金属和金属材料》检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 155.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-05 12:03:27 | ||
图片预览


文档简介
《金属和金属材料》检测题
一、单选题
1.将一定量的 Zn 粉和 Cu 粉加入一定量 AgNO3 溶液中,充分反应后过滤,有关滤液和滤渣的下列说法中,不合理的是
A.滤液中一定含有Zn2+,可能含有Cu2+
B.所得滤渣质量一定大于加入的 Zn 粉和 Cu 粉质量
C.如果滤渣中有 Zn,则滤液可能为蓝色
D.如果滤液中含有Ag+,则滤渣一定为纯净物
2.常见金属R与硝酸银溶液反应的化学方程式为R+3AgNO3==3Ag+R(NO3)3,有关该反应的说法正确的是
A.反应后溶液质量一定增加 B.该金属可能是铁
C.R的活泼性比Ag弱 D.R表面有固体析出
3.下列叙述中,不正确的是( )
A.在化学变化前后,二氧化锰的质量不会发生变化
B.在一氧化碳炼铁过程中,一氧化碳是还原剂
C.在潮湿的空气中,铁制品通常容易锈蚀
D.增大氧气的浓度,能够促进物质的充分燃烧
4.钢铁是使用最多的金属材料,根据你的生活经验分析,下列做法错误的是( )
A.钢铁放在潮湿的空气中容易生锈
B.在铁桶中加入硫酸铜、生石灰和水,配制农药
C.雨水淋湿的自行车,须先用干布擦拭后再用带油的布擦
D.用铁板可以制作防盗门
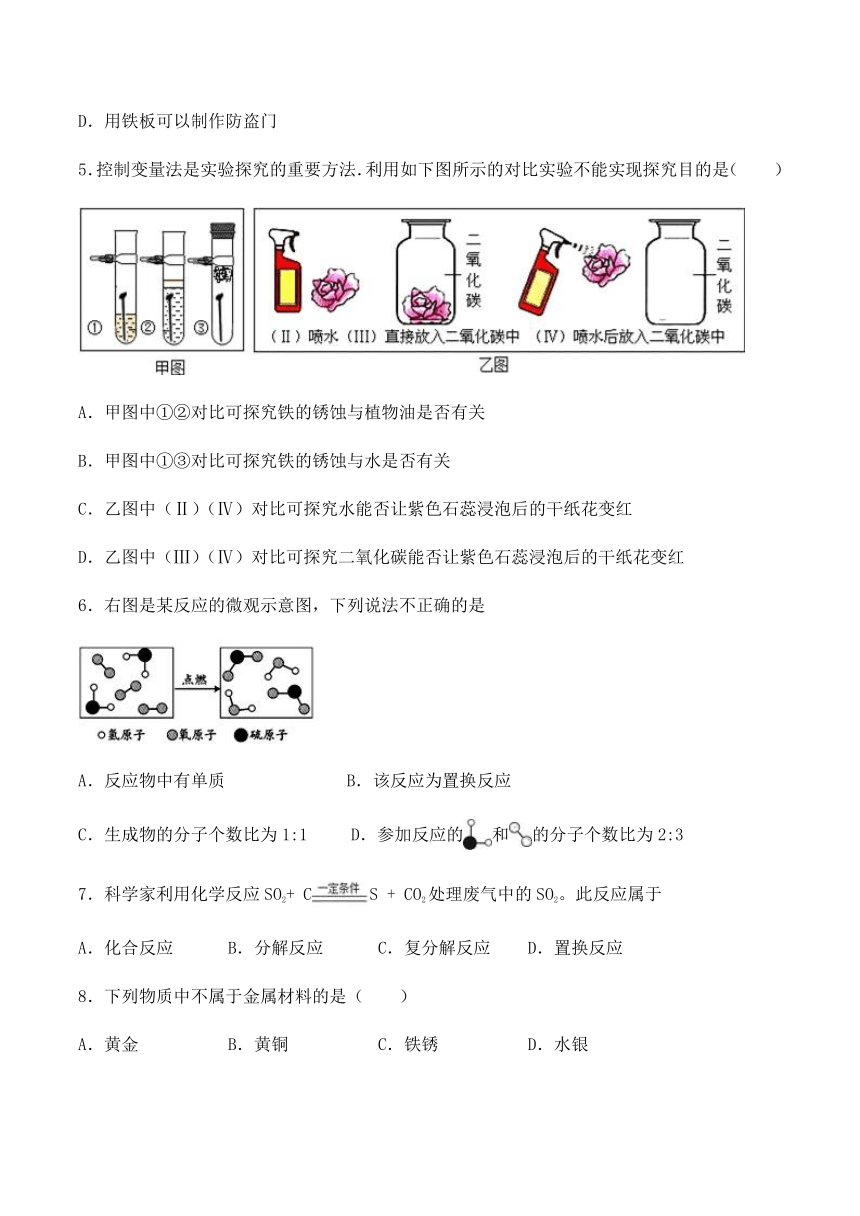
5.控制变量法是实验探究的重要方法.利用如下图所示的对比实验不能实现探究目的是( )
A.甲图中①②对比可探究铁的锈蚀与植物油是否有关
B.甲图中①③对比可探究铁的锈蚀与水是否有关
C.乙图中(Ⅱ)(Ⅳ)对比可探究水能否让紫色石蕊浸泡后的干纸花变红
D.乙图中(Ⅲ)(Ⅳ)对比可探究二氧化碳能否让紫色石蕊浸泡后的干纸花变红
6.右图是某反应的微观示意图,下列说法不正确的是
A.反应物中有单质 B.该反应为置换反应
C.生成物的分子个数比为1:1 D.参加反应的和的分子个数比为2:3
7.科学家利用化学反应SO2+ CS + CO2处理废气中的SO2。此反应属于
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
8.下列物质中不属于金属材料的是( )
A.黄金 B.黄铜 C.铁锈 D.水银
9.化学反应Fe3O4+4CO3Fe+4CO2中的还原剂是
A.Fe3O4 B.CO C.Fe D.CO2
10.铝、铁、铜是人类使用量较多的金属,下列对铝、铁、铜的说法中不正确的是
A.铜可以用来做电线
B.铝是地壳中含量最多的金属元素
C.铝不与硫酸铜溶液反应
D.铁在潮湿的空气中容易生锈
11.即热饭盒之所以能加热饭菜,原因是其底部因是装入混有镁、铁粉末的高密度聚乙烯,进行简单的操作后水和镁就会发生剧烈的化学反应,放出热量便可使食物变热,其中铁可能是
A.一种反应物 B.起导热作用
C.催化剂 D.增大镁与水分子的接触机会
二、实验题
12. 杨明同学在阅读课外资料时了解到铁的氧化物有氧化铁、四氧化三铁(能被磁铁吸引)和黑色的氧化亚铁三种,这三种氧化物都能与酸发生反应而溶解。联系课堂上学过的知识,他提出了以下两个问题,请你与他一起探讨问题。
[问题1]铁燃烧的产物为什么不是Fe2O3呢?
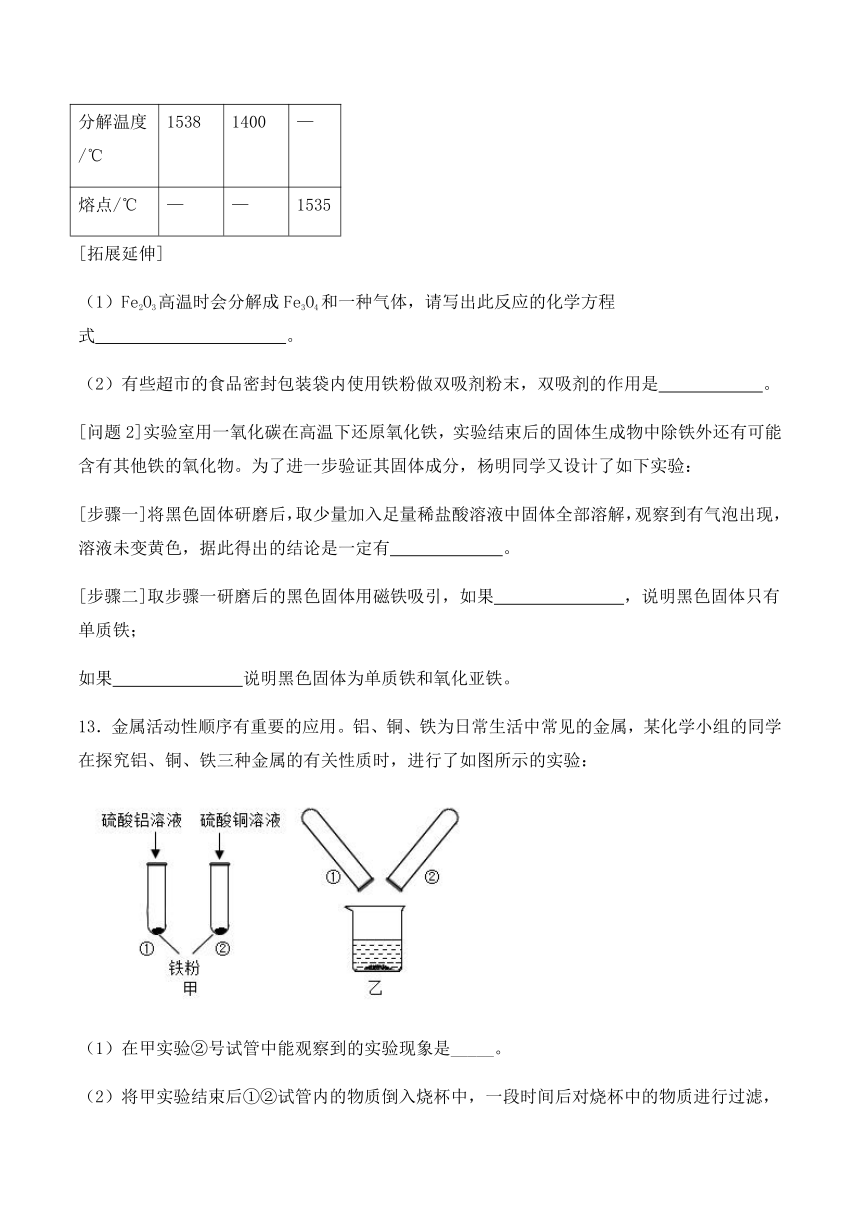
[查阅资料]1.四氧化三铁和氧化铁的分解温度、铁的熔点见表;
2.氧化铁高温时分解成四氧化三铁和氧气
[理论探讨]根据实验现象,并结合下表中数据,可推知铁在氧气里燃烧时产生的高温应在___ __之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4。
Fe3O4 Fe2O3 铁
分解温度/℃ 1538 1400 —
熔点/℃ — — 1535
[拓展延伸]
(1)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 。
(2)有些超市的食品密封包装袋内使用铁粉做双吸剂粉末,双吸剂的作用是 。
[问题2]实验室用一氧化碳在高温下还原氧化铁,实验结束后的固体生成物中除铁外还有可能含有其他铁的氧化物。为了进一步验证其固体成分,杨明同学又设计了如下实验:
[步骤一]将黑色固体研磨后,取少量加入足量稀盐酸溶液中固体全部溶解,观察到有气泡出现,溶液未变黄色,据此得出的结论是一定有 。
[步骤二]取步骤一研磨后的黑色固体用磁铁吸引,如果 ,说明黑色固体只有单质铁;
如果 说明黑色固体为单质铁和氧化亚铁。
13.金属活动性顺序有重要的应用。铝、铜、铁为日常生活中常见的金属,某化学小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图所示的实验:
(1)在甲实验②号试管中能观察到的实验现象是_____。
(2)将甲实验结束后①②试管内的物质倒入烧杯中,一段时间后对烧杯中的物质进行过滤,滤液中的溶质一定有_____。
(3)若要验证铝、铁、铜金属活动性顺序,还可以用一种试剂直接与上述金属反应就能达到目的,该试剂可以是_____。
三、推断题
14.下列各物质之间有如图所示反应关系,请根据图回答下列问题
(1)写出化学式:C为______________G为________________;
(2)写出步骤③中发生反应的一个化学方程式:___________;
(3)A是由常见离子构成的一种化合物,该物质中一定含有_______ 三种元素。
15.A-F和X都是初中化学中的常见物质,其中A、C是元素组成相同的两种气体,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略):
(1)请写出F的化学式_____________________;
(2)写出反应①的化学方程式___________________;
(3)写出②的化学方程式___________________。
16.A~I都是初中化学中的常见物质,且有如图所示转化关系(部分反应物、生成物及反应条件均已略去)。已知A为金属单质,其它均为化合物。F为大理石的主要成分,E为一种常见的不挥发性酸。
回答下列问题:
(1)写出下列物质的化学式:B ________。
(2)写出反应的化学方程式:①D溶液+H溶液:________;②F→G:_____________。
四、计算题
17.某铁矿石的主要成分为Fe2O3,其Fe2O3的含量为80%。试计算:用100t这种铁矿石理论上可以炼出含杂质4%的生铁的质量为____________?
18.氯化锌是无机盐工业的重要产品之一,应用广泛。某工厂急需氯化锌13. 6kg,请计算至少需要多少质量的锌和足量的盐酸(HCl) 反应才能供应工厂需求?相关反应的化学方程式为___________________。(写出计算过程)
19.黄铜是制作电子元件的重要材料。为测定某黄铜(假设合金中仅含铜、锌)中锌的质量分数.兴趣小组同学进行了如下图所示的实验(同种盐酸分两次加人) ,请计算:
(1)生成氢气的总质量_______g;
(2)该黄铜中锌的质量分数______;(计算结果精确至1%)
(3)所用稀盐酸的溶质质量分数_____。(计算结果精确至0.1%)
参考答案
1.C 2.D 3.A 4.B 5.A 6.B 7.D 8.C 9.B 10.C 11.C
12.[理论探讨]l535℃~l538℃
[拓展延伸](1)6Fe203 高温 4Fe304+02↑;(2)吸收氧气和水等物质
[步骤一]有单质铁;
[步骤二]黑色固体被磁铁全部吸引;被部分吸引。
13.有红色物质生成,溶液由蓝色变成了浅绿色 硫酸铝、硫酸亚铁 稀盐酸(稀硫酸)
14.C为 CaCO3 G为H2 Fe+CuSO4==FeSO4+Cu(或 Fe+H2SO4==FeSO4+ H2↑) Cu C O
15.Cu 3CO+Fe2O32Fe+3CO2 CO2 +Ca(OH)2 =CaCO3↓+ H2O
16.CuO; CuSO4+Ca(OH)2====Cu(OH)2↓+CaSO4 CaCO3CaO+CO2↑
17.175t
18.6.5 kg(详见解析)
19.0.4 65% 14.6%
