第二节 几种常见的酸 探究酸的化学性质 课件(18张PPT)
文档属性
| 名称 | 第二节 几种常见的酸 探究酸的化学性质 课件(18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-06 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
课题:探究酸的化学性质
学习目标
1.掌握酸的化学性质。
2.通过活动与探究掌握酸的化学性质。
3.树立科学的物质观,学会用辩证的观点看待事物,能透过表面现象挖掘事物具有共性的本质原因。
知识回顾
1.常见的酸碱指示剂有哪些,它们遇酸碱如何变色;
2.浓硫酸如何稀释;
3.盐酸和稀硫酸各具有哪些用途。
苹果酸
硫酸
柠檬酸
乳酸
盐酸
碳酸
有两瓶未贴标签的稀盐酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
探究活动1
你的方案一:用紫色石蕊溶液
酸的溶液能使紫色石蕊变成红色
酸的溶液不能使无色酚酞溶液变色
紫色石蕊变成溶液红色
紫色石蕊变成溶液红色
无色酚酞溶液不变色
无色酚酞溶液不变色
依据:紫色石蕊遇酸溶液变成红色
结论:酸能与指示剂反应
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
规 律
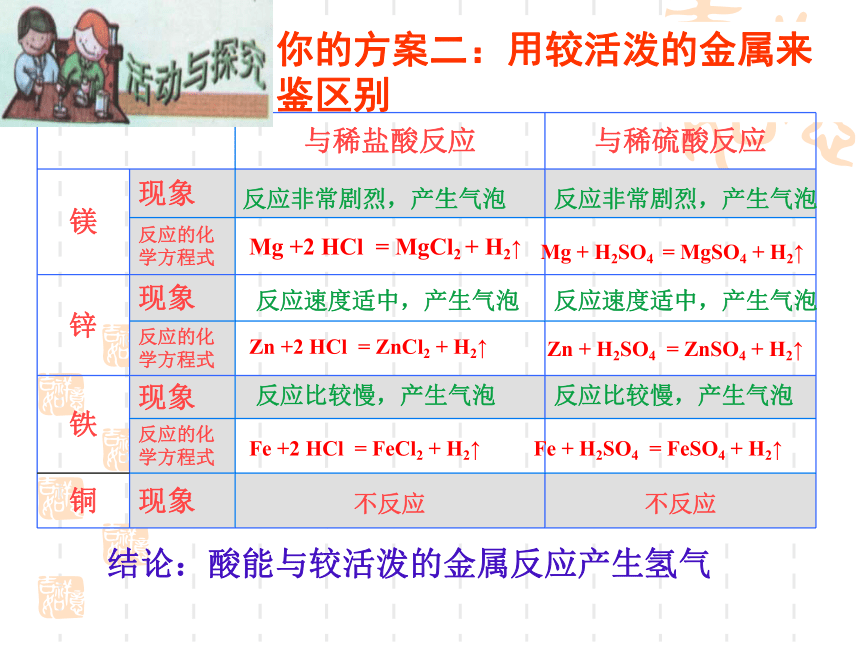
你的方案二:用较活泼的金属来鉴区别
结论:酸能与较活泼的金属反应产生氢气
反应非常剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
问题:
同学们在日常生活中见到过或用到过哪些除铁锈的方法?
提示:铁锈的主要成分是Fe2O3
探究活动2 将一段生锈的铁丝分别用细线系好放入盛有稀盐酸和稀硫酸的试管里,仔细观察一会儿,取出,用水洗净铁丝,铁丝表面和溶液颜色有什么变化?
讨论:
①上面两个反应中的生成物有什么共同之处?
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?
现 象 化学方程式
铁锈+盐酸 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+硫酸 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
同学们在此实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。
2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁片表面会冒出气泡。
这是为什么呢?
加入的酸量不同!
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
结论:酸能与金属氧化物反应有水生成
一、酸能使酸碱指示剂显示不同的颜色;
二、酸能与多种活泼金属反应,生成氢气;
三、酸能与某些金属氧化物反应,生成水。
酸有一些相似的化学性质:
你还有什么收获?
方法
从个别推导到一般
从具体到抽象
我也来试一把
已知:
2HCl+CaCO3=2CaCl2+H2O+CO2↑
2HCl+Na2CO3=2NaCl+H2O+CO2↑
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑、
请根据所给信息推理出合理的结论。
酸能与盐反应生成新盐和新酸
小试身手(我会选择)
1、 下列物质放入或通入水中能使紫色石蕊试液变红的是( )
A. Cu(OH)2 B. NaOH C. CO2 D . NaCl
2、 下列金属与盐酸反应,剧烈程度排列顺序正确的是( )
A. Fe Al Mg Zn B. Mg Al Zn Fe
C. Mg Fe Al Zn D. Zn Fe Mg Al
3、某无色溶液滴加紫色石蕊试溶液变为红色,则不可能是( )
A. HCl B. H2SO4 C. Na Cl D.CH3COOH
不能用金属和酸直接反应得到的物质是( )
A. MgCl2 B. FeCl3 C. ZnSO4 D. FeCl2
C
B
C
B
我会填空
5、MgO与稀盐酸反应的化学方程式 :
Al2O3与稀盐酸反应的化学方程式 :
Al2O3+6HCl=2AlCl3+3H2O
MgO+2HCl=MgCl2+ H2O
谢谢大家!
课题:探究酸的化学性质
学习目标
1.掌握酸的化学性质。
2.通过活动与探究掌握酸的化学性质。
3.树立科学的物质观,学会用辩证的观点看待事物,能透过表面现象挖掘事物具有共性的本质原因。
知识回顾
1.常见的酸碱指示剂有哪些,它们遇酸碱如何变色;
2.浓硫酸如何稀释;
3.盐酸和稀硫酸各具有哪些用途。
苹果酸
硫酸
柠檬酸
乳酸
盐酸
碳酸
有两瓶未贴标签的稀盐酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
探究活动1
你的方案一:用紫色石蕊溶液
酸的溶液能使紫色石蕊变成红色
酸的溶液不能使无色酚酞溶液变色
紫色石蕊变成溶液红色
紫色石蕊变成溶液红色
无色酚酞溶液不变色
无色酚酞溶液不变色
依据:紫色石蕊遇酸溶液变成红色
结论:酸能与指示剂反应
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
规 律
你的方案二:用较活泼的金属来鉴区别
结论:酸能与较活泼的金属反应产生氢气
反应非常剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
问题:
同学们在日常生活中见到过或用到过哪些除铁锈的方法?
提示:铁锈的主要成分是Fe2O3
探究活动2 将一段生锈的铁丝分别用细线系好放入盛有稀盐酸和稀硫酸的试管里,仔细观察一会儿,取出,用水洗净铁丝,铁丝表面和溶液颜色有什么变化?
讨论:
①上面两个反应中的生成物有什么共同之处?
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?
现 象 化学方程式
铁锈+盐酸 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+硫酸 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
同学们在此实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。
2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁片表面会冒出气泡。
这是为什么呢?
加入的酸量不同!
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
结论:酸能与金属氧化物反应有水生成
一、酸能使酸碱指示剂显示不同的颜色;
二、酸能与多种活泼金属反应,生成氢气;
三、酸能与某些金属氧化物反应,生成水。
酸有一些相似的化学性质:
你还有什么收获?
方法
从个别推导到一般
从具体到抽象
我也来试一把
已知:
2HCl+CaCO3=2CaCl2+H2O+CO2↑
2HCl+Na2CO3=2NaCl+H2O+CO2↑
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑、
请根据所给信息推理出合理的结论。
酸能与盐反应生成新盐和新酸
小试身手(我会选择)
1、 下列物质放入或通入水中能使紫色石蕊试液变红的是( )
A. Cu(OH)2 B. NaOH C. CO2 D . NaCl
2、 下列金属与盐酸反应,剧烈程度排列顺序正确的是( )
A. Fe Al Mg Zn B. Mg Al Zn Fe
C. Mg Fe Al Zn D. Zn Fe Mg Al
3、某无色溶液滴加紫色石蕊试溶液变为红色,则不可能是( )
A. HCl B. H2SO4 C. Na Cl D.CH3COOH
不能用金属和酸直接反应得到的物质是( )
A. MgCl2 B. FeCl3 C. ZnSO4 D. FeCl2
C
B
C
B
我会填空
5、MgO与稀盐酸反应的化学方程式 :
Al2O3与稀盐酸反应的化学方程式 :
Al2O3+6HCl=2AlCl3+3H2O
MgO+2HCl=MgCl2+ H2O
谢谢大家!
