课题 2 金属的化学性质 课件(21张PPT)
文档属性
| 名称 | 课题 2 金属的化学性质 课件(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-06 22:31:14 | ||
图片预览





文档简介
(共21张PPT)
金属的化学性质
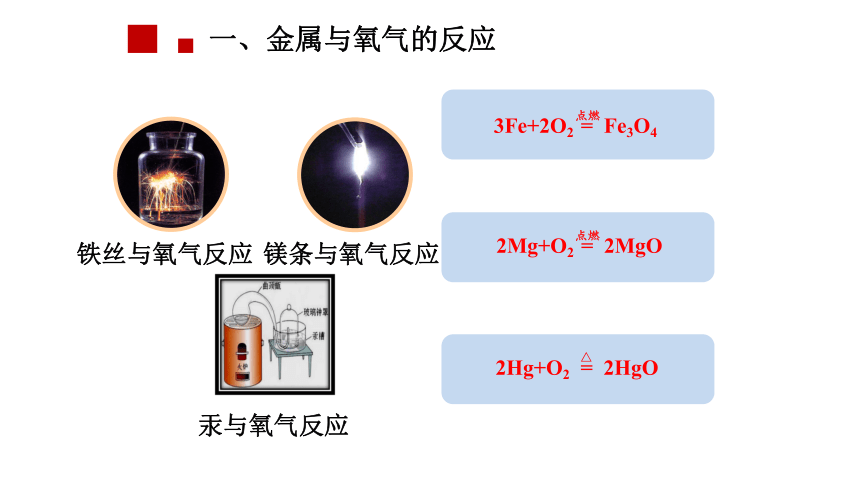
3Fe+2O2 = Fe3O4
点燃
铁丝与氧气反应
2Mg+O2 = 2MgO
点燃
镁条与氧气反应
2Hg+O2 = 2HgO
△
汞与氧气反应
一、金属与氧气的反应
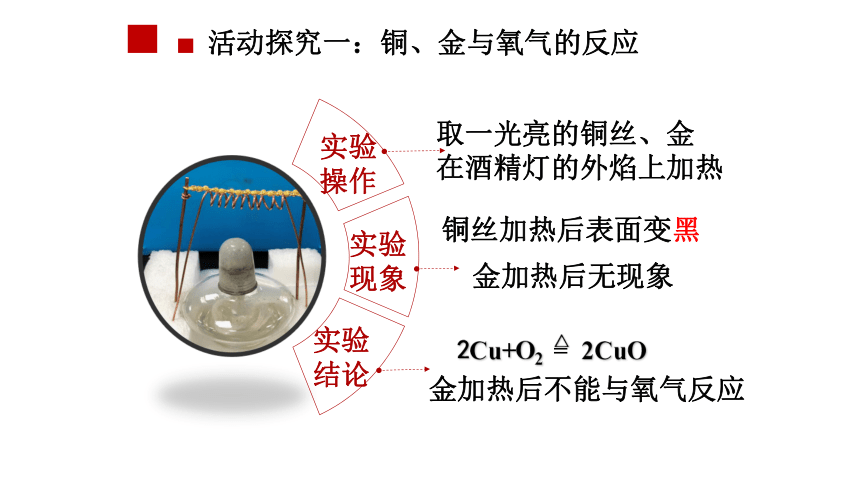
实验操作
实验现象
实验结论
取一光亮的铜丝、金
在酒精灯的外焰上加热
铜丝加热后表面变黑
金加热后无现象
2Cu+O2 = 2CuO
△
活动探究一:铜、金与氧气的反应
金加热后不能与氧气反应
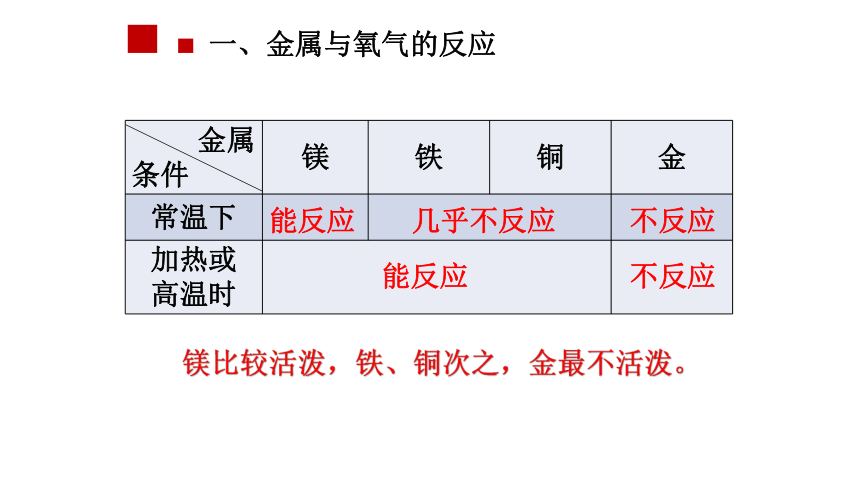
一、金属与氧气的反应
金属
条件 镁 铁 铜 金
常温下
加热或
高温时
几乎不反应
能反应
能反应
不反应
不反应
镁比较活泼,铁、铜次之,金最不活泼。
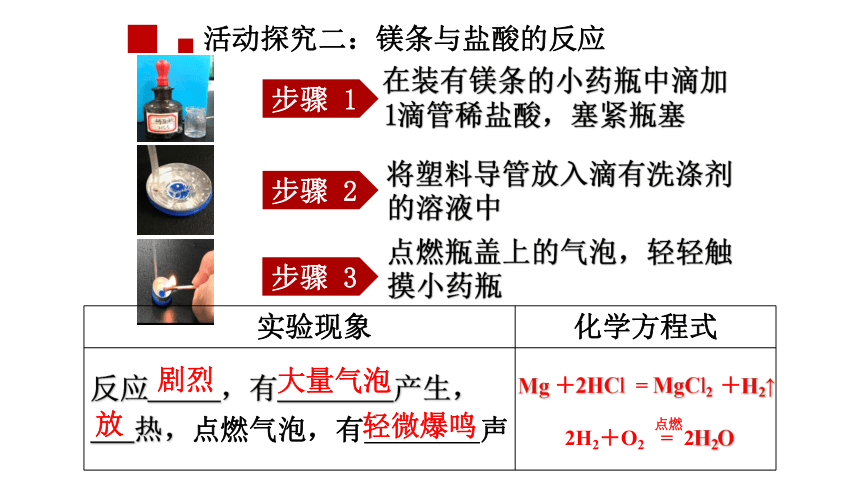
步骤 1
步骤 2
步骤 3
在装有镁条的小药瓶中滴加1滴管稀盐酸,塞紧瓶塞
将塑料导管放入滴有洗涤剂的溶液中
点燃瓶盖上的气泡,轻轻触摸小药瓶
实验现象 化学方程式
反应 ,有 产生,
热,点燃气泡,有 声
剧烈
大量气泡
放
轻微爆鸣
活动探究二:镁条与盐酸的反应
Mg +2HCl = MgCl2 +H2↑
2H2+O2 = 2H2O
点燃
活动探究三:锌粒与稀硫酸的反应
反应 ,持续有 产生
在试管里放入少量锌粒,加入少量稀硫酸
Zn +H2SO4 = ZnSO4 +H2↑
实验步骤
实验现象
实验结论
较快
气泡
温度传感器
活动探究四:金属铁、铜与稀硫酸的反应
在两个孔穴中,放入打磨过大小相同的铁、铜各一片,分别滴入相同浓度的稀硫酸1滴管。
金属 实验现象 化学方程式
铁 反应 ,有少量 产生,
铜 。
缓慢
气泡
Fe + H2SO4 = FeSO4 +H2↑
资料卡片
Fe2+的水溶液显浅绿色
Fe3+的水溶液显黄色
溶液变成浅绿色
无现象
二、金属与盐酸、稀硫酸反应
交流讨论
从反应物和生成物的物质类别的角度分析,这些反应有什么共同特点?
Mg + 2HCl = MgCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
单质
单质
化合物
化合物
置换反应:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
镁与盐酸反应示意图
Cl-
H+
H+
Cl-
H
H
Mg
Mg
2+
宏微分析
Mg+2H+ =Mg2+ +H2
镁、锌、铁能置换出盐酸或稀硫酸中的氢,而铜不能,所以它们的金属活动性比铜强。
还有其他方法说明铁的金属活动性比铜强吗?
西汉《淮南万毕术》“曾青得铁
则化为铜”湿法炼铜的原理。
Fe + CuSO4 = Cu + FeSO4
金属活动性强的金属可以将活动性弱的金属从它的化合物溶液中置换出来。
金属 实验现象 化学方程式
铜片浸入硝酸银溶液中 金属由 色变成 色
溶液由 色变成 色
Cu +2AgNO3 = 2Ag+Cu(NO3)2
三、金属与某些金属的化合物溶液的反应
活动探究五:设计实验判断铜和银的活动性
紫红
银白
无
蓝
电子显微镜
铜的金属活动性比银强
常见金属在溶液中的活动性顺序
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
交流讨论
金属活动性顺序可以给我们哪些判断的依据呢?
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
拓展提升
铝
制
品
金属活动性由强逐渐减弱
方法1:
加热铝箔
实验步骤
实验现象
实验结论
用镊子夹住一小块打磨过的铝箔,在酒精灯外焰上加热。
铝箔熔化,但不滴落。
活动探究六:铝与空气中氧气的反应
打磨过的铝箔,在空气中也会很快生成新的氧化膜Al2O3, Al2O3的熔点高于Al的熔点,包在铝的外面,熔化的液态铝不会滴落下来。
资料卡片
铝的表面有一层氧化铝薄膜。
将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
方法2:测定氧气含量的变化
氧气传感器
铝的表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,所以铝具有很好的抗腐蚀性能。
4Al + 3O2 = 2Al2O3
2Al + 3HgCl2 = 3Hg + 2AlCl3
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
化学方程式
金属的用途不仅与它们的物理性质有密切关系,而且与它们的化学性质有密切关系。
1.调查如何利用金属资源和对金属资源的保护。
2.调查我国冶炼金属的发展史。
课后调查
金属的化学性质
3Fe+2O2 = Fe3O4
点燃
铁丝与氧气反应
2Mg+O2 = 2MgO
点燃
镁条与氧气反应
2Hg+O2 = 2HgO
△
汞与氧气反应
一、金属与氧气的反应
实验操作
实验现象
实验结论
取一光亮的铜丝、金
在酒精灯的外焰上加热
铜丝加热后表面变黑
金加热后无现象
2Cu+O2 = 2CuO
△
活动探究一:铜、金与氧气的反应
金加热后不能与氧气反应
一、金属与氧气的反应
金属
条件 镁 铁 铜 金
常温下
加热或
高温时
几乎不反应
能反应
能反应
不反应
不反应
镁比较活泼,铁、铜次之,金最不活泼。
步骤 1
步骤 2
步骤 3
在装有镁条的小药瓶中滴加1滴管稀盐酸,塞紧瓶塞
将塑料导管放入滴有洗涤剂的溶液中
点燃瓶盖上的气泡,轻轻触摸小药瓶
实验现象 化学方程式
反应 ,有 产生,
热,点燃气泡,有 声
剧烈
大量气泡
放
轻微爆鸣
活动探究二:镁条与盐酸的反应
Mg +2HCl = MgCl2 +H2↑
2H2+O2 = 2H2O
点燃
活动探究三:锌粒与稀硫酸的反应
反应 ,持续有 产生
在试管里放入少量锌粒,加入少量稀硫酸
Zn +H2SO4 = ZnSO4 +H2↑
实验步骤
实验现象
实验结论
较快
气泡
温度传感器
活动探究四:金属铁、铜与稀硫酸的反应
在两个孔穴中,放入打磨过大小相同的铁、铜各一片,分别滴入相同浓度的稀硫酸1滴管。
金属 实验现象 化学方程式
铁 反应 ,有少量 产生,
铜 。
缓慢
气泡
Fe + H2SO4 = FeSO4 +H2↑
资料卡片
Fe2+的水溶液显浅绿色
Fe3+的水溶液显黄色
溶液变成浅绿色
无现象
二、金属与盐酸、稀硫酸反应
交流讨论
从反应物和生成物的物质类别的角度分析,这些反应有什么共同特点?
Mg + 2HCl = MgCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
单质
单质
化合物
化合物
置换反应:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
镁与盐酸反应示意图
Cl-
H+
H+
Cl-
H
H
Mg
Mg
2+
宏微分析
Mg+2H+ =Mg2+ +H2
镁、锌、铁能置换出盐酸或稀硫酸中的氢,而铜不能,所以它们的金属活动性比铜强。
还有其他方法说明铁的金属活动性比铜强吗?
西汉《淮南万毕术》“曾青得铁
则化为铜”湿法炼铜的原理。
Fe + CuSO4 = Cu + FeSO4
金属活动性强的金属可以将活动性弱的金属从它的化合物溶液中置换出来。
金属 实验现象 化学方程式
铜片浸入硝酸银溶液中 金属由 色变成 色
溶液由 色变成 色
Cu +2AgNO3 = 2Ag+Cu(NO3)2
三、金属与某些金属的化合物溶液的反应
活动探究五:设计实验判断铜和银的活动性
紫红
银白
无
蓝
电子显微镜
铜的金属活动性比银强
常见金属在溶液中的活动性顺序
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
交流讨论
金属活动性顺序可以给我们哪些判断的依据呢?
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
拓展提升
铝
制
品
金属活动性由强逐渐减弱
方法1:
加热铝箔
实验步骤
实验现象
实验结论
用镊子夹住一小块打磨过的铝箔,在酒精灯外焰上加热。
铝箔熔化,但不滴落。
活动探究六:铝与空气中氧气的反应
打磨过的铝箔,在空气中也会很快生成新的氧化膜Al2O3, Al2O3的熔点高于Al的熔点,包在铝的外面,熔化的液态铝不会滴落下来。
资料卡片
铝的表面有一层氧化铝薄膜。
将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
方法2:测定氧气含量的变化
氧气传感器
铝的表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,所以铝具有很好的抗腐蚀性能。
4Al + 3O2 = 2Al2O3
2Al + 3HgCl2 = 3Hg + 2AlCl3
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
化学方程式
金属的用途不仅与它们的物理性质有密切关系,而且与它们的化学性质有密切关系。
1.调查如何利用金属资源和对金属资源的保护。
2.调查我国冶炼金属的发展史。
课后调查
同课章节目录
