第二节 盐的性质 课件(17张PPT)
文档属性
| 名称 | 第二节 盐的性质 课件(17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1004.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-06 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
盐 的 性 质
九年级化学
近三年省中考化学盐部分
试题的分值
年份 试题类型 知识点 分值
2016 选择、填空、推断、实验 常见盐的化学性质、用途 12
2017 填空、推断 化学肥料、盐和盐之间的转化
12
2018 推断,实验 盐的化学性质,氮肥的检验 18
复习目标
1 常见盐的特性和用途
2 盐的化学性质
3 离子的检验
4 复分解反应的探究及应用
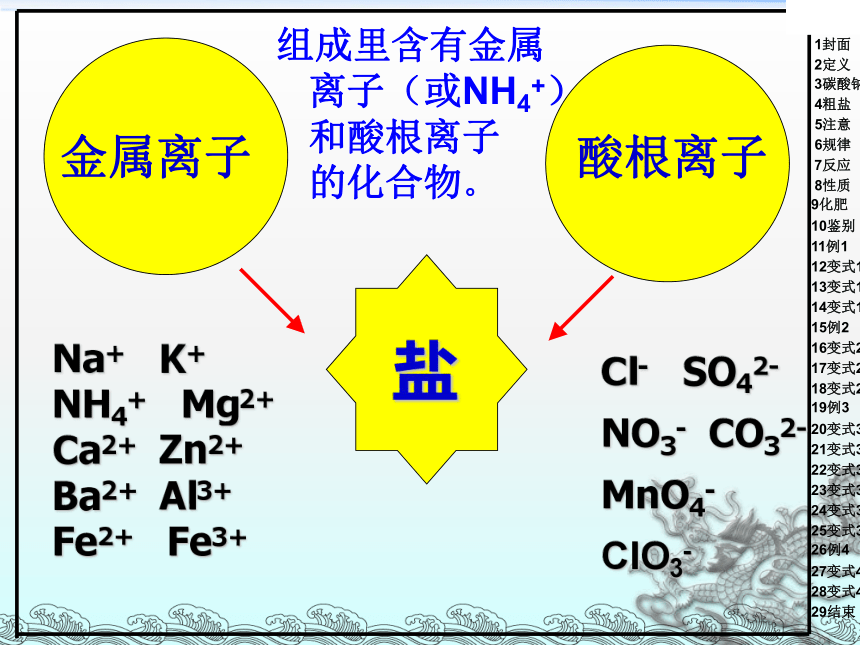
Na+ K+ NH4+ Mg2+ Ca2+ Zn2+ Ba2+ Al3+ Fe2+ Fe3+
Cl- SO42- NO3- CO32- MnO4-
ClO3-
组成里含有金属离子(或NH4+)和酸根离子 的化合物。
盐
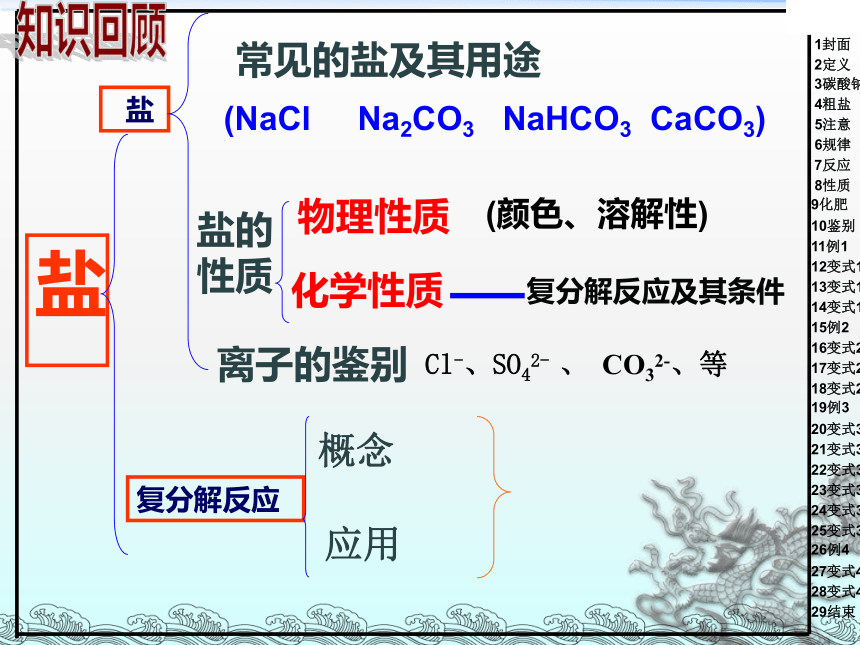
常见的盐及其用途
盐的
性质
(颜色、溶解性)
离子的鉴别
复分解反应
盐
(NaCl Na2CO3 NaHCO3 CaCO3)
Cl-、SO42- 、 CO32-、等
概念
应用
考点1:盐的物理性质
1 下列物质的名称、俗名与化学式完全对应的是( )
A.氯化钠 食盐 NaCl2
B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO
D.氢氧化钠 火碱 NaOH
考点2:盐的化学性质
一:盐与金属反应:
盐+金属→另一种盐+另一种金属
归纳:反应物:①盐溶于水,②前面的金属置换 后面的金属 ③K、Ca、Na除外
二、盐与酸反应:
盐+酸→另一种盐+另一种酸
归纳:生成物:有气体或水或沉淀
三、盐与碱反应
盐+碱→另一种盐+另一种碱
归纳:反应物都可溶,生成物至少有一种沉淀物
Ca(OH)2 + NH4Cl ===
Ca(OH)2 + Na2CO3 ===
(工业上用纯碱制取烧碱)
NaOH + CuSO4 ===
四、盐与盐反应:
盐 + 盐→ 另两种盐
如:NaCl+AgNO3===
Na2SO4+BaCl2===
归纳:反应物都可溶,生成物至少有一种沉淀物
思路: 除杂的原则,不能“玉石俱焚”,不能“前门 驱虎,后门进狼”;
思考:选用一种试剂除去下列物质中的杂质(括号内为杂质)。
NaNO3溶液(NaCl) 。
温馨提示:复分解,两头顾,先顾头,后顾尾。顾头要看溶解性,顾尾气体沉淀水。(反应物:有酸酸必溶,无酸碱盐溶。生成物:有水或气体或沉淀。
考点3:复分解反应
练习.(2016.兰州)下列离子能在溶液中大量共存的是( )
A.K+、NO3-、Na+、OH-
B. CO32-、K+、Cl-、Ca 2+
C. H+、Ba 2+、Cl-、SO42-
D.K+、OH-、SO42-、Cu 2+
思路:
能反应不共存
1.[2017·甘南]下列各组物质溶于足量的水中,充分搅拌,能得到无色透明溶液的是( )
D.CaCl2 Na2CO3 NaOH
A.CuSO4 HCl KCl
B.H2SO4 KNO3 BaCl2
C.HCl KNO3 BaCl2
2.(2017?兰州)下列框图中的物质均为中学化学常见物质,其中A是大理石的主要成分,B是黑色粉末,H是蓝色沉淀.如图是它们之间的转化关系,请回答
(1)写出下列物质的化学式:B C ;
(2)写出F+G→H的化学方程式: ;
(3)写出物质E的一种用途 .
3. (2017?省卷)将一定量的K2CO3溶液与BaCl2溶液混合,过滤反应后的混合物.某研究小组的同学们欲探究滤液中溶质的组成.请你一同参与探究并回答有关问题
【查阅资料】K2CO3溶液显碱性;KCl、 BaCl2溶液 显中性
【提出猜想】
猜想1:滤液中溶质是KCl; 猜想2:滤液中溶质是_____和____ 猜想3:滤液中溶质是KCI和K2CO3的混合物
【反思交流】 要使烧杯内溶液的溶质只含有KCl,要除去杂质,可用的方法是向烧杯内加入适量的___,然后过滤,该除杂的化学方程式_____________________________。
(1)取少量滤液于试管中,滴几滴无色酚酞试液,震荡
猜想___不成立
(2)另取少量滤液于另一支试管中,滴加K2CO3溶液
无明显现象
实验步骤 实验现象 结论
_____________________ 猜想2成立,
新盐+金属
新盐+新酸
新盐+新碱
新盐+新盐
盐
碱
盐
金属
酸
努力拼搏、
奋勇向上、
为自己扬帆、
为明天喝彩!
布置作业 :
配套练习27页15、17题
盐 的 性 质
九年级化学
近三年省中考化学盐部分
试题的分值
年份 试题类型 知识点 分值
2016 选择、填空、推断、实验 常见盐的化学性质、用途 12
2017 填空、推断 化学肥料、盐和盐之间的转化
12
2018 推断,实验 盐的化学性质,氮肥的检验 18
复习目标
1 常见盐的特性和用途
2 盐的化学性质
3 离子的检验
4 复分解反应的探究及应用
Na+ K+ NH4+ Mg2+ Ca2+ Zn2+ Ba2+ Al3+ Fe2+ Fe3+
Cl- SO42- NO3- CO32- MnO4-
ClO3-
组成里含有金属离子(或NH4+)和酸根离子 的化合物。
盐
常见的盐及其用途
盐的
性质
(颜色、溶解性)
离子的鉴别
复分解反应
盐
(NaCl Na2CO3 NaHCO3 CaCO3)
Cl-、SO42- 、 CO32-、等
概念
应用
考点1:盐的物理性质
1 下列物质的名称、俗名与化学式完全对应的是( )
A.氯化钠 食盐 NaCl2
B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO
D.氢氧化钠 火碱 NaOH
考点2:盐的化学性质
一:盐与金属反应:
盐+金属→另一种盐+另一种金属
归纳:反应物:①盐溶于水,②前面的金属置换 后面的金属 ③K、Ca、Na除外
二、盐与酸反应:
盐+酸→另一种盐+另一种酸
归纳:生成物:有气体或水或沉淀
三、盐与碱反应
盐+碱→另一种盐+另一种碱
归纳:反应物都可溶,生成物至少有一种沉淀物
Ca(OH)2 + NH4Cl ===
Ca(OH)2 + Na2CO3 ===
(工业上用纯碱制取烧碱)
NaOH + CuSO4 ===
四、盐与盐反应:
盐 + 盐→ 另两种盐
如:NaCl+AgNO3===
Na2SO4+BaCl2===
归纳:反应物都可溶,生成物至少有一种沉淀物
思路: 除杂的原则,不能“玉石俱焚”,不能“前门 驱虎,后门进狼”;
思考:选用一种试剂除去下列物质中的杂质(括号内为杂质)。
NaNO3溶液(NaCl) 。
温馨提示:复分解,两头顾,先顾头,后顾尾。顾头要看溶解性,顾尾气体沉淀水。(反应物:有酸酸必溶,无酸碱盐溶。生成物:有水或气体或沉淀。
考点3:复分解反应
练习.(2016.兰州)下列离子能在溶液中大量共存的是( )
A.K+、NO3-、Na+、OH-
B. CO32-、K+、Cl-、Ca 2+
C. H+、Ba 2+、Cl-、SO42-
D.K+、OH-、SO42-、Cu 2+
思路:
能反应不共存
1.[2017·甘南]下列各组物质溶于足量的水中,充分搅拌,能得到无色透明溶液的是( )
D.CaCl2 Na2CO3 NaOH
A.CuSO4 HCl KCl
B.H2SO4 KNO3 BaCl2
C.HCl KNO3 BaCl2
2.(2017?兰州)下列框图中的物质均为中学化学常见物质,其中A是大理石的主要成分,B是黑色粉末,H是蓝色沉淀.如图是它们之间的转化关系,请回答
(1)写出下列物质的化学式:B C ;
(2)写出F+G→H的化学方程式: ;
(3)写出物质E的一种用途 .
3. (2017?省卷)将一定量的K2CO3溶液与BaCl2溶液混合,过滤反应后的混合物.某研究小组的同学们欲探究滤液中溶质的组成.请你一同参与探究并回答有关问题
【查阅资料】K2CO3溶液显碱性;KCl、 BaCl2溶液 显中性
【提出猜想】
猜想1:滤液中溶质是KCl; 猜想2:滤液中溶质是_____和____ 猜想3:滤液中溶质是KCI和K2CO3的混合物
【反思交流】 要使烧杯内溶液的溶质只含有KCl,要除去杂质,可用的方法是向烧杯内加入适量的___,然后过滤,该除杂的化学方程式_____________________________。
(1)取少量滤液于试管中,滴几滴无色酚酞试液,震荡
猜想___不成立
(2)另取少量滤液于另一支试管中,滴加K2CO3溶液
无明显现象
实验步骤 实验现象 结论
_____________________ 猜想2成立,
新盐+金属
新盐+新酸
新盐+新碱
新盐+新盐
盐
碱
盐
金属
酸
努力拼搏、
奋勇向上、
为自己扬帆、
为明天喝彩!
布置作业 :
配套练习27页15、17题
