第12章 盐复习课件(22张PPT)
图片预览






文档简介
(共22张PPT)
酸碱盐 复习课
高效复习
盐
猜猜这是谁?
1、他是我国著名的化学家,是我
国制碱工业的先驱和奠基人,发明
了“联合制碱法”,为纯碱和氮肥工
业技术发展做出杰出的贡献,
他是_______。
2.它不是碱,但俗名中却有“碱”,可以用它来于玻璃,造纸,纺织等工艺,也可以做洗涤剂,……,它是________。
侯德榜
Na2CO3
猜猜这是谁?
3. 它是一种盐,老年人可以用它来适当补充某种元素以增强骨头功能,它是大理石、鸡蛋壳及水垢的主要成份,……,它是 。
4.它是一种盐,是烹饪使用的调味品,它在人体血液中所占质量分数为0.9%……它是 。
5. 它是一种盐,是发酵粉的主要成分,自制汽水时常常用到它……它是 。
CaCO3
NaCl
NaHCO3
一、盐
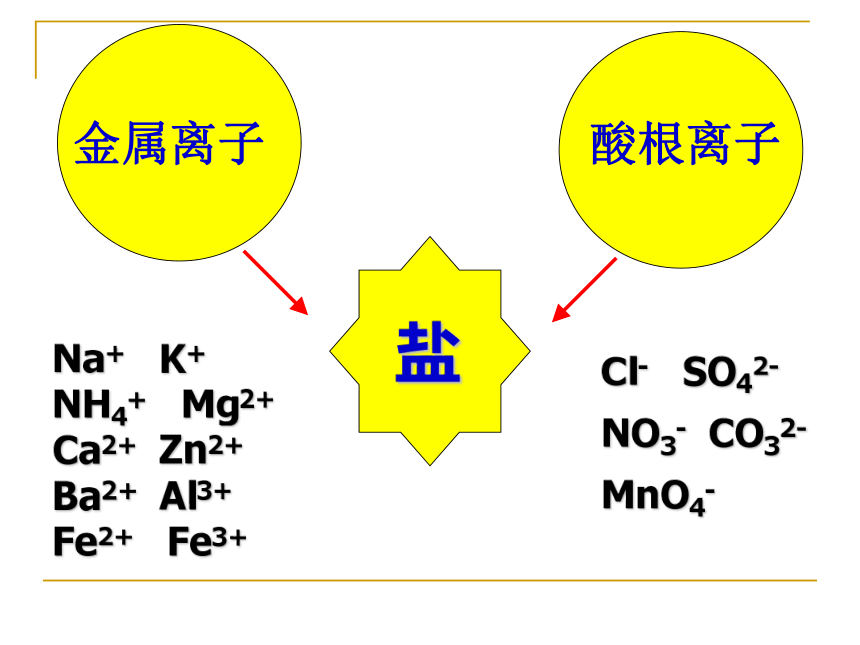
定义:
组成里含有金属离子(或NH4+)和酸根离子 的化合物。
Na+ K+ NH4+ Mg2+ Ca2+ Zn2+ Ba2+ Al3+ Fe2+ Fe3+
Cl- SO42- NO3- CO32- MnO4-
一、盐
NaCl
Na2CO3
NaHCO3
CaCO3
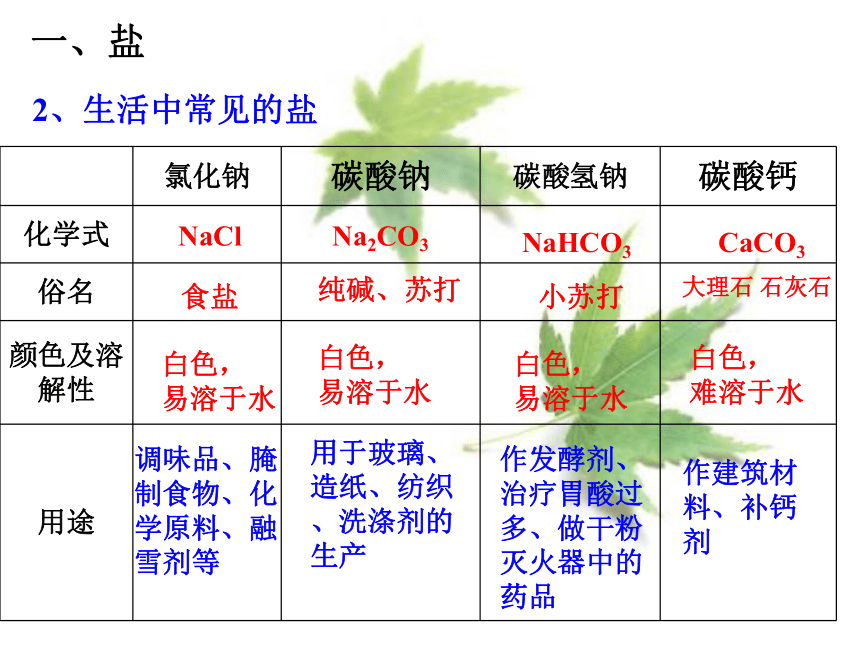
白色,
易溶于水
小苏打
食盐
大理石 石灰石
白色,
易溶于水
白色,
易溶于水
白色,
难溶于水
纯碱、苏打
调味品、腌制食物、化学原料、融雪剂等
用于玻璃、造纸、纺织、洗涤剂的生产
作建筑材料、补钙剂
作发酵剂、治疗胃酸过多、做干粉灭火器中的药品
2、生活中常见的盐
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗名
颜色及溶解性
用途
3、常见盐的溶解性:
______________________ 都易溶于水中间。
盐酸盐不溶___________ ,
硫酸盐不溶___________ ,
碳酸盐只溶__________________ ,
熟记几种常见沉淀:
碱沉淀: Cu(OH)2 Fe(OH)3 Al(OH)3 Mg(OH)2
碳酸盐沉淀: CaCO3 BaCO3
其它盐沉淀: AgCl BaSO4
钾钠铵盐硝酸盐
BaSO4
AgCl
钾、钠、铵
蓝色
红褐色
1 下列物质的名称、俗名与化学式完全对应的是( )
A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH
D
2. 判断正误
显碱性的物质一定是碱;
盐是组成里含有金属离子 和酸根离子的化合物。所以盐中一定含有金属元素;
× 也有可能是盐,例Na2CO3
× 某些铵盐中不含金属元素,例:NH4Cl
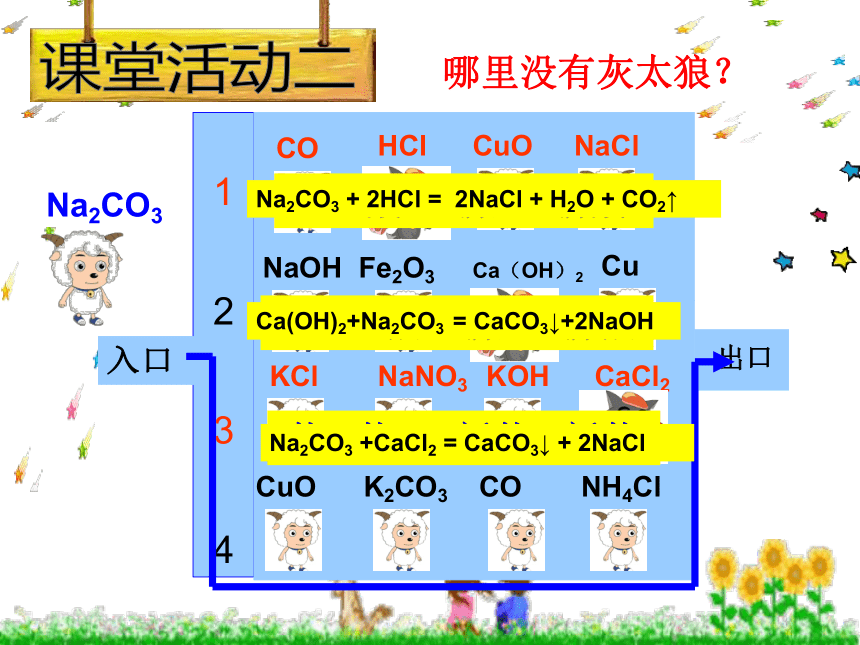
哪里没有灰太狼?
1
2
3
4
出口
入口
盐 + 酸 →新盐+新酸
盐 + 碱→新盐+新碱
盐+盐 → 新盐+新盐
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
Na2CO3 +CaCl2 = CaCO3↓ + 2NaCl
两种化合物相互交换成分,生成两种新的化合物。
发生的条件:
(1)、有气体生成
(2)、有沉淀生成
(3)、有水生成(中和反应是复分解反应中的一种反应)
三个条件中至少满足一项
二、盐的化学性质
1. 盐 + 酸 →新盐+新酸
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
※ HCl + AgNO3 = AgCl ↓+ HNO3
※ H2SO4 + BaCl2 = BaSO4↓+2HCl
二、盐的化学性质
2. 盐 + 碱 →新盐+新碱
Ca(OH)2 + Na2CO3 =2NaOH + CaCO3 ↓
(工业上用纯碱制取烧碱)
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
Ca(OH)2 + 2NH4NO3 = Ca(NO3)2 +2 NH3↑ +2 H2O
二、盐的化学性质
3. 盐 + 盐 →新盐+新盐
3
3
3
二、盐的化学性质
4. 盐 +金属 → 新盐 + 新金属
Fe + CuSO4 = FeSO4 + Cu
Cu + 2 AgNO3 = 2 Ag + Cu(NO3)2
2Al + 3CuSO4 = 3Cu + Al2(SO4)3
金属活动性顺序中,位于前面的金属,能把位于后面的金属从它的盐溶液中置换出来。
下列试剂中,不能用来检验氢氧化钠溶液是否变质的是: ( )
A 酚酞试剂 B 稀硫酸
C 澄清石灰水 D 氯化钙溶液
A
思路: 本题的实质就是,在有氢氧化钠存在的情况 下,如何检验碳酸钠的存在。可选的试剂有:
酸: HCl H2SO4 HNO3
碱: Ca(OH)2 Ba(OH)2
盐: CaCl2 Ca(NO3)2 BaCl2 Ba(NO3)2
2NaOH + CO2 = Na2CO3 + H2O
1. 用括号内物质不能一次性区别开下列各组物质的是 ( )
A.CaO、CaCO3、KCl 三种固体(水)
B.CaCl2 、Na2CO3、K2SO4三种溶液 【Ba(OH)2溶液】
C.Cu、Fe、CuO三种固体(稀盐酸)
D.AgNO3 、NaNO3 、K2CO3三种溶液 【稀盐酸】
思路: 要求加入一种物质后,被鉴别的三种物 质会出现三种不同的现象;
无法区分Na2CO3和K2SO4
2.下列各组物质在溶液中能大量共存且形成无色溶液的是( )
A.NaCl BaCl2 Na2CO3
B.KNO3 HCl CaCl2
C.H2SO4 FeCl3 NaNO3
D.NaOH HNO3 NH4NO3
思路: 能大量共存,即相互之间不能发生反应;
3.下列除去物质中的少量杂质(括号内为杂质)的方法,正确的是( )
A.CO(CO2)——通过足量的灼热氧化铜
B.MnO2粉末(KCl)——溶解、过滤、洗涤、干燥
C.FeSO4溶液(CuSO4)——加入足量锌粉、过滤
D.Na2SO4溶液(NaCl)——加入适量硝酸银溶液、过滤
思路: 除杂的原则,不能“玉石俱焚”,不能“前门 驱虎,后门进狼”;
反应掉了CO
引入了ZnSO4
引入了NaNO3
4.下列离子能在溶液中大量共存的是( )
A.K+、NO3-、Na+、OH-
B. CO32-、K+、Cl-、Ca 2+
C. H+、Ba 2+、Cl-、SO42-
D.K+、OH-、SO42-、Cu 2+
思路: 某些离子能结合在一起,形成沉淀,气体或者水,则这些离子不能共存。
小结:常见不能共存的离子组合
1、生成沉淀类
Ba2+与SO42-、Ba2+与CO32- 、Ca2+与CO32-
Cu2+与OH- 、Fe3+与OH- 、Mg2+与OH-
Al 3+与OH- Ag+与Cl-
2、生成气体类
NH4+与OH-、 H+与CO32- H+与HCO3-
3、生成水
H+与OH-
5.由一种盐和一种碱组成的固体混合物,按下图的步骤进行实验。请回答:
(1)白色沉淀B是 (填化学式)。
(2)写出滤液A与CuSO4溶液反应的方程式 。
(3)若固体中的盐不含氢元素,则这种固体混合物可能是
① 和 ; ② 和 。
Na2SO4
Cu(OH)2
NaOH
CaCO3
CaCO3
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 ↓
NaOH
CaCO3
Na2CO3
Ca(OH)2
酸碱盐 复习课
高效复习
盐
猜猜这是谁?
1、他是我国著名的化学家,是我
国制碱工业的先驱和奠基人,发明
了“联合制碱法”,为纯碱和氮肥工
业技术发展做出杰出的贡献,
他是_______。
2.它不是碱,但俗名中却有“碱”,可以用它来于玻璃,造纸,纺织等工艺,也可以做洗涤剂,……,它是________。
侯德榜
Na2CO3
猜猜这是谁?
3. 它是一种盐,老年人可以用它来适当补充某种元素以增强骨头功能,它是大理石、鸡蛋壳及水垢的主要成份,……,它是 。
4.它是一种盐,是烹饪使用的调味品,它在人体血液中所占质量分数为0.9%……它是 。
5. 它是一种盐,是发酵粉的主要成分,自制汽水时常常用到它……它是 。
CaCO3
NaCl
NaHCO3
一、盐
定义:
组成里含有金属离子(或NH4+)和酸根离子 的化合物。
Na+ K+ NH4+ Mg2+ Ca2+ Zn2+ Ba2+ Al3+ Fe2+ Fe3+
Cl- SO42- NO3- CO32- MnO4-
一、盐
NaCl
Na2CO3
NaHCO3
CaCO3
白色,
易溶于水
小苏打
食盐
大理石 石灰石
白色,
易溶于水
白色,
易溶于水
白色,
难溶于水
纯碱、苏打
调味品、腌制食物、化学原料、融雪剂等
用于玻璃、造纸、纺织、洗涤剂的生产
作建筑材料、补钙剂
作发酵剂、治疗胃酸过多、做干粉灭火器中的药品
2、生活中常见的盐
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗名
颜色及溶解性
用途
3、常见盐的溶解性:
______________________ 都易溶于水中间。
盐酸盐不溶___________ ,
硫酸盐不溶___________ ,
碳酸盐只溶__________________ ,
熟记几种常见沉淀:
碱沉淀: Cu(OH)2 Fe(OH)3 Al(OH)3 Mg(OH)2
碳酸盐沉淀: CaCO3 BaCO3
其它盐沉淀: AgCl BaSO4
钾钠铵盐硝酸盐
BaSO4
AgCl
钾、钠、铵
蓝色
红褐色
1 下列物质的名称、俗名与化学式完全对应的是( )
A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH
D
2. 判断正误
显碱性的物质一定是碱;
盐是组成里含有金属离子 和酸根离子的化合物。所以盐中一定含有金属元素;
× 也有可能是盐,例Na2CO3
× 某些铵盐中不含金属元素,例:NH4Cl
哪里没有灰太狼?
1
2
3
4
出口
入口
盐 + 酸 →新盐+新酸
盐 + 碱→新盐+新碱
盐+盐 → 新盐+新盐
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
Na2CO3 +CaCl2 = CaCO3↓ + 2NaCl
两种化合物相互交换成分,生成两种新的化合物。
发生的条件:
(1)、有气体生成
(2)、有沉淀生成
(3)、有水生成(中和反应是复分解反应中的一种反应)
三个条件中至少满足一项
二、盐的化学性质
1. 盐 + 酸 →新盐+新酸
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
※ HCl + AgNO3 = AgCl ↓+ HNO3
※ H2SO4 + BaCl2 = BaSO4↓+2HCl
二、盐的化学性质
2. 盐 + 碱 →新盐+新碱
Ca(OH)2 + Na2CO3 =2NaOH + CaCO3 ↓
(工业上用纯碱制取烧碱)
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
Ca(OH)2 + 2NH4NO3 = Ca(NO3)2 +2 NH3↑ +2 H2O
二、盐的化学性质
3. 盐 + 盐 →新盐+新盐
3
3
3
二、盐的化学性质
4. 盐 +金属 → 新盐 + 新金属
Fe + CuSO4 = FeSO4 + Cu
Cu + 2 AgNO3 = 2 Ag + Cu(NO3)2
2Al + 3CuSO4 = 3Cu + Al2(SO4)3
金属活动性顺序中,位于前面的金属,能把位于后面的金属从它的盐溶液中置换出来。
下列试剂中,不能用来检验氢氧化钠溶液是否变质的是: ( )
A 酚酞试剂 B 稀硫酸
C 澄清石灰水 D 氯化钙溶液
A
思路: 本题的实质就是,在有氢氧化钠存在的情况 下,如何检验碳酸钠的存在。可选的试剂有:
酸: HCl H2SO4 HNO3
碱: Ca(OH)2 Ba(OH)2
盐: CaCl2 Ca(NO3)2 BaCl2 Ba(NO3)2
2NaOH + CO2 = Na2CO3 + H2O
1. 用括号内物质不能一次性区别开下列各组物质的是 ( )
A.CaO、CaCO3、KCl 三种固体(水)
B.CaCl2 、Na2CO3、K2SO4三种溶液 【Ba(OH)2溶液】
C.Cu、Fe、CuO三种固体(稀盐酸)
D.AgNO3 、NaNO3 、K2CO3三种溶液 【稀盐酸】
思路: 要求加入一种物质后,被鉴别的三种物 质会出现三种不同的现象;
无法区分Na2CO3和K2SO4
2.下列各组物质在溶液中能大量共存且形成无色溶液的是( )
A.NaCl BaCl2 Na2CO3
B.KNO3 HCl CaCl2
C.H2SO4 FeCl3 NaNO3
D.NaOH HNO3 NH4NO3
思路: 能大量共存,即相互之间不能发生反应;
3.下列除去物质中的少量杂质(括号内为杂质)的方法,正确的是( )
A.CO(CO2)——通过足量的灼热氧化铜
B.MnO2粉末(KCl)——溶解、过滤、洗涤、干燥
C.FeSO4溶液(CuSO4)——加入足量锌粉、过滤
D.Na2SO4溶液(NaCl)——加入适量硝酸银溶液、过滤
思路: 除杂的原则,不能“玉石俱焚”,不能“前门 驱虎,后门进狼”;
反应掉了CO
引入了ZnSO4
引入了NaNO3
4.下列离子能在溶液中大量共存的是( )
A.K+、NO3-、Na+、OH-
B. CO32-、K+、Cl-、Ca 2+
C. H+、Ba 2+、Cl-、SO42-
D.K+、OH-、SO42-、Cu 2+
思路: 某些离子能结合在一起,形成沉淀,气体或者水,则这些离子不能共存。
小结:常见不能共存的离子组合
1、生成沉淀类
Ba2+与SO42-、Ba2+与CO32- 、Ca2+与CO32-
Cu2+与OH- 、Fe3+与OH- 、Mg2+与OH-
Al 3+与OH- Ag+与Cl-
2、生成气体类
NH4+与OH-、 H+与CO32- H+与HCO3-
3、生成水
H+与OH-
5.由一种盐和一种碱组成的固体混合物,按下图的步骤进行实验。请回答:
(1)白色沉淀B是 (填化学式)。
(2)写出滤液A与CuSO4溶液反应的方程式 。
(3)若固体中的盐不含氢元素,则这种固体混合物可能是
① 和 ; ② 和 。
Na2SO4
Cu(OH)2
NaOH
CaCO3
CaCO3
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 ↓
NaOH
CaCO3
Na2CO3
Ca(OH)2
