华师大版科学九下 第3章 物质的转化和元素的循环 复习课件(共57张PPT)
文档属性
| 名称 | 华师大版科学九下 第3章 物质的转化和元素的循环 复习课件(共57张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-04-07 00:00:00 | ||
图片预览











文档简介
第3章 物质的转化和元素的循环复习课件
知识网络
物质的转化和元素的循环
物质的转化
金属氧化和金属氧化物的还原
单质、氧化物、酸(碱)之间转化
自然界中的氮循环
化学肥料
氮循环
自然界中的碳循环和氧循环
第1节
物质的转化
寒来暑往
大陆漂移
食物腐败
火山喷发
水滴石穿
元素衰变
滴水成冰
花香四溢
蜡炬成灰
野火烧不尽,春风吹又生
千锤万凿出深山,烈火焚烧若等闲
水滴石穿
食物腐败
蜡炬成灰
野火烧不尽,春风吹又生。
烈火焚烧若等闲。
元素衰变
变化的世界
1、手持铜丝在酒精灯外焰加热。
2、把变了黑的热铜丝迅速插入酒精。
活动:
1、铜的和氧化铜的相互转换
问1:用酒精灯火焰在空气中加热铜丝,能观察到什么现象?
紫红色的铜加热后变黑色。
化学方程式:
2Cu + O2 == 2CuO
问2:把变了黑的热铜丝迅速插入酒精,能观察到什么现象?
黑色的固体变紫红色。
化学方程式:
CuO + C2H5OH == Cu + C2H4O + H2O
乙醇
乙醛
以上实验说明
一、金属的氧化和氧化物的还原
金属的和它的氧化物可以相互转换
2Cu+O2 2CuO
铜得氧
铜被氧化
氧化铜失氧
氧化铜被还原
CuO+C2H5O
Cu+C2H4O+H2O
总结1:
得氧,被氧化;失氧,被还原。
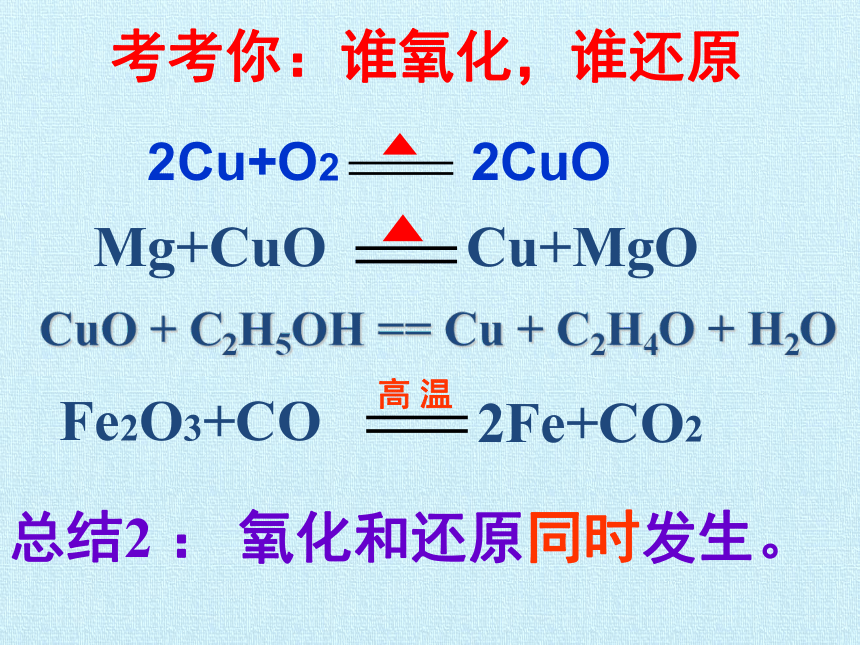
考考你:谁氧化,谁还原
Fe2O3+CO
2Fe+CO2
高 温
Mg+CuO
Cu+MgO
总结2 :
氧化和还原同时发生。
2Cu+O2 2CuO
CuO + C2H5OH == Cu + C2H4O + H2O
物质得到氧跟氧结合,物质被氧化;
物质失去了氧跟氧,物质被还原;
得氧物质—被氧化—发生的是氧化反应—是还原剂。
失氧物质—被还原—发生的是还原反应—是氧化剂。
1、氧化与还原
可见:
判断方法:
3CO + Fe2O3 == 3CO2 ↑ + 2Fe
高温
C + 2CuO == 2 Cu + CO2 ↑
高温
判断下列反应的氧化剂和还原剂,被氧化和被还原。
CO + CuO == Cu + CO2
H2 + CuO == Cu + H2O
Mg + CuO == Cu + MgO
练习:
1、氢气跟氧化铜(CuO)反应
2、碳与氧化铜反应
1、加热一段时间后,发现试管
壁出现:________
2、澄清石灰水变:________,
说明_____________________。
3、木炭跟氧化铜反应,生成
了_____和_________。
4、化学方程式:
________________________。
红色物质
变浑浊
产生的气体是二氧化碳
铜
二氧化碳
C+ 2CuO == 2Cu + CO2↑
思考题:
木炭也能使氧化铜还原,此反应能用H2跟氧化铜反应的装置吗?
3、CO与氧化铜反应
注意:CO有毒要除尾气。用点燃的方法除尾气
现象:试管中黑色的粉末变成红色物质,
澄清的石灰水变浑浊,
尾气燃烧,发出淡蓝色的火焰。
根据前面所学:用CO跟氧化铜加热反应,实验要如何操作?
CO + CuO ==Cu + CO2
化学方程式:
1、定义:
把金属______变成________叫金属的冶炼。
2、常用方法:
____________与___________在__________下反应,夺取金属氧化物的______,得到金属单质。或者用________________置换活动性弱的金属的化合物。
化合物
金属单质
用H2、碳和CO
金属氧化物
加热或高温
氧
冶炼金属的方法
活动性强的金属
3CO + Fe2O3 == 3CO2 ↑ + 2Fe
高温
C + 2CuO == 2 Cu + CO2 ↑
高温
1、用H2、碳或CO
2、活动性强的金属置换活动性弱的金属
Fe + CuSO4 == Cu + FeSO4
CO + CuO == Cu + CO2
H2 + CuO == Cu + H2O
Mg + CuO == Cu + MgO
用稀硫酸和锌反应,生成氢气。再与氧化铜反应。
复习:
用稀硫酸和氧化铜反应,生成硫酸铜,再用Zn置换。
1、由氧化铜制取铜,可用哪些方法?写出化学方程式。
H2 + CuO == Cu + H2O
Zn+H2SO4 == CuSO4 + H2↑
CuO+H2SO4 == CuSO4 + H2O
Zn + CuSO4 == ZnSO4 + Cu
5、绝大部分金属+氧气→金属氧化物
2Mg + O2 == 2 MgO
点燃
3Fe + 2O2 == Fe3O4
点燃
4Al + 3O2 == 2Al2O3
点燃
Pt、Au跟氧气不反应。“真金不怕火炼”
6、金属的保护
致密的氧化物保护膜阻止了金属进一步氧化!
铁制容器为什么不能盛波尔多液?但它为什么能盛放浓硫酸?
铁表面锈铁为什么不能保护铁呢?
铁(Fe)生锈变成氧化铁(Fe2O3)
因为铁和浓硫酸反应会生成致密的氧化物保护膜。
因为铁和硫酸铜反应会生成硫酸亚铁。
金属
氧化物
金属
氧化(得氧)
还原(失氧)
氢气还原氧化铜的设计
一、
二、
小结:
第2节
自然界中的氧循环和碳循环
一、自然界中的氧循环
消耗氧气的途径
产生氧气的途径
物质的燃烧
生物呼吸
植物
光合作用
微生物的
氧化分解
氧气不断的被消耗,又不断的产生,实现物质之间转化和循环、平衡,使氧气在大气中的含量基本保持不变。这也是生命赖以生存的基础。
自然界氧循环对生存有什么意义呢?
1、大自然中氧气的消耗有多种途径,下列不是氧气在大自然中消耗的途径是( )
A、植物的光合作用 B、物质的燃烧
C、合成臭氧 D、生物的呼吸作用
A
2、养有金鱼的缸内,常养些水草,它对金鱼的作用是( )
A、光合作用释放出氧气,有利于金鱼的呼吸
B、使金鱼有较好的活动场所
C、增加美观
D、使金鱼获得光合作用的产物—有机物
A
练一练
二、自然界中的碳循环
碳在自然界中的循环是通过二氧化碳来完成的。
大气中的二氧化碳是通过什么被消耗的?
产生二氧化碳的途径又有哪些?
植物
光合作用
动植物的呼吸作用、有机物的燃烧以及微生物的分解。
自然界中的碳循环
CO2
作用
物
植物 作用
动物吸收 体内
动植物残体
微生物的分解
煤、石油、
天然气
光合
有机
呼吸
氧化
燃烧
三、碳循环的破坏 温室效应
二氧化碳气体为什么会产生温室效应?
感受什么是温室效应
实验
实验现象:__________
解释原因:
温度左低右高
右边杯子热量不易散失。
想想
透明玻璃
温室的保温原理
太阳光透过温室的玻璃后,会使室内的地面温度升高,而地面的辐射却很少能穿透玻璃,因此温室具有保温作用。
假如把这个温室看作是一个巨大的地球,那么玻璃是什么?
二氧化碳
大气中的二氧化碳具有与温室玻璃相似的作用,对地球起着保温的作用,从而产生“温室效应”。
1、CO2占空气总体积的0.03%;自然界中CO2的循环如下图所示,在A处不参与该循环的是( )
A、生物的呼吸作用 B、含碳燃料的燃烧
C、发展利用氢燃料 D、人和动物的呼吸
C
练一练
2、下列情况会使大气中的二氧化碳浓度增多( )
A、利用石灰水吸收空气中的二氧化碳 B、汽车数量增加
C、发展太阳能、水能以代替煤、石油等燃料
D、植树造林
3、碳在自然界中的循环是通过二氧化碳来完成的,自然界中主要吸收二氧化碳的途径是( )
A、呼吸作用 B、蒸腾作用
C、光合作用 D、分解作用
B
C
练一练
4、关于温室效应,有下列说法:①温室效应有利也有弊;②温室效应的加剧是大气层中臭氧层受到破坏引起的;③温室效应的加剧主要是由于大气中的二氧化碳含量升高引起的;④发展太阳能、水能以代替煤、石油等燃料,可以防止温室效应的加剧;⑤适度的温室效应能保证地球上的气温衡定,适于动植物生存;⑥森林被称为地球之肺,所以大力提倡植树造林,可以消除温室效应。其中正确的是( )
A、①②③④⑤⑥ B、①③④⑤
C、①③④⑤⑥ D、①②③④⑤
B
练一练
[深化提高]
1、小朱同学很喜欢养花,并且在每天睡觉前在床前放几瓶花,认为这样房间里的环境优雅且可以在睡觉时呼吸更多的氧气。请你分析小朱同学的做法对不对?
答:不对,因为植物只有在有光的条件下才能进行光合作用,放出氧气。在晚上黑暗的条件下,植物只进行呼吸作用,消耗氧气,放出二氧化碳,会使房间空气中二氧化碳含量升高,氧气含量减小,这样做反而对人的健康不利。
2、近些年,广州等地家里流行一种生态球,其结构是外部用透明玻璃制成的密封球,球内有水,水中有几尾小鱼,还有一些水草等。请你分析这种球放在家里的什么位置较为合适,为什么?并说明球内水草和小鱼能共同长期生存的原因。
答:这种球放在窗户边阳光照到的位置较为合适,因为只有在阳光照到的位置,球内的水草才能进行光合作用。球内的小鱼和水草能长期共同生存的原因是水草靠光合作用制造有机物,并释放出氧气,这些刚好能为小鱼提供食物和氧气,而小鱼产生的二氧化碳恰好是水草光合作用的原料,小鱼消化的排泄物又能为水草提供肥料,所以它们能长期共同生存。
3、如下图所示的密闭装置,一株植物和一支蜡烛放在透明钟罩的底部,假如减少钟罩中的二氧化碳量,同时增加氧气的量,点燃蜡烛,蜡烛燃烧1分钟后自行熄灭。三天后,蜡烛被一个电装置重新点燃,并在熄灭前燃烧了1分钟,请根据图回答问题:
这个实验回答了下列哪个问题: A、是否植物所有的部分都吸收二氧化碳,释放出氧气。 B、植物是否需要阳光才吸收二氧化碳和放出氧气。 C、植物与燃烧的蜡烛对空气是否具有同样的效果。 D、植物吸收的氧气的数量是否大于释放的氧气的数量。
D
你得出这个结论的理由:
第一次蜡烛熄灭,说明钟罩内的氧气已消耗完,过三天后重新点燃蜡烛又能燃烧1分钟,说明植物在这三天中光合作用吸收的二氧化碳的数量大于植物在这三天中进行呼吸作用所消耗的氧气的数量,所以得出了:D
第3节 自然界中的氮循环
思考:为什么施过动物或人的稀尿液的农作物长势特别旺?
一、自然界氮的循环
因为动物和人的尿液里含尿素,尿素为植物生长提供必需氮元素(N)。
1、氮的固定
大气中氮单质(N2)转化为氮的化合物的过程称为氮的固定。
2、固氮的途径
生物固氮
N2+O2放电2NO
N2+3H2高温、高压、催化剂2NH3
工业固氮
大气固氮
3、自然界中氮的循环
细菌分解
硝酸盐
氨或铵盐
大气中的氮
NOX
棉花你的叶子为什么变黄了?
氮肥能促使作物的茎、叶生长茂盛,叶色浓绿。
因为我缺氮!
二、化学肥料
肥料
化学肥料
农家肥料:如厩肥、人粪尿、绿肥等。
氮肥
磷肥
钾肥
复合肥料
微量元素肥料
思考:植物生长需要哪些营养元素?其中土壤中较少,而植物摄取量又较多的是哪些元素?
C、H、O、N、P、K
N、P、K
种类
物质
在植物生长中的作用
缺乏时的表现
氮肥
尿素、氨水、铵盐、硝酸盐
能促进作物的茎叶生长茂盛,叶色浓绿
植株矮小瘦弱,叶片发黄,严重时叶脉呈淡棕色
磷肥
磷矿粉、钙镁磷肥、过磷酸钙
能促进作物根系发达,增强抗寒抗旱能力,能促进作物提早成熟,子粒饱满
植株特别矮小,叶片呈暗绿色,并出现紫色
钾肥
硫酸钾、氯化钾
能保证各种代谢过程的顺利进行
茎干软弱,容易倒伏,叶片的边缘和尖端呈褐色,并焦枯。
复合肥
磷酸二氢铵、磷酸氢二铵、硝酸钾
同时含有两种或两种以上的营养元素,能同时均匀地供给多种养分,有效成分高。
常见化肥的种类与作用
氮肥
磷肥
钾肥
复合肥
铵态氮肥
硝态氮肥
有机态氮肥
NH4HCO3 (NH4)2SO4 NH4Cl NH4NO3
17.7% 21.2% 26.2% 35%
KNO3 NH4NO3
CO(NH2)2
46.7%
过磷酸钙(混合物)
KCl KNO3 K2CO3 ( 草木灰的主要成份 )
KNO3 KH2PO4
液态化肥:氨水(氨气的水溶液)化学式:NH3·H2O
气态肥料:CO2
化学肥料
农家肥料
所含营养元素种类少,但营养元素的含量大
常含多种营养元素,营养元素含量较少
一般易溶于水,易于被作物吸收,肥效较快
一般较难溶于水,经腐熟后逐步转化为可溶于水、能被作物吸收的物质,肥效较慢但较长
便于工业生产,成本较高
便于就地取材,成本低廉
有些品种化肥如长期大量施用能使土壤板结
能改良土壤结构
对比化学肥料和农家肥料的一些特点
磷肥促进作物提早成熟,穗粒增多,子粒饱满。
磷肥
缺钾的大豆
缺钾的甘蓝
钾肥能促使作物生长健壮,茎杆粗硬,增强对虫害和倒伏的抵抗能力。
钾肥
复合肥料是含有两种或两种以上营养元素的化肥,如磷酸二氢铵、硝酸钾等。
复合肥料
微量元素肥料主要有硼肥、锰肥、铜肥、锌肥、钼肥等,施用的量很少。植物缺乏这些微量元素,就会影响生长发育,减弱抗病能力。
微量元素
1、能够促使作物的茎、叶生长茂盛的是( )
A、 氮肥 B、 磷肥 C、 钾肥 D、微量元素肥料
2、下列肥料不能跟草木灰混合使用的是( )
A、尿素 B、硫酸铵 C、硝酸钾 D、磷酸钙
3、下列肥料属于复合肥料的是( )
A、碳酸氢铵 B、磷酸二氢钙 C、硝酸钾 D、磷酸氢二铵
练习
A
B
D
练习
4、 下列化肥属于复合肥料的是:
A、NH4Cl B、NH4NO3
C、KH2PO4 D、KNO3
5、下列化肥与熟石灰混合研磨,能闻到氨气的是
A、氯化钾 B、硫酸钾
C、过磷酸钙 D、硫酸铵
6、某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,严重时叶脉呈淡棕色,你认为应该施加下列哪一种化肥:
A、氯化钾 B、硫酸钾 C、过磷酸钙 D、尿素
C
D
D
7. 国外施行用汽水(碳酸饮料)浇灌农田,它的动机是( )
①对植物呼吸作用有利;②改良碱性土壤,调节PH值;③有利于土壤的Ca2+、Mg2+被植物吸收;④加速光合作用进行
A、只有②正确 B、只有③正确
C、②④正确 D、全部正确
8、人尿中含尿素为2%,则折合成氮元素为( )
A、0.66% B、0.93% C、0.88% D、1.00%
C
B
9、为鉴别NH4HCO3、(NH4)2SO4、KCl、K2SO4四种化肥,某同学设计了如下所示的实验方案,请你根据每步实验现象将有关化肥的化学式填写在下图相应的空格中。
NH4HCO3、KCl、 (NH4)2SO4 、 K2SO4
①
②
③
⑥
⑤
④
加氢氧化钙
有氨味
无氨味
加盐酸
溶于水后再加氯化钡溶液
有气体产生
无气体产生
有白色沉淀
无白色沉淀
为鉴别NH4HCO3、(NH4)2SO4、KCl、K2SO4四种化肥,某同学设计了如下所示的实验方案,请你根据每步实验现象将有关化肥的化学式填写在下图相应的空格中。
NH4HCO3、KCl、 (NH4)2SO4 、 K2SO4
① NH4HCO3 、 (NH4)2SO4
② KCl、K2SO4
③ NH4HCO3
⑥ KCl
⑤K2SO4
④ (NH4)2SO4
加氢氧化钙
有氨味
无氨味
加盐酸
溶于水后再加氯化钡溶液
有气体产生
无气体产生
有白色沉淀
无白色沉淀
谢 谢
知识网络
物质的转化和元素的循环
物质的转化
金属氧化和金属氧化物的还原
单质、氧化物、酸(碱)之间转化
自然界中的氮循环
化学肥料
氮循环
自然界中的碳循环和氧循环
第1节
物质的转化
寒来暑往
大陆漂移
食物腐败
火山喷发
水滴石穿
元素衰变
滴水成冰
花香四溢
蜡炬成灰
野火烧不尽,春风吹又生
千锤万凿出深山,烈火焚烧若等闲
水滴石穿
食物腐败
蜡炬成灰
野火烧不尽,春风吹又生。
烈火焚烧若等闲。
元素衰变
变化的世界
1、手持铜丝在酒精灯外焰加热。
2、把变了黑的热铜丝迅速插入酒精。
活动:
1、铜的和氧化铜的相互转换
问1:用酒精灯火焰在空气中加热铜丝,能观察到什么现象?
紫红色的铜加热后变黑色。
化学方程式:
2Cu + O2 == 2CuO
问2:把变了黑的热铜丝迅速插入酒精,能观察到什么现象?
黑色的固体变紫红色。
化学方程式:
CuO + C2H5OH == Cu + C2H4O + H2O
乙醇
乙醛
以上实验说明
一、金属的氧化和氧化物的还原
金属的和它的氧化物可以相互转换
2Cu+O2 2CuO
铜得氧
铜被氧化
氧化铜失氧
氧化铜被还原
CuO+C2H5O
Cu+C2H4O+H2O
总结1:
得氧,被氧化;失氧,被还原。
考考你:谁氧化,谁还原
Fe2O3+CO
2Fe+CO2
高 温
Mg+CuO
Cu+MgO
总结2 :
氧化和还原同时发生。
2Cu+O2 2CuO
CuO + C2H5OH == Cu + C2H4O + H2O
物质得到氧跟氧结合,物质被氧化;
物质失去了氧跟氧,物质被还原;
得氧物质—被氧化—发生的是氧化反应—是还原剂。
失氧物质—被还原—发生的是还原反应—是氧化剂。
1、氧化与还原
可见:
判断方法:
3CO + Fe2O3 == 3CO2 ↑ + 2Fe
高温
C + 2CuO == 2 Cu + CO2 ↑
高温
判断下列反应的氧化剂和还原剂,被氧化和被还原。
CO + CuO == Cu + CO2
H2 + CuO == Cu + H2O
Mg + CuO == Cu + MgO
练习:
1、氢气跟氧化铜(CuO)反应
2、碳与氧化铜反应
1、加热一段时间后,发现试管
壁出现:________
2、澄清石灰水变:________,
说明_____________________。
3、木炭跟氧化铜反应,生成
了_____和_________。
4、化学方程式:
________________________。
红色物质
变浑浊
产生的气体是二氧化碳
铜
二氧化碳
C+ 2CuO == 2Cu + CO2↑
思考题:
木炭也能使氧化铜还原,此反应能用H2跟氧化铜反应的装置吗?
3、CO与氧化铜反应
注意:CO有毒要除尾气。用点燃的方法除尾气
现象:试管中黑色的粉末变成红色物质,
澄清的石灰水变浑浊,
尾气燃烧,发出淡蓝色的火焰。
根据前面所学:用CO跟氧化铜加热反应,实验要如何操作?
CO + CuO ==Cu + CO2
化学方程式:
1、定义:
把金属______变成________叫金属的冶炼。
2、常用方法:
____________与___________在__________下反应,夺取金属氧化物的______,得到金属单质。或者用________________置换活动性弱的金属的化合物。
化合物
金属单质
用H2、碳和CO
金属氧化物
加热或高温
氧
冶炼金属的方法
活动性强的金属
3CO + Fe2O3 == 3CO2 ↑ + 2Fe
高温
C + 2CuO == 2 Cu + CO2 ↑
高温
1、用H2、碳或CO
2、活动性强的金属置换活动性弱的金属
Fe + CuSO4 == Cu + FeSO4
CO + CuO == Cu + CO2
H2 + CuO == Cu + H2O
Mg + CuO == Cu + MgO
用稀硫酸和锌反应,生成氢气。再与氧化铜反应。
复习:
用稀硫酸和氧化铜反应,生成硫酸铜,再用Zn置换。
1、由氧化铜制取铜,可用哪些方法?写出化学方程式。
H2 + CuO == Cu + H2O
Zn+H2SO4 == CuSO4 + H2↑
CuO+H2SO4 == CuSO4 + H2O
Zn + CuSO4 == ZnSO4 + Cu
5、绝大部分金属+氧气→金属氧化物
2Mg + O2 == 2 MgO
点燃
3Fe + 2O2 == Fe3O4
点燃
4Al + 3O2 == 2Al2O3
点燃
Pt、Au跟氧气不反应。“真金不怕火炼”
6、金属的保护
致密的氧化物保护膜阻止了金属进一步氧化!
铁制容器为什么不能盛波尔多液?但它为什么能盛放浓硫酸?
铁表面锈铁为什么不能保护铁呢?
铁(Fe)生锈变成氧化铁(Fe2O3)
因为铁和浓硫酸反应会生成致密的氧化物保护膜。
因为铁和硫酸铜反应会生成硫酸亚铁。
金属
氧化物
金属
氧化(得氧)
还原(失氧)
氢气还原氧化铜的设计
一、
二、
小结:
第2节
自然界中的氧循环和碳循环
一、自然界中的氧循环
消耗氧气的途径
产生氧气的途径
物质的燃烧
生物呼吸
植物
光合作用
微生物的
氧化分解
氧气不断的被消耗,又不断的产生,实现物质之间转化和循环、平衡,使氧气在大气中的含量基本保持不变。这也是生命赖以生存的基础。
自然界氧循环对生存有什么意义呢?
1、大自然中氧气的消耗有多种途径,下列不是氧气在大自然中消耗的途径是( )
A、植物的光合作用 B、物质的燃烧
C、合成臭氧 D、生物的呼吸作用
A
2、养有金鱼的缸内,常养些水草,它对金鱼的作用是( )
A、光合作用释放出氧气,有利于金鱼的呼吸
B、使金鱼有较好的活动场所
C、增加美观
D、使金鱼获得光合作用的产物—有机物
A
练一练
二、自然界中的碳循环
碳在自然界中的循环是通过二氧化碳来完成的。
大气中的二氧化碳是通过什么被消耗的?
产生二氧化碳的途径又有哪些?
植物
光合作用
动植物的呼吸作用、有机物的燃烧以及微生物的分解。
自然界中的碳循环
CO2
作用
物
植物 作用
动物吸收 体内
动植物残体
微生物的分解
煤、石油、
天然气
光合
有机
呼吸
氧化
燃烧
三、碳循环的破坏 温室效应
二氧化碳气体为什么会产生温室效应?
感受什么是温室效应
实验
实验现象:__________
解释原因:
温度左低右高
右边杯子热量不易散失。
想想
透明玻璃
温室的保温原理
太阳光透过温室的玻璃后,会使室内的地面温度升高,而地面的辐射却很少能穿透玻璃,因此温室具有保温作用。
假如把这个温室看作是一个巨大的地球,那么玻璃是什么?
二氧化碳
大气中的二氧化碳具有与温室玻璃相似的作用,对地球起着保温的作用,从而产生“温室效应”。
1、CO2占空气总体积的0.03%;自然界中CO2的循环如下图所示,在A处不参与该循环的是( )
A、生物的呼吸作用 B、含碳燃料的燃烧
C、发展利用氢燃料 D、人和动物的呼吸
C
练一练
2、下列情况会使大气中的二氧化碳浓度增多( )
A、利用石灰水吸收空气中的二氧化碳 B、汽车数量增加
C、发展太阳能、水能以代替煤、石油等燃料
D、植树造林
3、碳在自然界中的循环是通过二氧化碳来完成的,自然界中主要吸收二氧化碳的途径是( )
A、呼吸作用 B、蒸腾作用
C、光合作用 D、分解作用
B
C
练一练
4、关于温室效应,有下列说法:①温室效应有利也有弊;②温室效应的加剧是大气层中臭氧层受到破坏引起的;③温室效应的加剧主要是由于大气中的二氧化碳含量升高引起的;④发展太阳能、水能以代替煤、石油等燃料,可以防止温室效应的加剧;⑤适度的温室效应能保证地球上的气温衡定,适于动植物生存;⑥森林被称为地球之肺,所以大力提倡植树造林,可以消除温室效应。其中正确的是( )
A、①②③④⑤⑥ B、①③④⑤
C、①③④⑤⑥ D、①②③④⑤
B
练一练
[深化提高]
1、小朱同学很喜欢养花,并且在每天睡觉前在床前放几瓶花,认为这样房间里的环境优雅且可以在睡觉时呼吸更多的氧气。请你分析小朱同学的做法对不对?
答:不对,因为植物只有在有光的条件下才能进行光合作用,放出氧气。在晚上黑暗的条件下,植物只进行呼吸作用,消耗氧气,放出二氧化碳,会使房间空气中二氧化碳含量升高,氧气含量减小,这样做反而对人的健康不利。
2、近些年,广州等地家里流行一种生态球,其结构是外部用透明玻璃制成的密封球,球内有水,水中有几尾小鱼,还有一些水草等。请你分析这种球放在家里的什么位置较为合适,为什么?并说明球内水草和小鱼能共同长期生存的原因。
答:这种球放在窗户边阳光照到的位置较为合适,因为只有在阳光照到的位置,球内的水草才能进行光合作用。球内的小鱼和水草能长期共同生存的原因是水草靠光合作用制造有机物,并释放出氧气,这些刚好能为小鱼提供食物和氧气,而小鱼产生的二氧化碳恰好是水草光合作用的原料,小鱼消化的排泄物又能为水草提供肥料,所以它们能长期共同生存。
3、如下图所示的密闭装置,一株植物和一支蜡烛放在透明钟罩的底部,假如减少钟罩中的二氧化碳量,同时增加氧气的量,点燃蜡烛,蜡烛燃烧1分钟后自行熄灭。三天后,蜡烛被一个电装置重新点燃,并在熄灭前燃烧了1分钟,请根据图回答问题:
这个实验回答了下列哪个问题: A、是否植物所有的部分都吸收二氧化碳,释放出氧气。 B、植物是否需要阳光才吸收二氧化碳和放出氧气。 C、植物与燃烧的蜡烛对空气是否具有同样的效果。 D、植物吸收的氧气的数量是否大于释放的氧气的数量。
D
你得出这个结论的理由:
第一次蜡烛熄灭,说明钟罩内的氧气已消耗完,过三天后重新点燃蜡烛又能燃烧1分钟,说明植物在这三天中光合作用吸收的二氧化碳的数量大于植物在这三天中进行呼吸作用所消耗的氧气的数量,所以得出了:D
第3节 自然界中的氮循环
思考:为什么施过动物或人的稀尿液的农作物长势特别旺?
一、自然界氮的循环
因为动物和人的尿液里含尿素,尿素为植物生长提供必需氮元素(N)。
1、氮的固定
大气中氮单质(N2)转化为氮的化合物的过程称为氮的固定。
2、固氮的途径
生物固氮
N2+O2放电2NO
N2+3H2高温、高压、催化剂2NH3
工业固氮
大气固氮
3、自然界中氮的循环
细菌分解
硝酸盐
氨或铵盐
大气中的氮
NOX
棉花你的叶子为什么变黄了?
氮肥能促使作物的茎、叶生长茂盛,叶色浓绿。
因为我缺氮!
二、化学肥料
肥料
化学肥料
农家肥料:如厩肥、人粪尿、绿肥等。
氮肥
磷肥
钾肥
复合肥料
微量元素肥料
思考:植物生长需要哪些营养元素?其中土壤中较少,而植物摄取量又较多的是哪些元素?
C、H、O、N、P、K
N、P、K
种类
物质
在植物生长中的作用
缺乏时的表现
氮肥
尿素、氨水、铵盐、硝酸盐
能促进作物的茎叶生长茂盛,叶色浓绿
植株矮小瘦弱,叶片发黄,严重时叶脉呈淡棕色
磷肥
磷矿粉、钙镁磷肥、过磷酸钙
能促进作物根系发达,增强抗寒抗旱能力,能促进作物提早成熟,子粒饱满
植株特别矮小,叶片呈暗绿色,并出现紫色
钾肥
硫酸钾、氯化钾
能保证各种代谢过程的顺利进行
茎干软弱,容易倒伏,叶片的边缘和尖端呈褐色,并焦枯。
复合肥
磷酸二氢铵、磷酸氢二铵、硝酸钾
同时含有两种或两种以上的营养元素,能同时均匀地供给多种养分,有效成分高。
常见化肥的种类与作用
氮肥
磷肥
钾肥
复合肥
铵态氮肥
硝态氮肥
有机态氮肥
NH4HCO3 (NH4)2SO4 NH4Cl NH4NO3
17.7% 21.2% 26.2% 35%
KNO3 NH4NO3
CO(NH2)2
46.7%
过磷酸钙(混合物)
KCl KNO3 K2CO3 ( 草木灰的主要成份 )
KNO3 KH2PO4
液态化肥:氨水(氨气的水溶液)化学式:NH3·H2O
气态肥料:CO2
化学肥料
农家肥料
所含营养元素种类少,但营养元素的含量大
常含多种营养元素,营养元素含量较少
一般易溶于水,易于被作物吸收,肥效较快
一般较难溶于水,经腐熟后逐步转化为可溶于水、能被作物吸收的物质,肥效较慢但较长
便于工业生产,成本较高
便于就地取材,成本低廉
有些品种化肥如长期大量施用能使土壤板结
能改良土壤结构
对比化学肥料和农家肥料的一些特点
磷肥促进作物提早成熟,穗粒增多,子粒饱满。
磷肥
缺钾的大豆
缺钾的甘蓝
钾肥能促使作物生长健壮,茎杆粗硬,增强对虫害和倒伏的抵抗能力。
钾肥
复合肥料是含有两种或两种以上营养元素的化肥,如磷酸二氢铵、硝酸钾等。
复合肥料
微量元素肥料主要有硼肥、锰肥、铜肥、锌肥、钼肥等,施用的量很少。植物缺乏这些微量元素,就会影响生长发育,减弱抗病能力。
微量元素
1、能够促使作物的茎、叶生长茂盛的是( )
A、 氮肥 B、 磷肥 C、 钾肥 D、微量元素肥料
2、下列肥料不能跟草木灰混合使用的是( )
A、尿素 B、硫酸铵 C、硝酸钾 D、磷酸钙
3、下列肥料属于复合肥料的是( )
A、碳酸氢铵 B、磷酸二氢钙 C、硝酸钾 D、磷酸氢二铵
练习
A
B
D
练习
4、 下列化肥属于复合肥料的是:
A、NH4Cl B、NH4NO3
C、KH2PO4 D、KNO3
5、下列化肥与熟石灰混合研磨,能闻到氨气的是
A、氯化钾 B、硫酸钾
C、过磷酸钙 D、硫酸铵
6、某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,严重时叶脉呈淡棕色,你认为应该施加下列哪一种化肥:
A、氯化钾 B、硫酸钾 C、过磷酸钙 D、尿素
C
D
D
7. 国外施行用汽水(碳酸饮料)浇灌农田,它的动机是( )
①对植物呼吸作用有利;②改良碱性土壤,调节PH值;③有利于土壤的Ca2+、Mg2+被植物吸收;④加速光合作用进行
A、只有②正确 B、只有③正确
C、②④正确 D、全部正确
8、人尿中含尿素为2%,则折合成氮元素为( )
A、0.66% B、0.93% C、0.88% D、1.00%
C
B
9、为鉴别NH4HCO3、(NH4)2SO4、KCl、K2SO4四种化肥,某同学设计了如下所示的实验方案,请你根据每步实验现象将有关化肥的化学式填写在下图相应的空格中。
NH4HCO3、KCl、 (NH4)2SO4 、 K2SO4
①
②
③
⑥
⑤
④
加氢氧化钙
有氨味
无氨味
加盐酸
溶于水后再加氯化钡溶液
有气体产生
无气体产生
有白色沉淀
无白色沉淀
为鉴别NH4HCO3、(NH4)2SO4、KCl、K2SO4四种化肥,某同学设计了如下所示的实验方案,请你根据每步实验现象将有关化肥的化学式填写在下图相应的空格中。
NH4HCO3、KCl、 (NH4)2SO4 、 K2SO4
① NH4HCO3 、 (NH4)2SO4
② KCl、K2SO4
③ NH4HCO3
⑥ KCl
⑤K2SO4
④ (NH4)2SO4
加氢氧化钙
有氨味
无氨味
加盐酸
溶于水后再加氯化钡溶液
有气体产生
无气体产生
有白色沉淀
无白色沉淀
谢 谢
同课章节目录
- 第一章 宇宙的起源与演化
- 1 我们的宇宙
- 2 热大爆炸宇宙模型
- 3 恒星的一生
- 4 星际航行和空间技术
- 第二章 地球的演化和生物圈的形成
- 1 地球的演化
- 2 生命起源
- 3 生物进化
- 4 生态平衡
- 第三章 物质的转化和元素的循环
- 1 物质的转化
- 2 自然界中的碳循环和氧循环
- 3 自然界中的氮循环
- 第四章 健康与保健
- 1 健康、亚健康和疾病
- 2 运动与健康
- 3 免疫与健康
- 4 营养与健康
- 5 卫生与健康
- 6 环境与健康
- 第五章 生物的遗传和变异
- 1 生物的遗传
- 2 生物的变异
- 第六章 能源与社会
- 1 能源和能源的分类
- 2 太阳能的利用
- 3 核能的开发与放射性防护
- 4 新能源与可持续发展
- 第七章 科学与社会发展
- 1 科学就是力量
- 2 科学推动技术发展
- 3 科学技术推动经济增长
- 4 科学技术与可持续发展
