第二节金属的化学性质课件(37张PPT)
文档属性
| 名称 | 第二节金属的化学性质课件(37张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-08 18:05:14 | ||
图片预览











文档简介
(共36张PPT)
金属的化学性质
古
代
文
明
你知道哪些金属?见过哪些金属?说出它们的名称和元素符号,完成课本P.114的表5-1 。看看谁知道的最多!
金属元素的名称和符号
我知道的
金属名称
元素符号
我见过的 金属名称
元素符号
钠
镁
钾
锌
钙
Na
Mg
K
Zn
Ca
铁
铝
铜
银
金
Fe
Al
Cu
Ag
Au
……
……
……
……
想一想:我们日常生活中金属有哪些用途及运用了那些物理性质吗?
思考1:铁、铝常用于制作锅、铲等炊具,表现出金属哪
种物理性质?
铁锅
铝锅
导热性
金属的物理性质
铜线
思考2:铁、铝、铜能加工成导线、能压成薄片,表现出金属 哪些物理性质?
导电性、
铝锭可压成很薄的铝箔用来包装糖果等
延展性
金属的物理性质
思考3:金、银、铂做成各种首饰等,表现出金属哪种
物理性质?
有金属光泽
金属的物理性质
交流与讨论并将结果填入P114表5-2中。总结出金属的主要物理性质。
一 金属的性质
(一).物理性质:
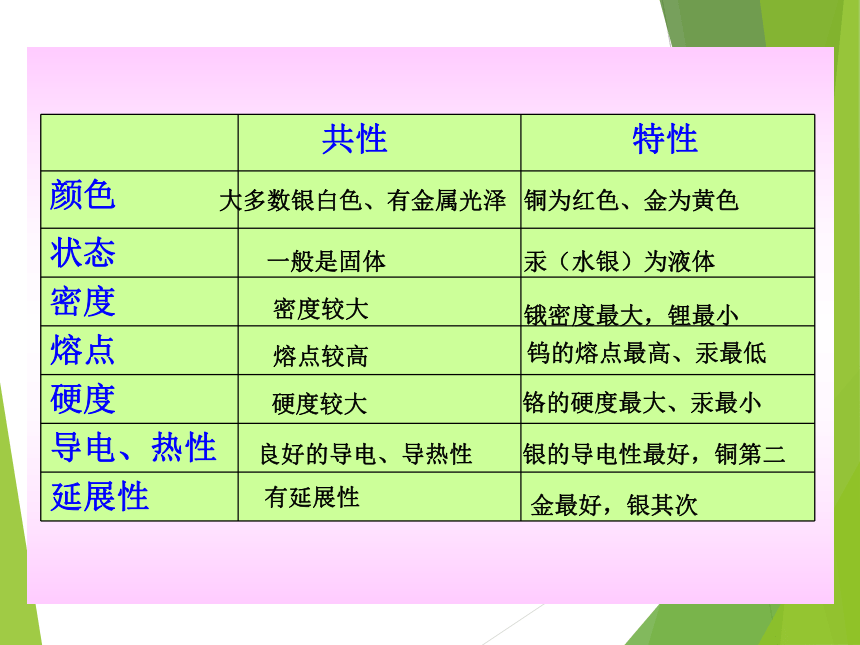
相似性:大多数金属都有金属光泽,密度、硬度较大,熔、沸点较高,具有良好的导电、导热性、延展性。
差异性:汞常温下呈液态,铜为紫红色,银的导电能力最强,熔点最高的金属是钨等。
共性 特性
颜色
状态
密度
熔点
硬度
导电、热性
延展性
大多数银白色、有金属光泽
一般是固体
密度较大
熔点较高
硬度较大
良好的导电、导热性
有延展性
铜为红色、金为黄色
汞(水银)为液体
锇密度最大,锂最小
钨的熔点最高、汞最低
铬的硬度最大、汞最小
银的导电性最好,铜第二
金最好,银其次
金属光泽
Fe
Cu
有些金属粉末细小到一定程度时,吸收可
见光后辐射不出去,
所以金属粉末一般
呈暗灰色或黑色。
金属的物理性质
1、为何铁制锅铲需要加上木柄或塑料柄?
2、银的导电性比铜好,为什么不用银制造电线、电缆?
3、联合国卫生组织为什么推荐使用中国的铁锅炊具?
防止烫手。因为铁具有良好的导热性,而木柄或塑料的导热性较差,这样就可以防止手拿锅铲时被烫伤。
因为银较稀少,价格昂贵,而铜相对较多,价格便宜。
铁锅做炊具,可以补充人体所需的铁元素,防止缺铁性贫血。
4、选择铸造硬币的金属材料需要考虑哪些因素?
需要考虑价格、硬度、无毒、耐磨、耐腐蚀、色泽美观、质轻、易加工、性质稳定、价廉、资源丰富等因素。
5、为何菜刀、镰刀、锤子等用铁制而不用铝制?
6、为什么灯泡里的灯丝用钨丝?
铁的硬度大,铝的硬度小,且有毒。
钨熔点高,不易熔断。
根据你以前所学的知识(如:镁在空气中燃烧、铁丝在氧气中燃烧的实验)及你的生活经验,请大胆猜测金属可能有哪些化学性质?
探究金属的化学性质
1.镁条在空气中燃烧;
2.铁丝在氧气中点燃;
3.铝片在空气中加热;
4.铜片在空气中加热。
观察完后,请将观察到的现象填入P115《观察与思考》的表格中。
金属与氧气的反应
实验现象
1、金属与氧气反应(化合反应)
常见金属的化学性质
镁在空气中点燃 铁在氧气中点燃 铝在空气中加热 铜在空气中加热
实验
现象
化学方程式
结论
剧烈燃烧,火星四射,放热,生成黑色固体
表面变暗,失去金属光泽
表面由红色变成黑色
剧烈燃烧,发出耀眼的白光,放热,生成白色固体
3Fe+2O2 == Fe3O4
2Mg+O2==2MgO
4Al+3O2==2Al2O3
2Cu+O2 2CuO
Mg 、 Fe 、 Al、Cu能与氧气反应
点燃
点燃
铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗?
原因:常温下,铝就能和氧气发生反应,在其表面生成一层 的氧化铝保护膜(Al2O3)。
4Al + 3O2 = 2Al2O3
致密
思考一下
再思考:
“真金不怕火炼”道出了金的什么性质?金易被腐蚀吗?
“真金不怕火炼”,说明既使是在较高的温度下,“金”的化学性质也不活泼
1、自由女神化妆:美国的自由女神像,因内部的金属被酸雨腐蚀,而变得“伤痕累累”,不得不进行大修。
2、波兰的铁轨因酸雨腐蚀,火车每小时开不到40 km,而且还易引发事故,相当危险。
根据以上新闻报道,你能猜想到金属有什么样的化学性质吗?
金属能酸发生反应
试管中分别有镁、锌、铁、铜四种金属,将稀盐酸或稀硫酸分别倒入试管中,观察实验现象?
(1)试管中的镁片、锌片、铁片、铜片已经预先
打磨,以除去金属表面的氧化物;
(2)实验时要向4支试管内倒入大约四分之一试
管的稀盐酸(或稀硫酸);
金属 是否有
气泡 反应
速率 溶液的颜色变化
Mg
Zn
Fe
Cu
有气泡
有气泡
适中
很快
有气泡
较慢
无气泡
无
无
溶液都由无色变为浅绿色
铁与稀盐酸或稀硫酸反应后的溶液都呈浅绿色
说明金属的化学性质越活泼。
金属与酸反应越剧烈,
活动性:Mg>Zn>Fe>Cu
Mg + 2HCl = MgCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
从反应物和生成物的类别(如单质、化合物)的角度来分析,你能找出这些反应特点吗?
单质
单质
化合物
化合物
我来观察这些方程式
置换反应定义:由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应。
是第3种化学基本反应类型
单质+化合物=另一种化合物+另一种单质
A + BC → AC + B
化合反应(多变一)
分解反应(一变多)
(一换一)
金属与稀盐酸或稀硫酸的反应都属于置换反应,其实质是金属从稀盐酸或稀硫酸中置换出氢元素。
金属铝也能与稀盐酸或稀硫酸反应,你能写出反应方程式吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2 ↑
小结:
1。根据金属能否与酸反应或反应的剧烈程度也可以来比较金属的活动性较强弱。
2.金属活动性顺序:
人们经过长期的实践,总结出常见金属在溶液中的活动性顺序如下:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中,金属的位置越靠前,它的活动性就越强;
排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
随堂练习
1.下列关于锌、铁、铜的说法,错误的是( )
A.均可以导电
B.均可以和氧气反应
C.均可以和稀盐酸反应
D.都是金属
C
2.铜能够制成铜片或拉成铜丝,是因为铜具有良好的 ( )
A.导热性 B.导电性
C.延展性 D.金属活动性
C
3、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl====2AlCl3+3H2↑( )
(2)H2CO3====CO2↑+H2O ( )
(3)Fe+CuSO4====FeSO4+Cu ( )
(4)CaO+H2O====Ca(OH)2 ( )
C
B
C
A
一、金属的物理性质
1、大多数金属是银白色,具有一定的光泽。
二、金属的化学性质
1、大多数金属能与氧气反应。
2、大多数金属能与稀盐酸或稀硫酸反应,从稀盐酸 或稀硫酸中置换出氢元素。
三、置换反应
3、金属通常有一定的硬度、密度、熔点。
2、金属有良好的导电性、导热性、延展性。
作业:课本121页——122页
金属的化学性质
古
代
文
明
你知道哪些金属?见过哪些金属?说出它们的名称和元素符号,完成课本P.114的表5-1 。看看谁知道的最多!
金属元素的名称和符号
我知道的
金属名称
元素符号
我见过的 金属名称
元素符号
钠
镁
钾
锌
钙
Na
Mg
K
Zn
Ca
铁
铝
铜
银
金
Fe
Al
Cu
Ag
Au
……
……
……
……
想一想:我们日常生活中金属有哪些用途及运用了那些物理性质吗?
思考1:铁、铝常用于制作锅、铲等炊具,表现出金属哪
种物理性质?
铁锅
铝锅
导热性
金属的物理性质
铜线
思考2:铁、铝、铜能加工成导线、能压成薄片,表现出金属 哪些物理性质?
导电性、
铝锭可压成很薄的铝箔用来包装糖果等
延展性
金属的物理性质
思考3:金、银、铂做成各种首饰等,表现出金属哪种
物理性质?
有金属光泽
金属的物理性质
交流与讨论并将结果填入P114表5-2中。总结出金属的主要物理性质。
一 金属的性质
(一).物理性质:
相似性:大多数金属都有金属光泽,密度、硬度较大,熔、沸点较高,具有良好的导电、导热性、延展性。
差异性:汞常温下呈液态,铜为紫红色,银的导电能力最强,熔点最高的金属是钨等。
共性 特性
颜色
状态
密度
熔点
硬度
导电、热性
延展性
大多数银白色、有金属光泽
一般是固体
密度较大
熔点较高
硬度较大
良好的导电、导热性
有延展性
铜为红色、金为黄色
汞(水银)为液体
锇密度最大,锂最小
钨的熔点最高、汞最低
铬的硬度最大、汞最小
银的导电性最好,铜第二
金最好,银其次
金属光泽
Fe
Cu
有些金属粉末细小到一定程度时,吸收可
见光后辐射不出去,
所以金属粉末一般
呈暗灰色或黑色。
金属的物理性质
1、为何铁制锅铲需要加上木柄或塑料柄?
2、银的导电性比铜好,为什么不用银制造电线、电缆?
3、联合国卫生组织为什么推荐使用中国的铁锅炊具?
防止烫手。因为铁具有良好的导热性,而木柄或塑料的导热性较差,这样就可以防止手拿锅铲时被烫伤。
因为银较稀少,价格昂贵,而铜相对较多,价格便宜。
铁锅做炊具,可以补充人体所需的铁元素,防止缺铁性贫血。
4、选择铸造硬币的金属材料需要考虑哪些因素?
需要考虑价格、硬度、无毒、耐磨、耐腐蚀、色泽美观、质轻、易加工、性质稳定、价廉、资源丰富等因素。
5、为何菜刀、镰刀、锤子等用铁制而不用铝制?
6、为什么灯泡里的灯丝用钨丝?
铁的硬度大,铝的硬度小,且有毒。
钨熔点高,不易熔断。
根据你以前所学的知识(如:镁在空气中燃烧、铁丝在氧气中燃烧的实验)及你的生活经验,请大胆猜测金属可能有哪些化学性质?
探究金属的化学性质
1.镁条在空气中燃烧;
2.铁丝在氧气中点燃;
3.铝片在空气中加热;
4.铜片在空气中加热。
观察完后,请将观察到的现象填入P115《观察与思考》的表格中。
金属与氧气的反应
实验现象
1、金属与氧气反应(化合反应)
常见金属的化学性质
镁在空气中点燃 铁在氧气中点燃 铝在空气中加热 铜在空气中加热
实验
现象
化学方程式
结论
剧烈燃烧,火星四射,放热,生成黑色固体
表面变暗,失去金属光泽
表面由红色变成黑色
剧烈燃烧,发出耀眼的白光,放热,生成白色固体
3Fe+2O2 == Fe3O4
2Mg+O2==2MgO
4Al+3O2==2Al2O3
2Cu+O2 2CuO
Mg 、 Fe 、 Al、Cu能与氧气反应
点燃
点燃
铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗?
原因:常温下,铝就能和氧气发生反应,在其表面生成一层 的氧化铝保护膜(Al2O3)。
4Al + 3O2 = 2Al2O3
致密
思考一下
再思考:
“真金不怕火炼”道出了金的什么性质?金易被腐蚀吗?
“真金不怕火炼”,说明既使是在较高的温度下,“金”的化学性质也不活泼
1、自由女神化妆:美国的自由女神像,因内部的金属被酸雨腐蚀,而变得“伤痕累累”,不得不进行大修。
2、波兰的铁轨因酸雨腐蚀,火车每小时开不到40 km,而且还易引发事故,相当危险。
根据以上新闻报道,你能猜想到金属有什么样的化学性质吗?
金属能酸发生反应
试管中分别有镁、锌、铁、铜四种金属,将稀盐酸或稀硫酸分别倒入试管中,观察实验现象?
(1)试管中的镁片、锌片、铁片、铜片已经预先
打磨,以除去金属表面的氧化物;
(2)实验时要向4支试管内倒入大约四分之一试
管的稀盐酸(或稀硫酸);
金属 是否有
气泡 反应
速率 溶液的颜色变化
Mg
Zn
Fe
Cu
有气泡
有气泡
适中
很快
有气泡
较慢
无气泡
无
无
溶液都由无色变为浅绿色
铁与稀盐酸或稀硫酸反应后的溶液都呈浅绿色
说明金属的化学性质越活泼。
金属与酸反应越剧烈,
活动性:Mg>Zn>Fe>Cu
Mg + 2HCl = MgCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
从反应物和生成物的类别(如单质、化合物)的角度来分析,你能找出这些反应特点吗?
单质
单质
化合物
化合物
我来观察这些方程式
置换反应定义:由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应。
是第3种化学基本反应类型
单质+化合物=另一种化合物+另一种单质
A + BC → AC + B
化合反应(多变一)
分解反应(一变多)
(一换一)
金属与稀盐酸或稀硫酸的反应都属于置换反应,其实质是金属从稀盐酸或稀硫酸中置换出氢元素。
金属铝也能与稀盐酸或稀硫酸反应,你能写出反应方程式吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2 ↑
小结:
1。根据金属能否与酸反应或反应的剧烈程度也可以来比较金属的活动性较强弱。
2.金属活动性顺序:
人们经过长期的实践,总结出常见金属在溶液中的活动性顺序如下:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中,金属的位置越靠前,它的活动性就越强;
排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
随堂练习
1.下列关于锌、铁、铜的说法,错误的是( )
A.均可以导电
B.均可以和氧气反应
C.均可以和稀盐酸反应
D.都是金属
C
2.铜能够制成铜片或拉成铜丝,是因为铜具有良好的 ( )
A.导热性 B.导电性
C.延展性 D.金属活动性
C
3、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl====2AlCl3+3H2↑( )
(2)H2CO3====CO2↑+H2O ( )
(3)Fe+CuSO4====FeSO4+Cu ( )
(4)CaO+H2O====Ca(OH)2 ( )
C
B
C
A
一、金属的物理性质
1、大多数金属是银白色,具有一定的光泽。
二、金属的化学性质
1、大多数金属能与氧气反应。
2、大多数金属能与稀盐酸或稀硫酸反应,从稀盐酸 或稀硫酸中置换出氢元素。
三、置换反应
3、金属通常有一定的硬度、密度、熔点。
2、金属有良好的导电性、导热性、延展性。
作业:课本121页——122页
