2020年高二化学人教选修4第一章第一节1.1 第一课时《 焓变 反应热》课时检测
文档属性
| 名称 | 2020年高二化学人教选修4第一章第一节1.1 第一课时《 焓变 反应热》课时检测 |
|
|
| 格式 | zip | ||
| 文件大小 | 217.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-09 00:00:00 | ||
图片预览





文档简介
2020年高二化学人教选修4同步导学提分教程:
——《 焓变 反应热》课时检测
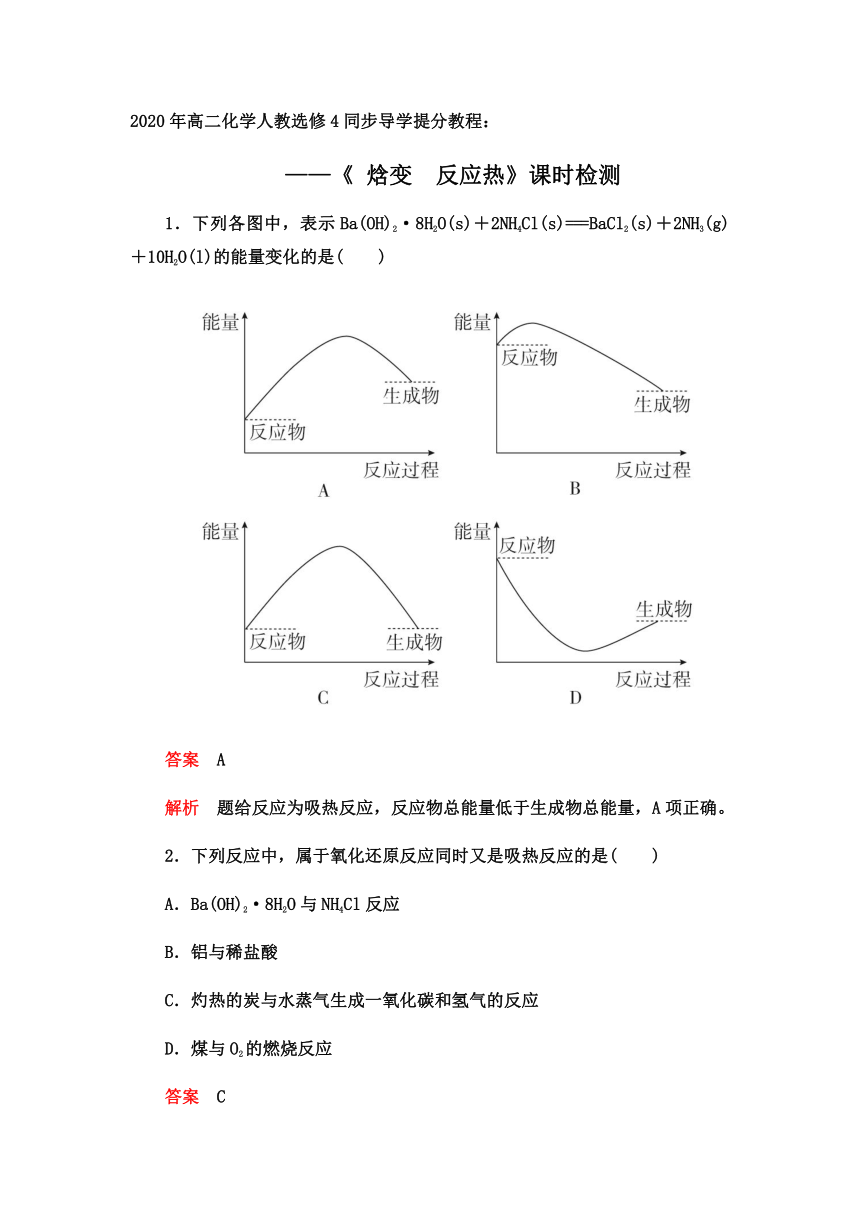
1.下列各图中,表示Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)的能量变化的是( )
答案 A
解析 题给反应为吸热反应,反应物总能量低于生成物总能量,A项正确。
2.下列反应中,属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与稀盐酸
C.灼热的炭与水蒸气生成一氧化碳和氢气的反应
D.煤与O2的燃烧反应
答案 C
解析 A为非氧化还原反应,B、C、D为氧化还原反应,其中C为吸热反应,B和D为放热反应。
3.下图表示H2和Br2反应的历程,其中虚线表示的是使用催化剂的反应历程,下列说法正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.加入催化剂,该化学反应的反应热增大
D.从图中可以看出,该反应的反应热与反应途径有关
答案 A
解析 由图像知反应物(Br2+H2)总能量低于生成物(2HBr)的总能量,所以此反应为吸热反应,A项正确,B项错误;加入催化剂时只是加快反应速率,并不影响反应热,反应热的大小与反应途径无关,C、D两项错误。
4.已知H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)===H2(g)+Cl2(g)的ΔH为( )
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.+92.3 kJ D.+92.3 kJ·mol-1
答案 D
解析 互为逆反应的两个热化学方程式,ΔH数值相等,符号相反;ΔH的大小与化学计量数成正比,故选D。
5.下列说法正确的是( )
A.焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
答案 C
解析 焓变单位中的kJ·mol-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错误;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C正确;化学反应的实质是旧化学键的断裂,新化学键的形成,断键时吸收能量,成键时放出能量,所以D错误。
6.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2
解析 氢气在氯气中燃烧时放出能量,所以形成2 mol氯化氢中的化学键释放的能量大于破坏1 mol氢气中的化学键和破坏1 mol氯气中的化学键消耗的能量之和。
7.下列关于ΔH(焓变)的说法正确的是( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时,反应吸收热量;ΔH<0时,反应放出热量
C.需要加热才能发生的反应一定是吸热反应
D.任何放热反应在常温下一定能发生反应
答案 B
解析 恒压条件下的反应热等于焓变,A项错误;ΔH>0为吸热反应,ΔH<0为放热反应,B项正确;反应开始需要加热的反应可能是吸热反应,也可能是放热反应,C项错误;有的放热反应如木炭的燃烧反应等,在常温下不能发生,D项错误。
8.下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.形成生成物全部化学键所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
答案 C
解析 任何化学反应都有反应热,即一定有能量变化,故A项错误;形成生成物全部化学键所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应放热,故B项错误;同一个化学反应的两个化学方程式化学计量数不同时,ΔH的值也不同,故D项错误。
9.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与二氧化碳的反应
C.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
D.甲烷在空气中燃烧的反应
答案 B
解析 A项属于放热反应,C项不属于氧化还原反应,D项属于放热反应。
10.下列说法正确的是( )
A.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃的条件下ΔH应该不相同
B.化学反应中的能量变化都表现为热量变化
C.任何吸热反应必须加热才能发生
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
答案 D
解析 ΔH的大小与反应条件无关,A项错误;化学反应中的能量变化有的是以光能的形式表现出来,B项错误;有的吸热反应不需要加热也能发生,如Ba(OH)2·8H2O与NH4Cl固体的反应,C项错误。
11.已知化学反应A2(g)+B2(g)===2AB(g) ΔH=Q kJ·mol-1,其能量变化如图所示,则Q的值正确的是( )
A.a-b B.a
C.-b D.b-a
答案 A
解析 ΔH=断键吸收的能量-成键放出的能量=a-b。
12.如图所示,下列说法正确的是( )
A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等
B.A―→B+C ΔH<0
C.A具有的能量高于B和C具有的能量的总和
D.A―→B+C ΔH>0,B+C―→A ΔH<0
答案 D
解析 由图可看出,B+C的总能量高于A的能量,则反应B+C―→A一定是放热反应,ΔH<0,反之A―→B+C一定是吸热反应,ΔH>0,根据能量守恒定律,两反应吸收和放出的能量一定相等。
13.参照反应Br+H2―→HBr+H的能量对反应过程的示意图,下列叙述中正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.反应物的总能量高于生成物的总能量
D.断裂反应物中化学键吸收的能量小于形成生成物中化学键放出的能量
答案 A
解析 A项,反应中,反应物的总能量低于生成物的总能量,为吸热反应,正确,B、C两项错误;D项,该反应为吸热反应,断裂化学键吸收的能量大于形成化学键放出的能量,错误。
14.化学反应A2+B2??2AB的能量变化如图所示,下列说法正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C.断裂2 mol A—B键时需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
答案 C
解析 1 mol A2和1 mol B2具有的总能量高于2 mol AB的总能量,故反应为放热反应,A错误;断键时吸收能量,故B错误;2 mol AB总能量低于1 mol A2和1 mol B2的总能量,D错误。
15.常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是( )
共价键 H—H F—F H—F H—Cl H—I
E(kJ·mol-1) 436 157 568 432 298
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g)===2HF(g) ΔH=-25 kJ·mol-1
答案 D
解析 H—Br键键能在H—Cl键和H—I键键能之间,A正确;表中H—F键的键能最大,所以H—F键最稳定,B正确;断裂1 mol H—H键吸收436 kJ能量,C正确;ΔH=反应物的键能总和-生成物的键能总和=(436+157-568×2) kJ·mol-1=-543 kJ·mol-1,D错误。
16.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ,则S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A.-1780 kJ/mol B.-1220 kJ/mol
C.-450 kJ/mol D.+430 kJ/mol
答案 B
解析 由题目的信息可知,1 mol SF6中含有6 mol S—F键,1 mol F2中含有1 mol F—F键,因此反应物中化学键断裂吸收的能量为280 kJ+3×160 kJ=760 kJ,生成物中化学键形成时放出的热量为6×330 kJ=1980 kJ,故反应放出的热量为1980 kJ-760 kJ=1220 kJ,该反应的反应热为-1220 kJ/mol。
17.已知C(s,石墨)===C(s,金刚石) ΔH>0,下列判断正确的是( )
A.此反应为放热反应
B.断裂1 mol石墨的化学键需要吸收的能量小于生成1 mol金刚石的化学键所放出的能量
C.石墨比金刚石稳定
D.此变化为物理变化
答案 C
解析 A项,ΔH>0,反应为吸热反应,错误;B项,ΔH=断裂1 mol石墨的化学键需要吸收的能量-生成1 mol金刚石的化学键所放出的能量>0,即断裂1 mol石墨中的化学键需要吸收的能量大于生成1 mol金刚石中的化学键所放出的能量,错误;C项,ΔH>0,石墨能量小于金刚石,能量越低越稳定,石墨比金刚石稳定,正确;D项,有新物质生成,此变化为化学变化,错误。
18.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)与O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )
A.1 mol N2(g)和1 mol O2(g)反应生成2 mol NO(g),吸收的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
D.数据不足,不能确定反应热的大小
答案 D
解析 反应中焓变等于反应物断裂化学键吸收的能量减去生成物形成化学键放出的能量,该反应的焓变为ΔH=946 kJ·mol-1+498 kJ·mol-1-2×632 kJ·mol-1=+180 kJ·mol-1,A正确;该反应为吸热反应,因此1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,B正确;氮气和氧气通常情况下不能直接反应,需要一定的条件,C正确;题中数据可以确定反应热的大小,D错误。
19.反应A(g)+B(g)??C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是__________反应(填“吸热”或“放热”)。
(2)E1表示______________,E2表示______________,ΔH=________。
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是
__________________________________________。
(4)在反应体系中加入催化剂,E1和E2的变化是:
E1________,E2________(填“增大”“减小”或“不变”)。
答案 (1)放热
(2)断键所吸收的能量 成键所释放的能量 E1-E2
(3)否 催化剂只能改变活化能,不会改变反应热
(4)减小 减小
解析 (1)反应物A和B总能量高于生成物C和D总能量,故反应为放热反应。
(2)E1表示正反应的活化能或者反应物A、B中化学键断裂所吸收的能量,E2表示逆反应的活化能或者形成C、D的化学键所释放的能量。ΔH=E1-E2。
(3)催化剂只会影响活化能即E1、E2的大小,不会改变焓变的大小。
20.已知氮化硅陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。
回答以下问题:
(1)上述反应中的氧化剂是________,还原产物是________。
(2)该反应是________(填“吸热反应”或“放热反应”),ΔH________(填“>”“<”或“=”)0。
(3)该反应过程中,断裂旧键吸收的热量________(填“>”“<”或“=”)形成新键释放的热量。
答案 (1)N2 Si3N4 (2)放热反应 < (3)<
解析 (1)SiO2+C+N2Si3N4+CO(未配平),反应中碳元素的化合价由0升高到+2,氮元素的化合价由0降低到-3,故反应中的氧化剂是N2,还原产物为Si3N4。
(2)该反应过程中,反应物的总能量大于生成物的总能量,则该反应为放热反应,ΔH<0。
(3)由(2)中分析可知,该反应为放热反应,故断裂旧键吸收的热量小于形成新键放出的热量。
