人教版高中化学选修4第四章第一节原电池能力提升训练
文档属性
| 名称 | 人教版高中化学选修4第四章第一节原电池能力提升训练 |  | |
| 格式 | zip | ||
| 文件大小 | 483.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-09 20:48:04 | ||
图片预览


文档简介
第四章第一节原电池能力提升训练
一、选择题(48分)
1、利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为:2NH3﹣6e﹣=N2+6H+
D.当有4.48L NO2(标准状况) 被处理时,转移电子为0.8mol
2、Mg﹣H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )
A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.该电池的总反应为:Mg+H2O2═Mg(OH)2
D.溶液中Cl﹣向正极移动
3、在图中的8个装置中,属于原电池的是( )
A.①②③⑤⑧ B.③④⑥⑦ C.④⑤⑥⑦ D.③⑤⑦
4、关于如下图所示各装置的叙述中,正确的是( )
A.装置①是原电池,总反应是:Cu+2Fe3+===Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为:Fe3++e-===Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
5、某同学设计如下原电池,其工作原理如图所示。下列说法不正确的是
A. 该装置将化学能转化为电能
B. 负极的电极反应是:Ag +I--e-=AgI
C. 电池的总反应是Ag+ +I-=AgI
D. 盐桥(含KNO3的琼脂)中NO3-从左向右移动
6、一种“海水”电池,其电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列有关说法不正确的是( )
A.负极反应式:Ag+Cl﹣﹣e﹣=AgCl
B.电子从电源的正极经外电路流向负极
C.Cl﹣不断向“海水”电池的负极移动
D.每生成1molNa2Mn5O10转移2mol电子
7、通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是( )
A.b极为正极,发生还原反应
B.一段时间后b极区电解液的pH减小
C.H+由a极穿过质子交换膜到达b极
D.a极的电极反应式为
8、工业废气H2S经资源利用后可回收能量并得到单质硫。反应原理如图所示。下列说法不正确的是( )
A.电极a为电池的负极
B.电极b上发生的电极反应为O2+4H++4e-=2H2O
C.若电路中通过2mol电子,则电池内部释放632kJ热量
D.若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
9、某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂。下列说法正确的是( )
A.b电极上发生的反应:Fe2+- e-═ Fe3+
B.a电极上发生氧化反应:MnO4- + 8H+ + 5e- ═ Mn2+ + 4H2O
C.外电路电子的流向是从a到b
D.电池工作时,盐桥中的SO42-移向甲烧杯
10、一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
A.反应CH4+H2O3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C.电池工作时,CO32﹣向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
11、被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O = ZnO+2MnO(OH)。下列说法正确的是( )
A. 该电池的正极为锌
B. 该电池反应中二氧化锰起催化剂作用
C. 当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D. 电池负极反应式为Zn - 2e-+2OH- = ZnO+H2O
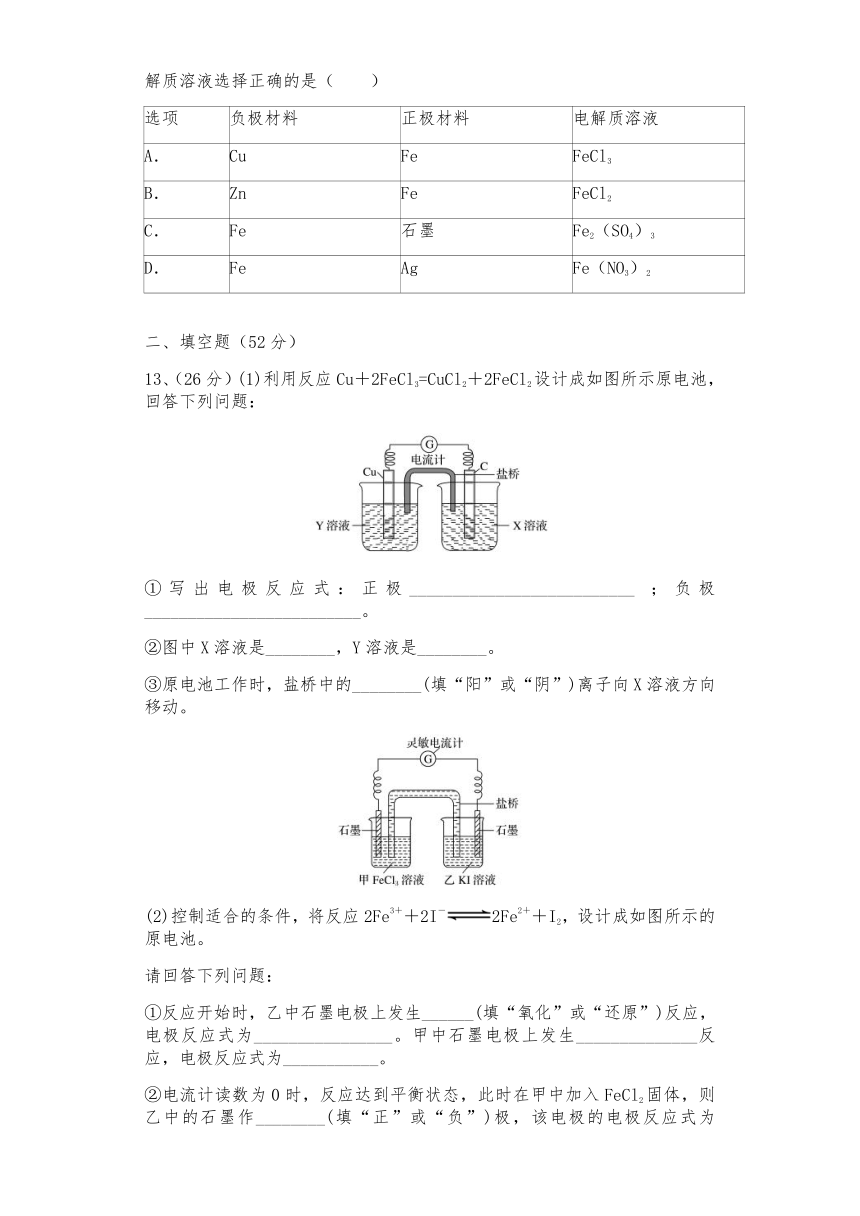
12、设计一个原电池来实现反应:2Fe3++Fe=3Fe2+,下列各选项中,电极和电解质溶液选择正确的是( )
选项 负极材料 正极材料 电解质溶液
A. Cu Fe FeCl3
B. Zn Fe FeCl2
C. Fe 石墨 Fe2(SO4)3
D. Fe Ag Fe(NO3)2
2、填空题(52分)
13、(26分)(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
①写出电极反应式:正极__________________________ ;负极_________________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
①反应开始时,乙中石墨电极上发生______(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作________(填“正”或“负”)极,该电极的电极反应式为___________________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为____________________________________。
14、(26分)( 1 )观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
① ____________________________________。
② ____________________________________。
( 2 )如右图是甲烷燃料电池原理示意图,回答下列问题:
① 电池的负极是________(填“a”或“b”)电极,该极的电极反应式为_____________________。
② 电池工作一段时间后电解质溶液的pH________。(填“增大”“减小”或“不变”)
(3)如右图甲乙所示为某实验小组设计的原电池:
① 该小组依据的氧化还原反应为(写离子方程式)________ 。
② 已知反应前电极质量相等,一段时间后,两电极质量相差12 g,则导线中通过________mol电子。
③ 用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,发生的离子反应为__________,然后滴加几滴硫氰化钾溶液,溶液变红。
参考答案
1、【答案】C
【解析】解:由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,
A.B为正极,A为负极,电流由正极经导线流向负极,故A正确;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,故B正确;
C.电解质溶液呈碱性,则负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,故C错误;
D.当有4.48L NO2(标准状况)即0.2mol 被处理时,转移电子为0.2mol×(4﹣0)=0.8mol,故D正确.
故选C.
2、【答案】C
【解析】解:本题考查原电池和电解池的工作原理.
A.组成的原电池的负极被氧化,镁为负极,而非正极,故A错误;
B.双氧水作为氧化剂,在石墨上被还原变为水和氢氧根离子,发生还原反应,故B错误;
C.镁做负极发生氧化反应,电极反应式为Mg﹣2e﹣=Mg2+,过氧化氢在正极上发生还原反应,电极反应式为H2O2+2e﹣═2OH﹣,则该电池的总反应为:Mg+H2O2═Mg(OH)2,故C正确;
D.溶液中Cl﹣移动方向同外电路电子移动方向一致,应向负极方向移动,故D错误;
故选C.
3、【答案】D
4、【答案】C
【解析】装置①中Fe比Cu活泼,Fe为负极,电极反应式为:Fe-2e-===Fe2+,总反应为:2Fe3++Fe===3Fe2+。装置②为胶体的电泳实验,Fe(OH)3胶体粒子带正电,在电场中向阴极移动,石墨Ⅱ是阴极,C项正确。装置③由电流方向可知c为阳极、d为阴极,精炼铜时阳极为粗铜、阴极为纯铜,电解质溶液含Cu2+,D项错误。
5、【答案】D
【解析】A. 经分析,该装置是原电池装置,则该装置将化学能转化为电能,A正确;
B. 根据电子的移动方向,可以推断出左侧电极为负极,该电极反应为:Ag +I--e-=AgI,B正确;
C. 该电池中,表观上看,只有Ag+和I-反应,所以总反应是Ag+ +I-=AgI,C正确;
D. 左侧电极为负极,右侧电极为正极,NO3-带负电荷,向负极移动,所以应该是从右向左移动,D错误;
故合理选项为D。
6、【答案】B
【解析】解:A、根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl﹣﹣e﹣=AgCl,故A正确;
B、电子从电源的负极经外电路流向正极,故B错误;
C、在原电池中阴离子向负极移动,阳离子向正极移动,所以Cl﹣不断向电池的负极移动,故C正确;
D、根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故D正确;
故选:B.
7、【答案】B
【解析】原电池工作时,正极上发生得电子的还原反应即:,则a为正极,b为负极,反应式为CH3COO--8e-+2H2O===2CO2↑+7H+,A、C、D错误;由电极方程式可知当转移8 mol电子时,正极消耗4 mol H+,负极生成7 mol H+,则处理后的废水pH降低,B正确。
8、【答案】C
【解析】解:本题考查原电池的工作原理.
9、【答案】A
【解析】解:A、根据原电池的工作原理:负极失电子,发生氧化反应,正极得电子发生还原反应,b极上电极反应式:Fe2+-e-=Fe3+,A正确;B、总电极反应式:2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O,a极是正极得电子,电极反应式=总电极反应式-b极反应式,得出:2MnO4-+16H++10e-=2Mn2++8H2O,化简得:MnO4-+8H++5e-=Mn2++4H2O,正极发生还原反应,B错误;B、根据以上分析可知外电路电子流向是从b流向a,C错误;C、根据原电池的工作原理:阴离子向负极移动,阳离子向正极移动,SO42-向b极移动,D错误;答案选A。
10、【答案】D
【解析】解:A.反应CH4+H2O3H2+CO,C元素化合价有﹣4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
B.电解质没有OH﹣,负极反应为H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2,故B错误;
C.电池工作时,CO32﹣向负极移动,即向电极A移动,故C错误;
D.B为正极,正极为氧气得电子生成CO32﹣,电极反应为:O2+2CO2+4e﹣=2CO32﹣,故D正确.
故选D.
11、【答案】D
【解析】
A.该装置为原电池,电池反应式中Zn元素化合价由0价变为+2价,所以Zn失电子发生氧化反应作负极,故A错误;B.该电池反应中,二氧化锰作正极,正极反应式为MnO2+H2O+e-═MnO(OH)+OH-,故B错误;C.电子不通过电解质溶液,电解质溶液产生电流是由阴阳离子定向移动形成的,故C错误;D.负极反应式为Zn+2OH--2e-═ZnO+H2O,故D正确;故选D。
12、【答案】C
【解析】 A.Cu为负极,发生2Fe3++Cu=2Fe2++Cu2+,故A错误;
B.锌的活泼性大于铁,锌作负极,铁作正极,所以不能实现该反应的原电池,故B错误;
C.铁的活泼性大于C,铁作负极,C作正极,电解质溶液为Fe2(SO4)3溶液,所以是能实现该反应的原电池,故C正确;
D.铁的活泼性大于银,铁作负极,银作正极,但电解质溶液为Fe(NO3)2溶液,所以是不能实现该反应的原电池,故D错误.
故选C.
13、【答案】(1)①2Fe3++2e-=2Fe2+ ; Cu-2e-=Cu2+ ; ②FeCl3 ; CuCl2 ; ③阳
(2)①氧化 ; 2I--2e-=I2 ; 还原 ; 2Fe3++2e-=2Fe2+
②正 ; I2+2e-=2I-
(3)O2+4e-+4H+=2H2O
【解析】解:本题考查原电池原理的应用。
(2)①碘离子失去电子,则乙中石墨是负极,所以反应开始时,乙中石墨电极上发氧化反应,电极反应式为2I--2e-=I2。甲中石墨电极上发生还原反应,电极反应式为2Fe3++2e-=2Fe2+。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,平衡向逆反应方向进行,则乙中的石墨正极,该电极的电极反应式为I2+2e-=2I-。
(3)根据方程式可知氧气得到电子,所以氧气在正极放电,溶液显酸性,则电极反应式为O2+4e-+4H+=2H2O。
14、【答案】(1) ①金属铬的活泼性比铜强且能和稀硫酸反应生成H2 ; ② 金属铬易被稀硝酸钝化
(2) ①a ; CH4+10OH--8e-= CO32-+7H2O ; ② 减小
(3) ①Fe+Cu2+=Fe2++Cu ; ② 0.2 ; ③ 2Fe2++Cl2=2Fe3++2Cl-
解析(3)由图可知该装置为原电池,Fe为负极,发生:Fe-2e-=Fe2+,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
n=0.2mol。
③滴加几滴硫氰化钾溶液,溶液变红,证明溶液中含有铁离子,而在上述原电池铁电极失电子产生亚铁离子,含有亚铁离子的溶液中滴加少量新制饱和氯水,亚铁离子被氯气氧化生成铁离子,离子反应为:2Fe2++Cl2=2Fe3++2Cl-。
