人教版九年级下册 第八单元 金属和金属材料 课题2 金属的化学性质 同步练习
文档属性
| 名称 | 人教版九年级下册 第八单元 金属和金属材料 课题2 金属的化学性质 同步练习 |  | |
| 格式 | zip | ||
| 文件大小 | 193.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-09 15:29:07 | ||
图片预览


文档简介
金属的化学性质 同步练习
一、选择题
1、化学的研究目的就是帮助人们认识、改造和应用物质,把金属矿物冶炼成金属就是人们利用化学方法实现物质改造的典型范例。下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是( )
A.地壳中金属元素的含量?????? ????B.金属的活动性
C.金属的延展性????????????? ?D.金属的导电性
2、为证明铜的金属活动性比银强,需要的一种试剂是( )
A.碳酸钠溶液 B.硝酸银溶液 C.盐酸 D.氯化钙溶液
3、下列反应中不属于置换反应的是( )
A.一氧化碳和氧化铁反应得到铁 B.铁与稀硫酸反应得到氢气?
C.氢气与氧化铜反应得到铜和水 D.镁与稀盐酸反应得到氢气?
4、镁的下列性质中,属于化学性质的是(?? )
A.导电性??? ??? B.导热性??? ?? C.可燃性??? ???? D.延展性
5、?从人类利用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,这个先后顺序跟下列因素有关的是????????????????????????????? ( ??)
①地壳中金属元素的含量;②金属活动性顺序;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性。
A.①③???? B.②⑤????? C.③⑤???? D.②④
6、现有四种银白色金属Fe、Al、Ag、Hg和稀硫酸,你首先鉴别出来的金属是(??? )
A、Hg??? B、Ag??? C、Al????? D、Fe
7、将金属Cu投入金属A的盐溶液中,观察到Cu的表面出现银白色物质;金属B投入稀硫酸中,观察到B的表面有气泡产生。下列关于金属A、B、Cu的活动性的叙述正确的是( )
A.B>Cu>A?????? ?????????????B.A>Cu>B
C.B>A>Cu??????????????????? D.A>B>Cu
8、已知X、Y、Z三种金属能发生下列反应:
X + H2SO4?== XSO4?+ H2↑ ??
Y + Z(NO3)2?== Y(NO3)2?+ Z
Z + X(NO3)2?== Z(NO3)2?+ X
则X、Y、Z三种金属与氢的活动性由强到弱的顺序为( )
A.X>H>Y>Z? ? ? ? ? ? ? ? ? B.Y>Z>X>H
C.Z>Y>X>H? ? ? ? ? ?? ? ? D.X>H>Z>Y
9、生铁与足量的稀盐酸充分反应后,剩余残渣的主要成分是( )
A.铁 ? ? ? ?B.氯化亚铁 ? ? ? ?C.氯化铁 ? ? ? D.碳
10、下列物质中,不能用金属跟稀酸反应直接制得的是( )
A.硫酸锌 ? ? ? ?B.氯化镁 ? ? ? ?? C.氯化铁 ? ? ? ?D.硫酸铝
11、有一镁和铁组成的合金,与足量稀盐酸反应生成氢气0.1g,则原合金的质量可能为( )
A.1.2g B.2.8g C.2g? ? D.3g
12、下列金属各n克,分别与是足量稀盐酸反应,生成氢气最少的是( )
A.Zn?? B.Al? ? C.Fe? ? D.Mg
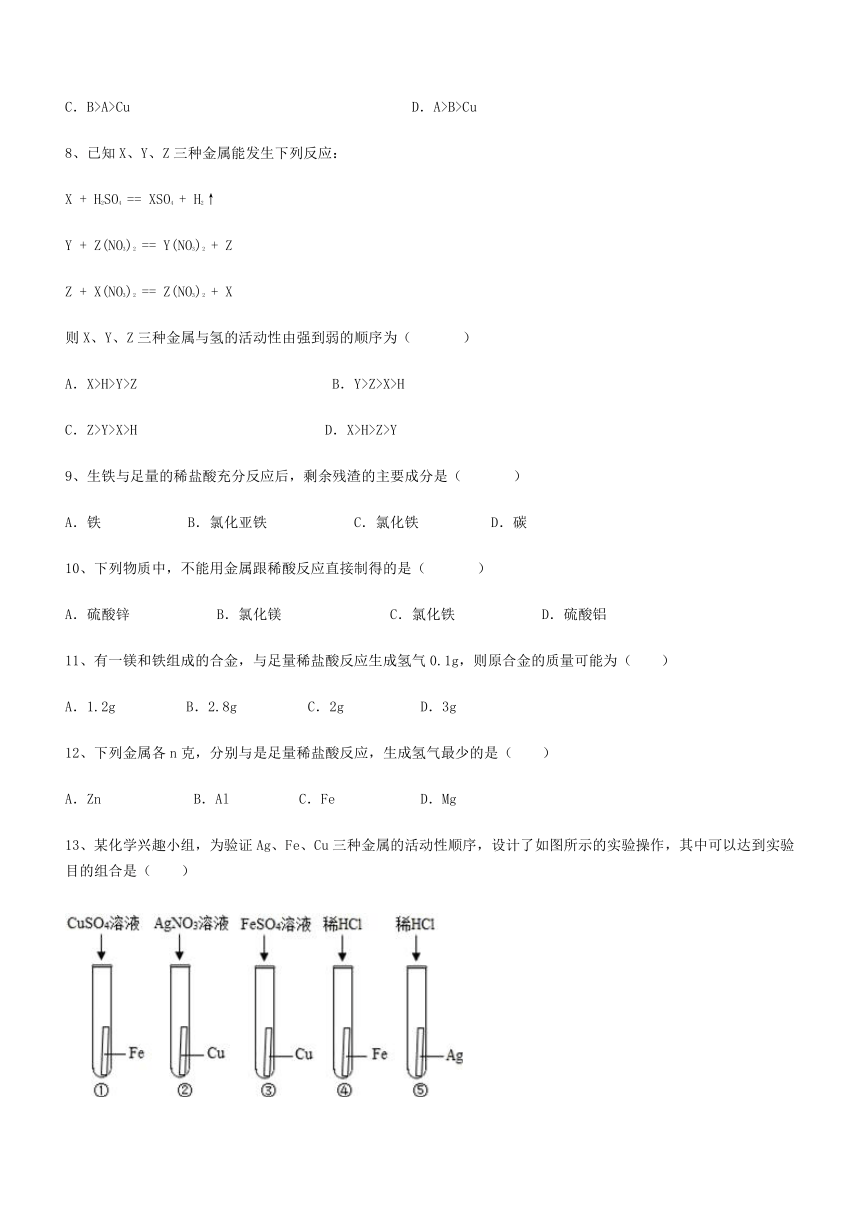
13、某化学兴趣小组,为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作,其中可以达到实验目的组合是( )
A.①③ B.②④ C.④⑤ D.②③
二、填空题
14、人类的生产和生活都离不开金属.
(1)生铁和钢中最主要的元素是 .用铝壶烧水主要利用铝良好的 性.
(2)铝具有很好抗腐蚀性的原因 (用化学方程式表示)
15、用FeCl2溶液、CuSO4溶液、Fe、Mg四种物质来验证Fe、Cu、Mg三种金属的活动性顺序,必须进行的两个反应是(用化学方程式表示):
(1)???????????? ;?? (2)????????????????? 。
16、氢气是一种清洁能源,氢气燃烧的化学方程式为 ,在实验室里可以通过置换反应来制取氢气,写出其中一个化学方程式: 。
17、在CuSO4和ZnSO4的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,则滤出的固体是 (填名称),滤液中一定含有的溶质为 、 (填化学式),有关反应的化学方程式为 。
18、置换反应是化学反应的基本类型之一。
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来。如铜和硝酸银溶液反应的化学方程式为??????????? 。
(2)非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:
Cl2+2NaBr=2NaCl+Br2,I2+Na2S=2NaI+S↓,Br2+2KI=2KBr+I2
由此可判断:S、Cl2、I2、Br2非金属活动性由强到弱顺序是???????? 。
19、人类生活离不开金属。
(1)铁是生活中常用的金属。图6是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热 。
①发热剂需接触到空气才会发热,原因是铁要与?? ???、????? ???等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是???????? ???????。
(2)应用金属活动性顺序能帮助我们进一步学习金属性质。
已知下列各组物质间均能发生置换反应。???????
A.Fe 和CuSO4 溶液? ????B.Mg和MnSO4 溶液?? C.Mn和FeSO4 溶液
①写出Fe 和CuSO4 溶液反应的化学方程式??????????????? 。
②Mn、Fe、Mg 、Cu四种金属的活动性由强到弱的顺序????????????? 。
三、实验,探究题
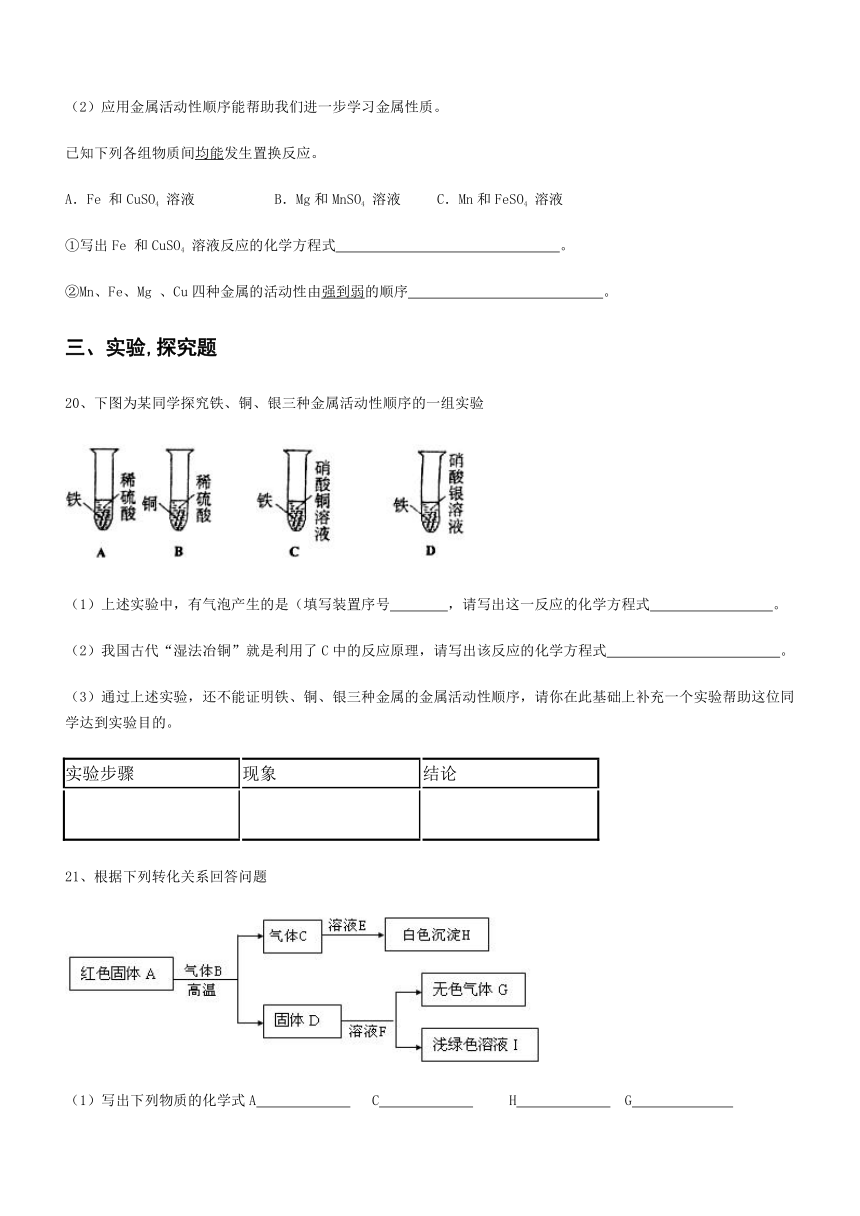
20、下图为某同学探究铁、铜、银三种金属活动性顺序的一组实验
(1)上述实验中,有气泡产生的是(填写装置序号 ,请写出这一反应的化学方程式 。
(2)我国古代“湿法冶铜”就是利用了C中的反应原理,请写出该反应的化学方程式 。
(3)通过上述实验,还不能证明铁、铜、银三种金属的金属活动性顺序,请你在此基础上补充一个实验帮助这位同学达到实验目的。
实验步骤 现象 结论
21、根据下列转化关系回答问题
(1)写出下列物质的化学式A? ? ? ??? C? ? ? ??? ?H? ? ? ???G? ? ? ? ?
(2)写出下列反应的方程式A+B→C+D? ? ? ? ? ? ? ? ? ? ? ? ? ?
D+F→G+I? ? ? ? ? ? ? ? ? ? ? ? ? ?
(3)若要仍生成C、D两种物质,气体B可以用? ? ??代替也能实现这样的转化
四、计算题
22、不纯的锌34克与200克硫酸溶液恰好完全反应,放出1克氢气.计算
(1)锌的纯度;(保留一位小数)
(2)原硫酸的质量百分比浓度.(保留一位小数)
23、某小组利用下列实验数据,计算金属M的相对原子质量。已知金属M和硫酸反应的化学方程式为: M + H2SO4 == MSO4 + H2↑。现取20 g该金属样品于烧杯中,然后向其中加入稀硫酸,实验数据记录如下:
实验编号 1 2 3 4 5
加入硫酸的质量/g ?? 100 ???200 ??? 300 ?? 400 ??? 500
烧杯中剩余物质量/g 119.8 219.6 319.4 419.4 519.4
??第5次实验后,烧杯中还有0.5 g剩余固体。
(1)原金属样品中M的质量????????
(2)计算该金属的相对原子质量。
24、小可同学为测定某铁合金的含铁量,做了如下实验,称取11.4克样品,放入质量为50.0克的烧杯中,再往烧杯中加入100.0克的稀盐酸(杂质不与酸反应、不溶于水)并对烧杯进行了四次称量,记录数据如下:
反应时间 t1 t2 t3 t4
烧杯总质量/克 161.4 161.2 161.0 161.0
求:(1)反应产生的氢气的质量
?? (2)该铁合金中铁的质量分数(保留一位小数)
参考答案
一、选择题
1、A;2、B;3、A;4、C;5、D;6、A;7、A;8、B;9、D;10、C;11、C.;12、A.;13、D.;
二、填空题
14、(1)铁元素;导热;(2)4Al+3O2═2Al2O3.
15、Fe +CuSO4== FeSO4+Cu?? Mg+FeCl2== MgCl2+Fe
16、2H2+O22H2O ???Zn+H2SO4==ZnSO4+H2↑(或Fe+2HCl==FeCl2+H2↑等合理答案)。
17、铜????? ZnSO4、FeSO4??????? Fe+CuSO4=FeSO4+Cu?
18、(1)Cu+2AgNO3=Cu(NO3)2+2Ag?????
(2)Cl2 Br2 I2 ?S
19、(1)①水、氧气????????????????????????????????????
②加速铁粉生锈,更快地放出热量??????????????????????????????? ?
(2) ①Fe+ CuSO4 === Fe SO4+ Cu (3分)? ?②Mg ?Mn ?Fe ?Cu??????
三、实验,探究题
20、(1)A????? Fe+H2SO4=FeSO4+H2↑
(2)Fe+CuSO4=FeSO4+Cu
(3)将Cu丝放入AgNO3溶液中
Cu的表面覆盖一层银白色物质? 溶液变蓝色???? Cu的活动大于Ag
21、Fe2O3? CO2? CaCO3? H2? 3CO + Fe2O3?==== 2Fe + 3CO2 ? ? ?Fe + H2SO4==== FeSO4?+ H2? ?H2
四、计算题
22、
23、
?
x=65
答:该金属的相对原子质量为65
24、(1)产生氢气的质量为:11.4克+100克+50克-161克=0.4克
?? (2)将氢气质量代入化学方程式求出铁的质量,进而求出其在样品中的质量分数为98.2%
同课章节目录
