苏教版高一化学必修2 从微观结构看物质的多样性(共23张PPT)
文档属性
| 名称 | 苏教版高一化学必修2 从微观结构看物质的多样性(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 825.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-10 10:40:39 | ||
图片预览






文档简介
(共23张PPT)
从微观结构看物质的多样性
苏教版高一必修Ⅱ 化学
一、同素异形现象
1.同素异形现象和同素异形体
(1)同一种元素能够形成几种不同的单质的现象叫做同素异形现象。
(2)同一种元素可形成不同单质,这些单质互称为这种元素的同素异形体。
一、同素异形现象
2.常见的同素异形体
(1)碳的同素异形体
金刚石 石墨 C60
结构特点 空间网状结构 层状结构 封闭笼状分子,形似足球
成键特点 每个碳原子与相邻的4个碳原子以共价键结合 层内碳原子间以共价键结合成平面六边形,层间以分子间作用力结合 60个碳原子以共价键结合
性质差异原因 晶体中原子的成键方式和排列方式不同
一、同素异形现象
2.常见的同素异形体
(2)氧的同素异形体
O2 O3
性质区别 无色无味气体 淡蓝色气体,有鱼腥味,氧化性极强
转化关系 3O2 2O3
差异原因 分子中氧原子的个数和氧原子的成键方式不同
放电
一、同素异形现象
2.常见的同素异形体
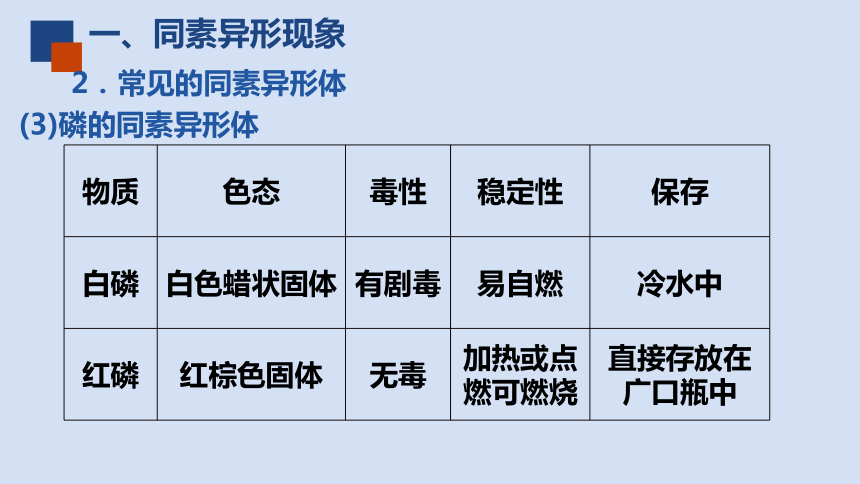
(3)磷的同素异形体
物质 色态 毒性 稳定性 保存
白磷 白色蜡状固体 有剧毒 易自燃 冷水中
红磷 红棕色固体 无毒 加热或点燃可燃烧 直接存放在广口瓶中
一、同素异形现象
2. 对同素异形体的理解
(1)组成元素:只含有一种元素。
(2)物质类别:互为同素异形体的只能是单质。
(3)性质关系:同素异形体之间的物理性质有差异,但化学性质相似。
(4)相互转化:同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成。
(5)同素异形体之间的转化既有单质参加,又有单质生成,但由于没有涉及化合价的变化,一般认为这种转化属于非氧化还原反应。
一、同素异形现象
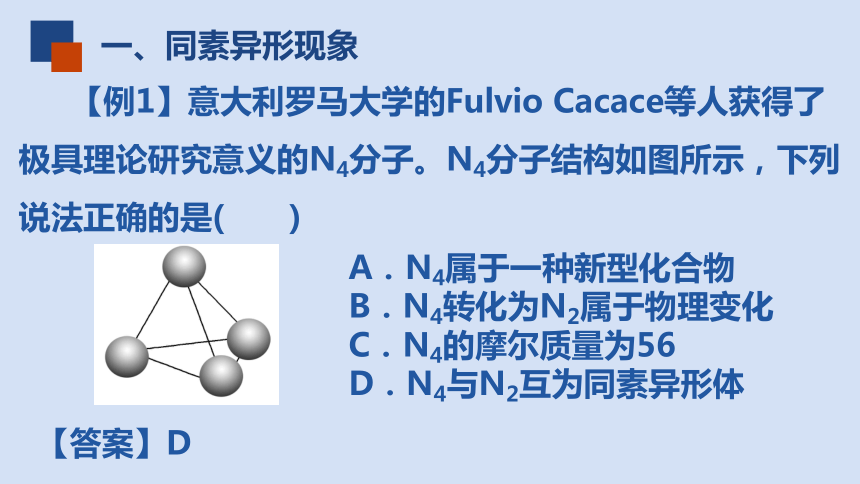
【例1】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是( )
A.N4属于一种新型化合物
B.N4转化为N2属于物理变化
C.N4的摩尔质量为56
D.N4与N2互为同素异形体
【答案】D
二、同分异构现象
1.同分异构现象和同分异构体
(1)化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。
(2)分子式相同而结构不同的化合物,互称为同分异构体。
(3)同分异构现象主要表现在有机化合物中。
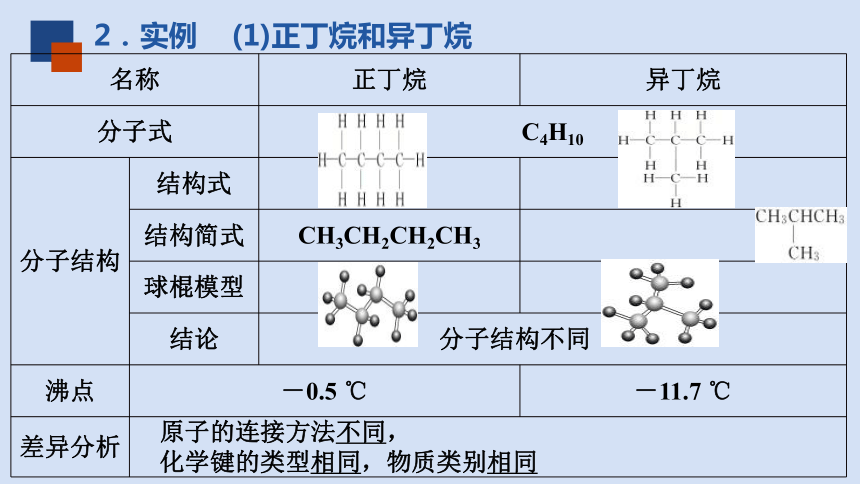
2.实例 (1)正丁烷和异丁烷
名称 正丁烷 异丁烷
分子式 C4H10
分子结构 结构式
结构简式 CH3CH2CH2CH3
球棍模型
结论 分子结构不同
沸点 -0.5 ℃ -11.7 ℃
差异分析 原子的连接方法不同,
化学键的类型相同,物质类别相同
2.实例 (2)乙醇和二甲醚
名称 乙醇 二甲醚
分子式 C2H6O
分子结构 结构式
结论 分子结构不同
性质 沸点 78 ℃ -23 ℃
物理性质不同,化学性质不同
二、同分异构现象
3.四角度认识同分异构体
(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物。
(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46。
(3)从结构看:互为同分异构体的化合物,空间结构不同。
(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。
【例2】下列各组物质中,属于同分异构体的是( )
A.白磷和红磷 B.干冰和CO2
C. 和
D. 和
【答案】D
三、不同类型的晶体
1.晶体
(1)晶体具有规则的几何外形,构成晶体的微粒有离子、分子、原子。
(2)常见的晶体类型有离子晶体、分子晶体、原子晶体和金属晶体。
(3)晶体有固定的熔、沸点。
三、不同类型的晶体
2.离子晶体
下图为氯化钠晶体结构示意图:
(1)构成氯化钠晶体的微粒是Na+和Cl-,微粒间的相互作用力是离子键,晶体类型是离子晶体。
(2)氯化钠晶体中不存在氯化钠分子,所以NaCl不表示氯化钠的分子式,仅表示在NaCl晶体中钠离子与氯离子的个数比是1∶1。
三、不同类型的晶体
3.分子晶体
下图为干冰晶体结构示意图。
(1)构成干冰晶体的微粒是CO2分子,微粒间的相互作用力是分子间作用力,晶体类型是分子晶体。
(2)干冰汽化时只需克服分子间作用力,对其分子内的共价键无影响。
三、不同类型的晶体
4.原子晶体
下图为石英晶体结构示意图。
(1)构成石英晶体的微粒是Si原子和O原子。微粒间的相互作用力是共价键,晶体类型是原子晶体。
(2)在石英晶体中,每个硅原子与4个氧原子结合,每个氧原子形成2个Si—O键。
(3)石英晶体的空间结构是正四面体型的空间网状结构。
(4)在石英晶体中,不存在SiO2分子,SiO2表示的意义是晶体中硅原子与氧原子的个数比为1∶2。
三、不同类型的晶体
类晶体性质的特点
晶体 氯化钠 氯化钡 金刚石 二氧化硅 硫 白磷
熔点/℃ 801 1 560 >3 550 1 723 112.8 44.1
硬度 较硬 较硬 很硬 硬而脆 脆 软
晶体类型 离子晶体 原子晶体 分子晶体
晶体特性 熔点较高硬度较大 熔点很高硬度很大 熔点较低硬度较小
三、不同类型的晶体
四种晶体的判断方法
(1)根据晶体的概念判断
(2)根据物质类别判断
①离子化合物(强碱和大多数盐)都是离子晶体;
②共价分子(单质或化合物)是分子晶体;
③常见的原子晶体,如二氧化硅、碳化硅、金刚石、晶体硅等。
(3)根据微粒间作用力判断
①离子晶体一定有离子键,可能有共价键,如Na2O2、NaOH等。
②分子晶体一定有分子间作用力(包括氢键),一定无离子键,有些可能在分子内存在共价键,如干冰。
③原子晶体一定有共价键,一定没有离子键。
【例3】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.CO2和SiO2 B.MgCl2和NaOH
C.金刚石和SiO2 D.氩和H2O
【答案】C
【例4】下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl I2 Br2
B.SiO2 CsCl Br2 I2
C.CsCl SiO2 I2 Br2
D.Br2 I2 CsCl SiO2
【答案】A
Ⅰ . ①BaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥碘片
按下列要求回答:
(1)熔化时不需要破坏化学键的是________(填序号,下同),熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)晶体以分子间作用力结合的是________。
【答案】(1)⑤⑥/②/②/⑤ (2)⑤⑥
作 业
Ⅱ. A.水晶(SiO2) B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
用字母回答下列问题:
(1)属于原子晶体的化合物是________,直接由原子构成的晶体是________,直接由原子构成的分子晶体是________。
(2)含有共价键的离子晶体是________,属于分子晶体的单质是________。
(3)在常温条件下能导电而不发生化学变化的是________,受热熔化后化学键不发生变化的是________,受热熔化需克服共价键的是________。
【答案】Ⅱ. (1)A AEH E
(2)F DE (3)G BDE AH
作 业
谢 谢 !
从微观结构看物质的多样性
苏教版高一必修Ⅱ 化学
一、同素异形现象
1.同素异形现象和同素异形体
(1)同一种元素能够形成几种不同的单质的现象叫做同素异形现象。
(2)同一种元素可形成不同单质,这些单质互称为这种元素的同素异形体。
一、同素异形现象
2.常见的同素异形体
(1)碳的同素异形体
金刚石 石墨 C60
结构特点 空间网状结构 层状结构 封闭笼状分子,形似足球
成键特点 每个碳原子与相邻的4个碳原子以共价键结合 层内碳原子间以共价键结合成平面六边形,层间以分子间作用力结合 60个碳原子以共价键结合
性质差异原因 晶体中原子的成键方式和排列方式不同
一、同素异形现象
2.常见的同素异形体
(2)氧的同素异形体
O2 O3
性质区别 无色无味气体 淡蓝色气体,有鱼腥味,氧化性极强
转化关系 3O2 2O3
差异原因 分子中氧原子的个数和氧原子的成键方式不同
放电
一、同素异形现象
2.常见的同素异形体
(3)磷的同素异形体
物质 色态 毒性 稳定性 保存
白磷 白色蜡状固体 有剧毒 易自燃 冷水中
红磷 红棕色固体 无毒 加热或点燃可燃烧 直接存放在广口瓶中
一、同素异形现象
2. 对同素异形体的理解
(1)组成元素:只含有一种元素。
(2)物质类别:互为同素异形体的只能是单质。
(3)性质关系:同素异形体之间的物理性质有差异,但化学性质相似。
(4)相互转化:同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成。
(5)同素异形体之间的转化既有单质参加,又有单质生成,但由于没有涉及化合价的变化,一般认为这种转化属于非氧化还原反应。
一、同素异形现象
【例1】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是( )
A.N4属于一种新型化合物
B.N4转化为N2属于物理变化
C.N4的摩尔质量为56
D.N4与N2互为同素异形体
【答案】D
二、同分异构现象
1.同分异构现象和同分异构体
(1)化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。
(2)分子式相同而结构不同的化合物,互称为同分异构体。
(3)同分异构现象主要表现在有机化合物中。
2.实例 (1)正丁烷和异丁烷
名称 正丁烷 异丁烷
分子式 C4H10
分子结构 结构式
结构简式 CH3CH2CH2CH3
球棍模型
结论 分子结构不同
沸点 -0.5 ℃ -11.7 ℃
差异分析 原子的连接方法不同,
化学键的类型相同,物质类别相同
2.实例 (2)乙醇和二甲醚
名称 乙醇 二甲醚
分子式 C2H6O
分子结构 结构式
结论 分子结构不同
性质 沸点 78 ℃ -23 ℃
物理性质不同,化学性质不同
二、同分异构现象
3.四角度认识同分异构体
(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物。
(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46。
(3)从结构看:互为同分异构体的化合物,空间结构不同。
(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。
【例2】下列各组物质中,属于同分异构体的是( )
A.白磷和红磷 B.干冰和CO2
C. 和
D. 和
【答案】D
三、不同类型的晶体
1.晶体
(1)晶体具有规则的几何外形,构成晶体的微粒有离子、分子、原子。
(2)常见的晶体类型有离子晶体、分子晶体、原子晶体和金属晶体。
(3)晶体有固定的熔、沸点。
三、不同类型的晶体
2.离子晶体
下图为氯化钠晶体结构示意图:
(1)构成氯化钠晶体的微粒是Na+和Cl-,微粒间的相互作用力是离子键,晶体类型是离子晶体。
(2)氯化钠晶体中不存在氯化钠分子,所以NaCl不表示氯化钠的分子式,仅表示在NaCl晶体中钠离子与氯离子的个数比是1∶1。
三、不同类型的晶体
3.分子晶体
下图为干冰晶体结构示意图。
(1)构成干冰晶体的微粒是CO2分子,微粒间的相互作用力是分子间作用力,晶体类型是分子晶体。
(2)干冰汽化时只需克服分子间作用力,对其分子内的共价键无影响。
三、不同类型的晶体
4.原子晶体
下图为石英晶体结构示意图。
(1)构成石英晶体的微粒是Si原子和O原子。微粒间的相互作用力是共价键,晶体类型是原子晶体。
(2)在石英晶体中,每个硅原子与4个氧原子结合,每个氧原子形成2个Si—O键。
(3)石英晶体的空间结构是正四面体型的空间网状结构。
(4)在石英晶体中,不存在SiO2分子,SiO2表示的意义是晶体中硅原子与氧原子的个数比为1∶2。
三、不同类型的晶体
类晶体性质的特点
晶体 氯化钠 氯化钡 金刚石 二氧化硅 硫 白磷
熔点/℃ 801 1 560 >3 550 1 723 112.8 44.1
硬度 较硬 较硬 很硬 硬而脆 脆 软
晶体类型 离子晶体 原子晶体 分子晶体
晶体特性 熔点较高硬度较大 熔点很高硬度很大 熔点较低硬度较小
三、不同类型的晶体
四种晶体的判断方法
(1)根据晶体的概念判断
(2)根据物质类别判断
①离子化合物(强碱和大多数盐)都是离子晶体;
②共价分子(单质或化合物)是分子晶体;
③常见的原子晶体,如二氧化硅、碳化硅、金刚石、晶体硅等。
(3)根据微粒间作用力判断
①离子晶体一定有离子键,可能有共价键,如Na2O2、NaOH等。
②分子晶体一定有分子间作用力(包括氢键),一定无离子键,有些可能在分子内存在共价键,如干冰。
③原子晶体一定有共价键,一定没有离子键。
【例3】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.CO2和SiO2 B.MgCl2和NaOH
C.金刚石和SiO2 D.氩和H2O
【答案】C
【例4】下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl I2 Br2
B.SiO2 CsCl Br2 I2
C.CsCl SiO2 I2 Br2
D.Br2 I2 CsCl SiO2
【答案】A
Ⅰ . ①BaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥碘片
按下列要求回答:
(1)熔化时不需要破坏化学键的是________(填序号,下同),熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)晶体以分子间作用力结合的是________。
【答案】(1)⑤⑥/②/②/⑤ (2)⑤⑥
作 业
Ⅱ. A.水晶(SiO2) B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
用字母回答下列问题:
(1)属于原子晶体的化合物是________,直接由原子构成的晶体是________,直接由原子构成的分子晶体是________。
(2)含有共价键的离子晶体是________,属于分子晶体的单质是________。
(3)在常温条件下能导电而不发生化学变化的是________,受热熔化后化学键不发生变化的是________,受热熔化需克服共价键的是________。
【答案】Ⅱ. (1)A AEH E
(2)F DE (3)G BDE AH
作 业
谢 谢 !
