人教版化学九年级下册第9单元《溶液》测试题(含答案)
文档属性
| 名称 | 人教版化学九年级下册第9单元《溶液》测试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 931.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-11 23:00:00 | ||
图片预览



文档简介
第9单元《溶液》测试题
一、单选题(每小题只有一个正确答案)
1.能减少氧气在水中溶解度的方法是
A.升高温度 B.减少氧气的体积 C.减少水的质量 D.增大压强
2.分析和推理是化学学习常用的方法。以下分析或推理正确的是( )
A.分子、原子都是不显电性的粒子,不显电性的粒子不一定是分子或原子
B.燃烧都伴随有发光、放热现象,有发光、放热现象的变化一定是燃烧
C.化合物是由两种或两种以上元素组成的纯净物,两种或两种以上的元素组成的物质一定是化合物
D.氢氧化钠溶于水放出热量,物质溶于水就会放出热量
3.韩国科学家们发现,一种新型化学粒子可有效淸除脑部淀粉样颗粒。下列微观粒子构成物质的说法正确的是( )
A.铁由铁原子构成,所有物质都由原子构成
B.O2由氧分子构成,H2O2由H2分子和O2分子构成
C.由一种阳离子和一种阴离子构成的物质属于化合物
D.蔗糖溶液由蔗糖分子和水分子构成,氯化钠溶液由氯化钠分子和水分子构成
4.下图是A、B两种不含结晶水的固体物质的溶解度曲线.下列说法中错误的是( )
A.t1℃时A、B的溶解度相等
B.B的溶解度都随温度升高而增大
C.将t2℃时A的饱和溶液降温到t1℃时,溶液变稀了
D.将t2℃时A、B的饱和溶液降温到t1℃,A溶液会析出晶体而B不会
5.下列有关溶液的说法中正确的是
A.溶液一定是无色透明的 B.溶液一定是均一、稳定的液体
C.溶液都是由溶质和溶剂组成的 D.碘酒的溶剂是水
6.下列各组物质能够得到溶液的是
A.碳酸钙和水 B.高锰酸钾和汽油 C.碘和水 D.二氧化碳和水
7.下列关于溶液说法正确的是( )
A.任何饱和溶液升高温度都会变为不饱和溶液
B.把20%的食盐溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g10%的氯化钠溶液一般经过计算、称量(或量取)溶解装瓶存放等步骤
8.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是
①称量的氯化钠固体中含有不溶性杂质;②用量筒量取水时俯视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.②③ C.②④ D.③④
9.要配制溶质质量分数为的氯化钠溶液,下列操作正确的是
A.将氯化钠固体直接放在天平的托盘上称量
B.用于溶解氯化钠的烧杯内壁有大量水滴
C.为加快固体溶解,用玻璃棒边搅拌边碾压氯化钠晶体
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
10.能证明某KCl溶液在20℃时已经达到饱和状态的方法是( )
A.温度不变时,向该溶液中加入少量水,结果溶液变稀
B.取少量该溶液,降温至10℃时,有KCl晶体析出
C.取少量该溶液升温,无KCl晶体析出
D.温度不变时,向该溶液中加入少量KCl晶体,晶体质量不再改变
11.小琪将盛有水的烧杯中加入一种物质,轻轻搅拌后,发现温度明显下降。她加入的物质是
A.食盐 B.硝酸铵 C.氢氧化钠固体 D.蔗糖
12.一瓶气体经化验知道其中只有一种元素,则该气体( )
A.是一种单质 B.是单质与化合物的混合物
C.是一种化合物 D.可能是一种单质,也可能是几种单质的混合物
13.实验室用蒸馏水和密度为1.84g/cm3、质量分数为98%的浓硫酸,配制500g质量分数为20%的稀硫酸。需要用多大体积的量筒取多少毫升的浓硫酸( )
A.100mL 55.46mL B.100mL 55.5mL C.250mL 55.46mL D.250mL 55.5mL
14.下列有关溶液的说法中,正确的是
A.溶液都是无色透明的液体
B.溶液是均一、稳定的混合物
C.将NaCl放入植物油中搅拌,能形成溶液
D.将40%的NaOH溶液均分成两份,每份溶液的溶质质量分数都为20%
15.某温度时,在m g食盐溶液中加入n g食盐,经充分搅拌后,得w g食盐溶液。则m、n、w之间的关系为( )
A.m+n=w B.m+n≤w C.m+n≥w D.m+n<w
二、填空题
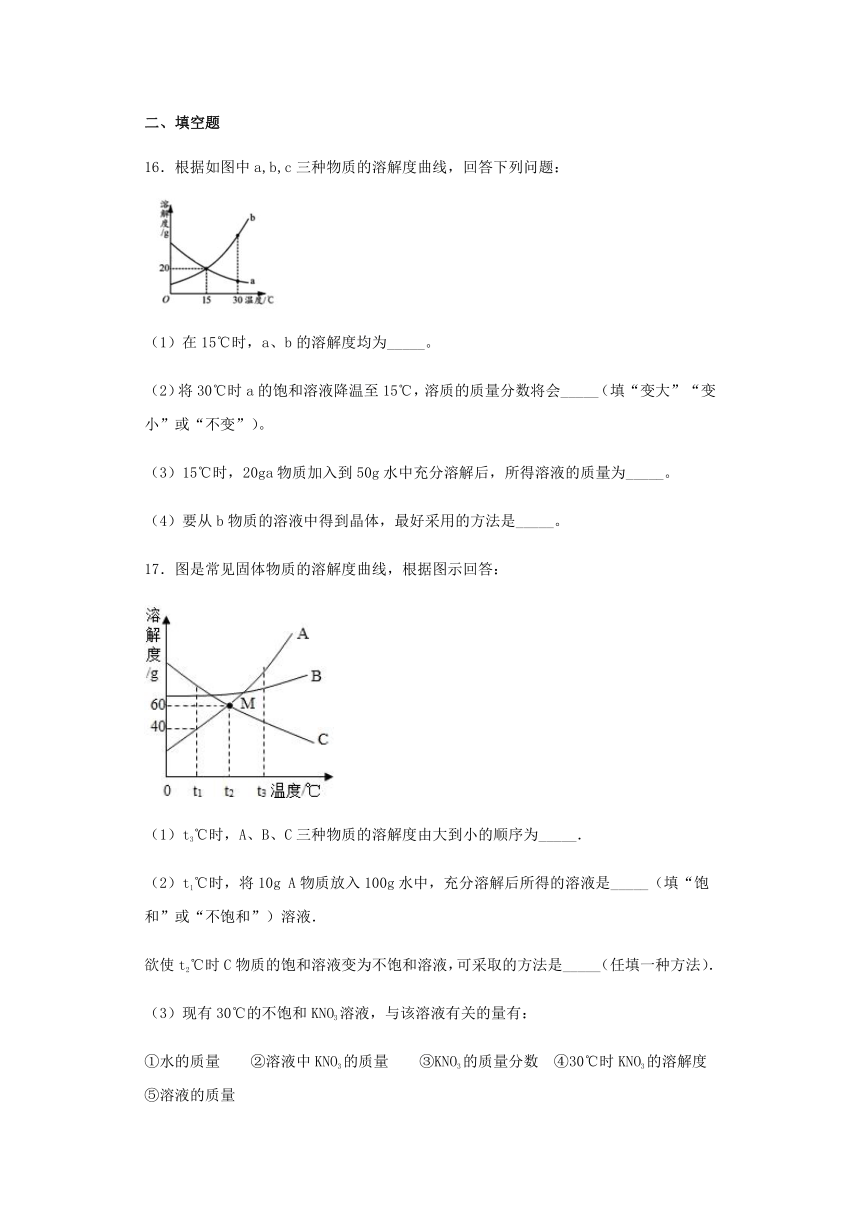
16.根据如图中a,b,c三种物质的溶解度曲线,回答下列问题:
(1)在15℃时,a、b的溶解度均为_____。
(2)将30℃时a的饱和溶液降温至15℃,溶质的质量分数将会_____(填“变大”“变小”或“不变”)。
(3)15℃时,20ga物质加入到50g水中充分溶解后,所得溶液的质量为_____。
(4)要从b物质的溶液中得到晶体,最好采用的方法是_____。
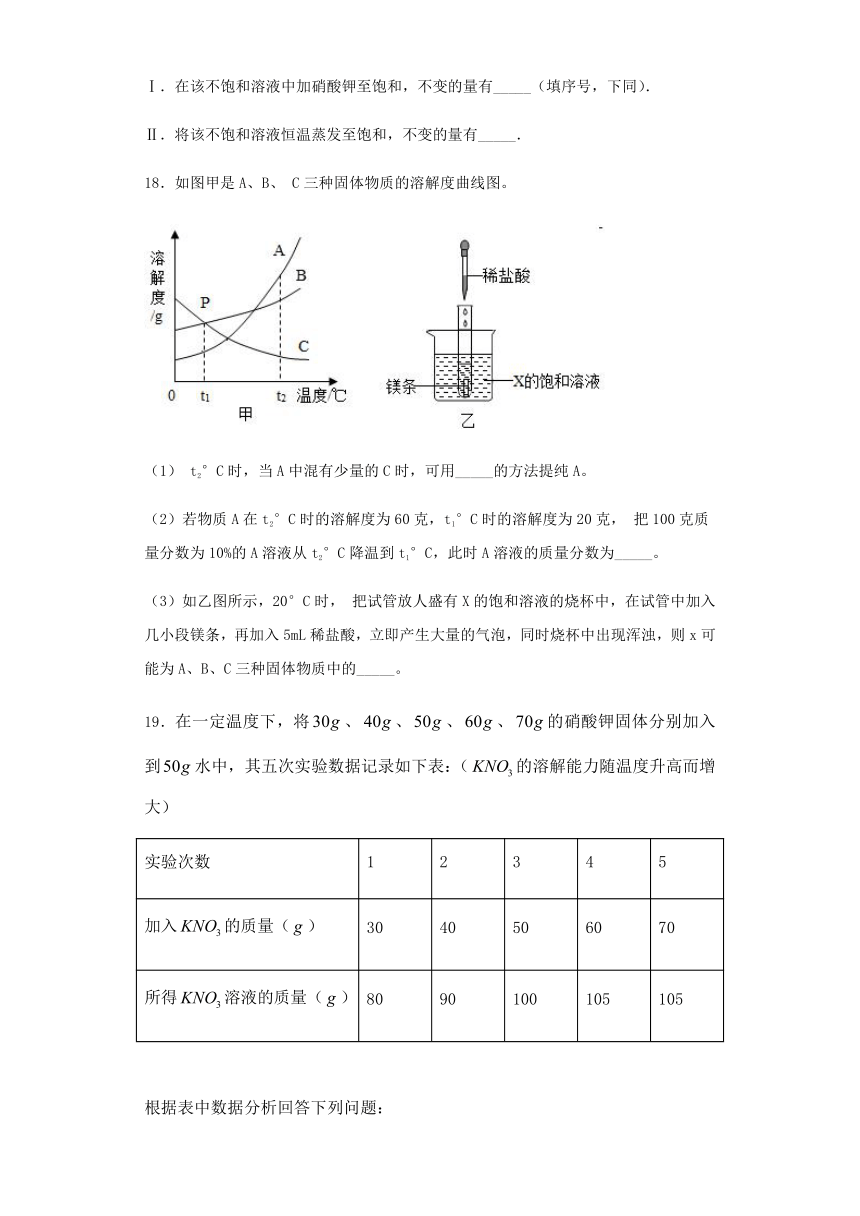
17.图是常见固体物质的溶解度曲线,根据图示回答:
(1)t3℃时,A、B、C三种物质的溶解度由大到小的顺序为_____.
(2)t1℃时,将10g A物质放入100g水中,充分溶解后所得的溶液是_____(填“饱和”或“不饱和”)溶液.
欲使t2℃时C物质的饱和溶液变为不饱和溶液,可采取的方法是_____(任填一种方法).
(3)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:
①水的质量 ②溶液中KNO3的质量 ③KNO3的质量分数 ④30℃时KNO3的溶解度 ⑤溶液的质量
Ⅰ.在该不饱和溶液中加硝酸钾至饱和,不变的量有_____(填序号,下同).
Ⅱ.将该不饱和溶液恒温蒸发至饱和,不变的量有_____.
18.如图甲是A、B、 C三种固体物质的溶解度曲线图。
(1) t2°C时,当A中混有少量的C时,可用_____的方法提纯A。
(2)若物质A在t2°C时的溶解度为60克,t1°C时的溶解度为20克, 把100克质量分数为10%的A溶液从t2°C降温到t1°C,此时A溶液的质量分数为_____。
(3)如乙图所示,20°C时, 把试管放人盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则x可能为A、B、C三种固体物质中的_____。
19.在一定温度下,将、、、、的硝酸钾固体分别加入到水中,其五次实验数据记录如下表:(的溶解能力随温度升高而增大)
实验次数 1 2 3 4 5
加入的质量() 30 40 50 60 70
所得溶液的质量() 80 90 100 105 105
根据表中数据分析回答下列问题:
(1)第_________次起得到的溶液为饱和溶液;
(2)在该温度下, 水中溶解___________ 刚好达到饱和,所得溶液的溶质质量分数是___;
(3)要使接近饱和的溶液,在不改变溶液质量的前提下变为饱和溶液,可以采用的方法是_;
(4)如图所示,小烧杯中盛放的是硝酸钾的饱和溶液,若将少量的下列物质分别放入大烧杯中的水中,不断搅拌,则小烧杯中一定有硝酸钾晶体析出的是_________(填字母)。
A.硝酸铵 B.氢氧化钠 C.冰 D.浓硫酸
(5)通过___________操作可将上述(4)中析出的硝酸钾晶体与硝酸钾溶液分离。
20.下图是实验室制取气体常见的装置,回答有关问题。
① 写出编号仪器的名称:a.________;
写出实验室用A装置制氧气的化学方程式_________。
② 下列四种途径都可以得到二氧化碳:
Ⅰ. 写出甲途径生成二氧化碳的化学方程式________,把产生的二氧化碳通入紫色石蕊试液中,溶液呈________色。
Ⅱ. 甲乙途径都能用石灰石生成二氧化碳,主要因为这种原料含有________元素,而且来源非常广泛。实验室不用丙丁途径制取二氧化碳的主要理由是_______。
Ⅲ. 写出实验室用乙途径制取二氧化碳,且能控制反应的发生和停止的装置组合(填序号)_________。
③ 乙途径中用12.5g石灰石(纯度为80%)与73g未知浓度的盐酸溶液,恰好完全反应。求:
Ⅰ. 石灰石中碳酸钙物质的量是_________mol。
Ⅱ. 该盐酸溶液的溶质质量分数。(根据化学方程式列式计算)________
三、推断题
21.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3 的溶解度曲线“消失”了,其原因可能是_____。
22.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
四、实验题
23.在实验室配制15%的氯化钠溶液50g。需要氯化钠的质量为_____克,需水的体积为_____mL,该同学按如图所示步骤依次操作:其中操作错误的步骤是_____(填字母);E中玻璃棒的作用是_____。若图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为_____克。若无其它错误,此实验最终导致所配制的溶液中溶质质量分数将_____(填“偏大”或“偏小”)。
24.下表是空气中的气体成分和人体呼出的气体成分含量对照表:
气体成分 氮气 氧气 二氧化碳 水 其他气体
空气中的气体(﹪) 78 21 0.03 0.07 0.9
呼出的气体(﹪) 78 16 4 1.1 0.9
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入的气体成分的含量有什么不同,其四个主要操作步骤如图(1、2、3、4)所示,请依据图示将主要实验操作步骤及验证依据填入下表中的空白处:
实验步骤 验证依据
1、用排水法收集两瓶呼出的气体,另收集两瓶空气。
2、将澄清石灰水分别滴入盛有呼出的气体和空气的集气瓶中。 根据 ,判断二氧化碳含量不同。
3、 。 根据木条燃烧情况的不同,判断氧气含量不同。
4、 。 根据 ,判断水含量不同。
五、计算题
25.今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
试计算:
(1)共制得氢气。
(2)反应中消耗的锌粒的质量。(写出计算过程)
(3)实验所用稀硫酸中溶质的质量分数。(写出计算过程,保留一位小数)
26.菱铁矿(主要成分是FeCO3)是炼铁的原料,现取20. 0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示。
(1)完成化学反应方程式:_____
(2)20. 0g菱铁矿中FeCO3的质量分数为_____;
(3)列式计算恰好完全反应时,所得溶液的质量_____;
(4)向上述所得溶液中加入_____g 水,能得到10%的硫酸亚铁溶液,用于缺铁花卉的营养液。
参考答案
1.A 2.A 3.C 4.D 5.C 6.D 7.D 8.B 9.D 10.D 11.B 12.D 13.B 14.B 15.C 16.20g 不变 60g 冷却结晶
17.A、B、C 不饱和 降低温度(或加入溶剂水) ①④ ②④
18.冷却热饱和溶液(方法正确即可) 10% C
19. 4 55 52.4% 降温 过滤
20.试管2H2O22H2O+ O2↑CaCO3CaO+CO2↑红碳、氧元素 (符号也得分,多写不给分)得到的二氧化碳纯度不高B、F0.1mol解:设HCl的物质的量为xmol
CaCO3+2HCl CaCl2+ H2O + CO2↑
1 2
0.1 x
x=0.2mol
0.2×36.5 /73=0.1(或10%)
21.过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
22.Fe + H2SO4 = Fe SO4 + H2↑ 过滤 CO2 7 : 9 1290
23.7.5 42.5 A、B 搅拌,加速溶解 2.5 偏小
24.石灰水变浑浊的程度不同 将燃着的木条分别伸入盛有呼出的气体和空气的集气瓶中 取两块干燥的玻璃片,对其中一块呼气 玻璃片上水蒸气的多少
25.(1)0.2;(2)6.5g;(3)19.6%
26. 58% 57.2g 94.8g
同课章节目录
