课题1 溶液的形成 课件(26张PPT)
图片预览




文档简介
(共26张PPT)
①
②
③
④
⑤
⑥
分类标准:
是否有颜色?
是否纯净物?
溶液
溶液的形成
第9单元·课题1
——以食盐水和碘酒为例
1.将碘溶入酒精中,形成 。
2.将 溶入 中,形成食盐水溶液。
3.煮汤时,把盐和糖都加入汤水中?是否都能溶解?
食盐
水
【生活经验】
环节一:溶液的概念
碘酒(碘酊)
环节一:溶液的概念
定义:一种或几种物质分散到另一种物质里,
形成均一的、稳定的混合物。
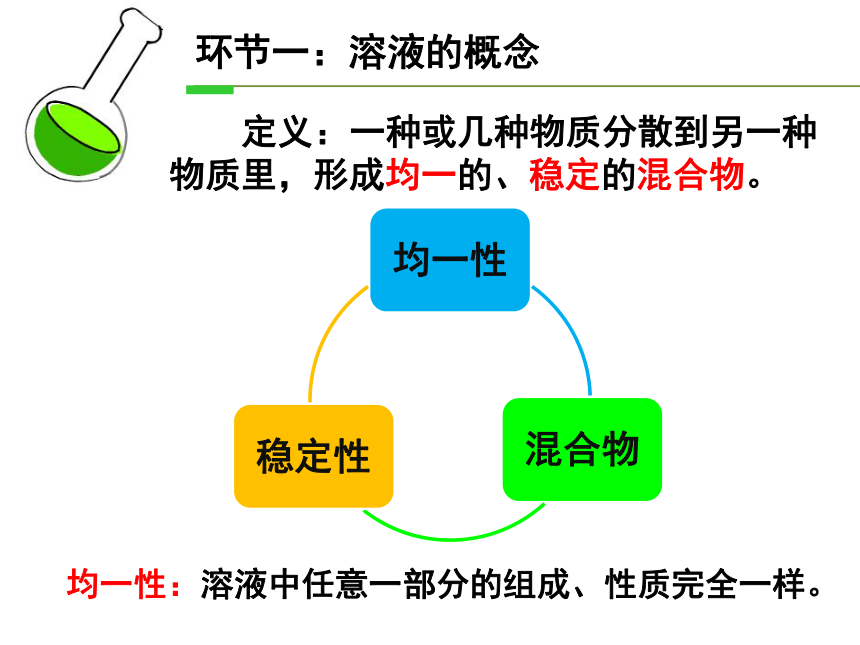
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
均一性:溶液中任意一部分的组成、性质完全一样。
环节一:溶液的概念
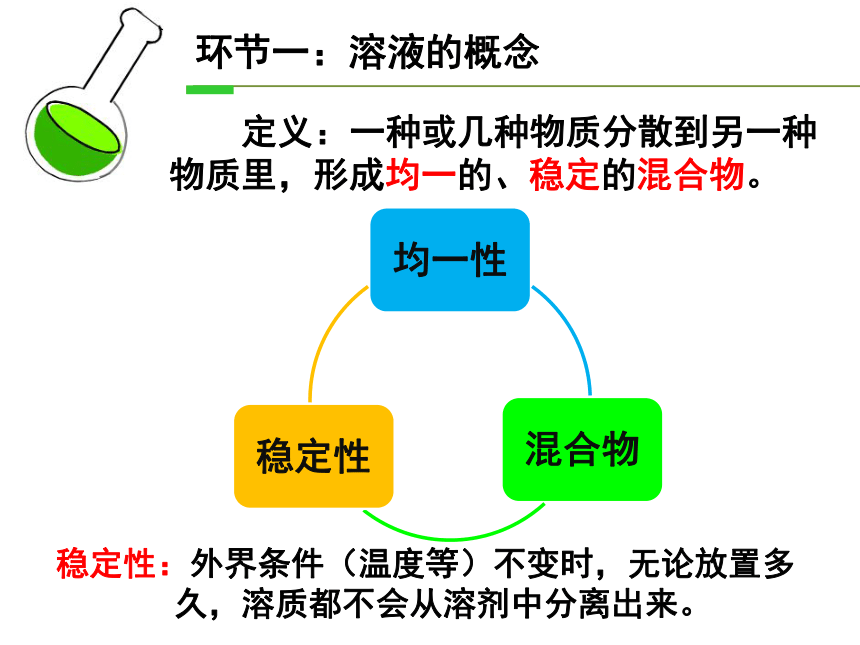
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
环节一:溶液的概念
稳定性:外界条件(温度等)不变时,无论放置多
久,溶质都不会从溶剂中分离出来。
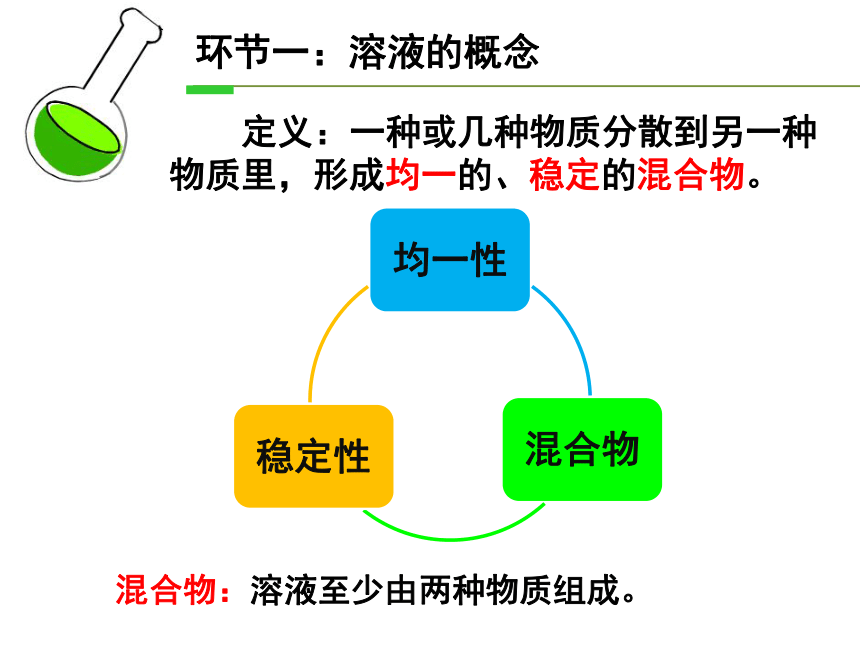
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
混合物:溶液至少由两种物质组成。
环节一:溶液的概念
①
②
③
④
⑤
⑥
溶液
√
√
√
不均一
纯净物
不稳定
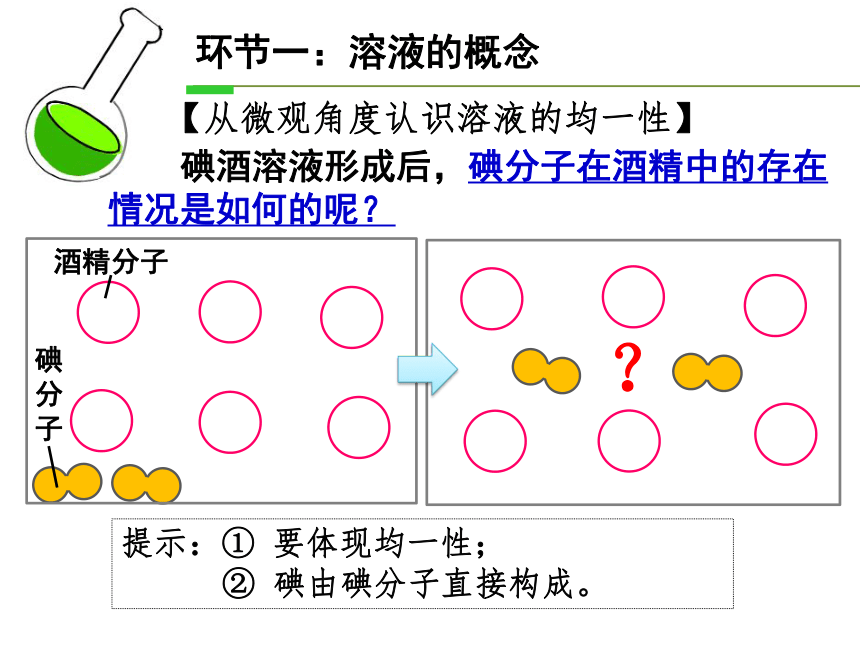
【从微观角度认识溶液的均一性】
酒精分子
碘分子
碘酒溶液形成后,碘分子在酒精中的存在情况是如何的呢?
环节一:溶液的概念
提示:① 要体现均一性;
② 碘由碘分子直接构成。
?
【从微观角度认识溶液的均一性】
酒精分子
碘分子
碘酒溶液形成后,碘分子在酒精中的存在情况是如何的呢?
环节一:溶液的概念
②碘在酒精中以碘分子形式存在。
分析:①碘分子均匀分散到酒精分子的间隔中去了。
?
请在下图中画出食盐溶液形成后,氯化钠在水中的存在情况。
水分子
氯化钠
Cl—
Cl—
Na+
Na+
【从微观角度认识溶液的均一性】
环节一:溶液的概念
提示:
① 要体现均一性;
② 氯化钠由Na+和Cl-两种离子构成。
【从微观角度认识溶液的均一性】
分析:
①氯化钠在水中以Na+和Cl-的形式存在;
环节一:溶液的概念
②Na+和Cl-均匀分散到水分子的间隔中去了。
Cl—
Cl—
Na+
Na+
环节一:溶液的概念
被溶解的物质
溶解其他物质的物质
(1种或多种)
(只能有1种)
环节二:溶液的组成
(1)溶质、溶剂的定义
可气
可液
可固
可气
可液
可固
可气
可液
可固
(水是最重要的溶剂)
(汽油、酒精也是常用的溶剂)
环节二:溶液的组成
(2)溶质、溶剂的状态
溶液质量 = 溶质质量 + 溶剂质量
(3)质量关系
环节二:溶液的组成
食盐水的质量
=
+
(被溶解的才算)
溶液
高锰酸钾溶液
碘酒
盐酸
溶质
溶剂
KMnO4
水
碘
酒精
HCl气体
水
环节二:溶液的组成
澄清石灰水
Ca(OH)2
水
硫酸铜溶液
CuSO4
水
不指明溶剂的溶液,溶剂一般指的是水。
实验室配制溶液时,下列溶剂中最常用的是( )
A. 酒精 B. 水
C. 汽油 D. 植物油
2. 下列说法正确的是( )
A. 溶液都是无色透明的
B. 溶质只能是固体物质
C. 溶液中可以含有多种溶质
D. 溶液是均一、稳定的混合物
课堂练习
B
D
环节三:探究影响溶解的因素
在酒精和水中的溶解能力是否相同?
碘
环节三:探究影响溶解的因素
(3) 不同溶质在 水 中溶解能力是否相同?
(1) 碘 在不同溶剂中溶解能力是否相同?
溶质
溶剂
【提出问题】
【作出猜想】
氯化钠
酒精
水
(2) 氯化钠 在不同溶剂中溶解能力是否相同?
(4) 不同溶质在 酒精 中溶解能力是否相同?
碘
不同
不同
不同
不同
【进行实验】
环节三:探究影响溶解的因素
碘
(1小勺)
氯化钠
(1小勺)
水
(3滴管)
酒精
(3滴管)
【制定探究方案】
① 先写好标签并分别贴到试管中上部;
② 注意装药品顺序:
先固后液
注意:
水
(3滴管)
酒精
(3滴管)
环节三:探究影响溶解的因素
序号 溶剂 溶质 现象
① 水 碘
②
③
④
几乎不溶于水
溶于水,形成无色溶液
溶于酒精,形成棕褐色溶液
几乎不溶于酒精
1.比较试管①②(或③④)的现象,可得出:
不同溶质在同一溶剂里的溶解能力不同。
2.比较试管②④(或①③)的现象,可得出:
同种溶质在不同溶剂里的溶解能力不同。
碘
酒精
酒精
氯化钠
【收集证据】
氯化钠
水
环节三:探究影响溶解的因素
物质溶解能力的大小与溶质和溶剂本身的性质有关。
【实验结论】
由于碘难溶于水,所以医院里选择溶解碘能力较强的酒精作为溶剂。
环节三:探究影响溶解的因素
根据生活经验,如何在最短时间内冲一杯盐水?
① ,你的预测 ;
② ,你的预测 ;
③ ,你的预测 。
温度
温度越高,食盐溶解越快
颗粒越小,食盐溶解越快
食盐颗粒大小
是否搅拌
搅拌能加快食盐的溶解
【比一比】
最佳方法:取NaCl粉末于杯子中,用温水溶解,并用筷子搅拌。
限定用品:
NaCl粉末、NaCl颗粒;冰水、温水、筷子、杯子。
可以有多种
溶质
被溶解
的物质
一种或
几种物质
分散到
另一种物质
溶剂
均一、稳定、
混合物
溶液
能溶解其他
物质的物质
固体、液体、气体
一般水是溶剂
只有一种
课堂小结
不同溶质在同一溶剂里的溶解能力不同。
同种溶质在不同溶剂里的溶解能力不同。
请批评指正!
①
②
③
④
⑤
⑥
分类标准:
是否有颜色?
是否纯净物?
溶液
溶液的形成
第9单元·课题1
——以食盐水和碘酒为例
1.将碘溶入酒精中,形成 。
2.将 溶入 中,形成食盐水溶液。
3.煮汤时,把盐和糖都加入汤水中?是否都能溶解?
食盐
水
【生活经验】
环节一:溶液的概念
碘酒(碘酊)
环节一:溶液的概念
定义:一种或几种物质分散到另一种物质里,
形成均一的、稳定的混合物。
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
均一性:溶液中任意一部分的组成、性质完全一样。
环节一:溶液的概念
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
环节一:溶液的概念
稳定性:外界条件(温度等)不变时,无论放置多
久,溶质都不会从溶剂中分离出来。
定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
混合物:溶液至少由两种物质组成。
环节一:溶液的概念
①
②
③
④
⑤
⑥
溶液
√
√
√
不均一
纯净物
不稳定
【从微观角度认识溶液的均一性】
酒精分子
碘分子
碘酒溶液形成后,碘分子在酒精中的存在情况是如何的呢?
环节一:溶液的概念
提示:① 要体现均一性;
② 碘由碘分子直接构成。
?
【从微观角度认识溶液的均一性】
酒精分子
碘分子
碘酒溶液形成后,碘分子在酒精中的存在情况是如何的呢?
环节一:溶液的概念
②碘在酒精中以碘分子形式存在。
分析:①碘分子均匀分散到酒精分子的间隔中去了。
?
请在下图中画出食盐溶液形成后,氯化钠在水中的存在情况。
水分子
氯化钠
Cl—
Cl—
Na+
Na+
【从微观角度认识溶液的均一性】
环节一:溶液的概念
提示:
① 要体现均一性;
② 氯化钠由Na+和Cl-两种离子构成。
【从微观角度认识溶液的均一性】
分析:
①氯化钠在水中以Na+和Cl-的形式存在;
环节一:溶液的概念
②Na+和Cl-均匀分散到水分子的间隔中去了。
Cl—
Cl—
Na+
Na+
环节一:溶液的概念
被溶解的物质
溶解其他物质的物质
(1种或多种)
(只能有1种)
环节二:溶液的组成
(1)溶质、溶剂的定义
可气
可液
可固
可气
可液
可固
可气
可液
可固
(水是最重要的溶剂)
(汽油、酒精也是常用的溶剂)
环节二:溶液的组成
(2)溶质、溶剂的状态
溶液质量 = 溶质质量 + 溶剂质量
(3)质量关系
环节二:溶液的组成
食盐水的质量
=
+
(被溶解的才算)
溶液
高锰酸钾溶液
碘酒
盐酸
溶质
溶剂
KMnO4
水
碘
酒精
HCl气体
水
环节二:溶液的组成
澄清石灰水
Ca(OH)2
水
硫酸铜溶液
CuSO4
水
不指明溶剂的溶液,溶剂一般指的是水。
实验室配制溶液时,下列溶剂中最常用的是( )
A. 酒精 B. 水
C. 汽油 D. 植物油
2. 下列说法正确的是( )
A. 溶液都是无色透明的
B. 溶质只能是固体物质
C. 溶液中可以含有多种溶质
D. 溶液是均一、稳定的混合物
课堂练习
B
D
环节三:探究影响溶解的因素
在酒精和水中的溶解能力是否相同?
碘
环节三:探究影响溶解的因素
(3) 不同溶质在 水 中溶解能力是否相同?
(1) 碘 在不同溶剂中溶解能力是否相同?
溶质
溶剂
【提出问题】
【作出猜想】
氯化钠
酒精
水
(2) 氯化钠 在不同溶剂中溶解能力是否相同?
(4) 不同溶质在 酒精 中溶解能力是否相同?
碘
不同
不同
不同
不同
【进行实验】
环节三:探究影响溶解的因素
碘
(1小勺)
氯化钠
(1小勺)
水
(3滴管)
酒精
(3滴管)
【制定探究方案】
① 先写好标签并分别贴到试管中上部;
② 注意装药品顺序:
先固后液
注意:
水
(3滴管)
酒精
(3滴管)
环节三:探究影响溶解的因素
序号 溶剂 溶质 现象
① 水 碘
②
③
④
几乎不溶于水
溶于水,形成无色溶液
溶于酒精,形成棕褐色溶液
几乎不溶于酒精
1.比较试管①②(或③④)的现象,可得出:
不同溶质在同一溶剂里的溶解能力不同。
2.比较试管②④(或①③)的现象,可得出:
同种溶质在不同溶剂里的溶解能力不同。
碘
酒精
酒精
氯化钠
【收集证据】
氯化钠
水
环节三:探究影响溶解的因素
物质溶解能力的大小与溶质和溶剂本身的性质有关。
【实验结论】
由于碘难溶于水,所以医院里选择溶解碘能力较强的酒精作为溶剂。
环节三:探究影响溶解的因素
根据生活经验,如何在最短时间内冲一杯盐水?
① ,你的预测 ;
② ,你的预测 ;
③ ,你的预测 。
温度
温度越高,食盐溶解越快
颗粒越小,食盐溶解越快
食盐颗粒大小
是否搅拌
搅拌能加快食盐的溶解
【比一比】
最佳方法:取NaCl粉末于杯子中,用温水溶解,并用筷子搅拌。
限定用品:
NaCl粉末、NaCl颗粒;冰水、温水、筷子、杯子。
可以有多种
溶质
被溶解
的物质
一种或
几种物质
分散到
另一种物质
溶剂
均一、稳定、
混合物
溶液
能溶解其他
物质的物质
固体、液体、气体
一般水是溶剂
只有一种
课堂小结
不同溶质在同一溶剂里的溶解能力不同。
同种溶质在不同溶剂里的溶解能力不同。
请批评指正!
同课章节目录
