课题2 溶解度第二课时 固体溶解度的表示方法 课件(24张PPT)
文档属性
| 名称 | 课题2 溶解度第二课时 固体溶解度的表示方法 课件(24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-12 11:31:42 | ||
图片预览




文档简介
(共24张PPT)
九年级化学人教版第九章第二课
《 溶解度的表示方法及应用》
固体溶解度的表示方法及应用
1、如何表示固体溶解度?
在一定温度下,某固态物质在100克溶剂中达到饱和状态时溶解的质量来表示
复 习 回 顾
2、溶解度与溶解性的关系
溶解性
溶解度/g (20℃)
易溶
可溶
微溶
难溶
S>10g
1g0.01gS<0.01g
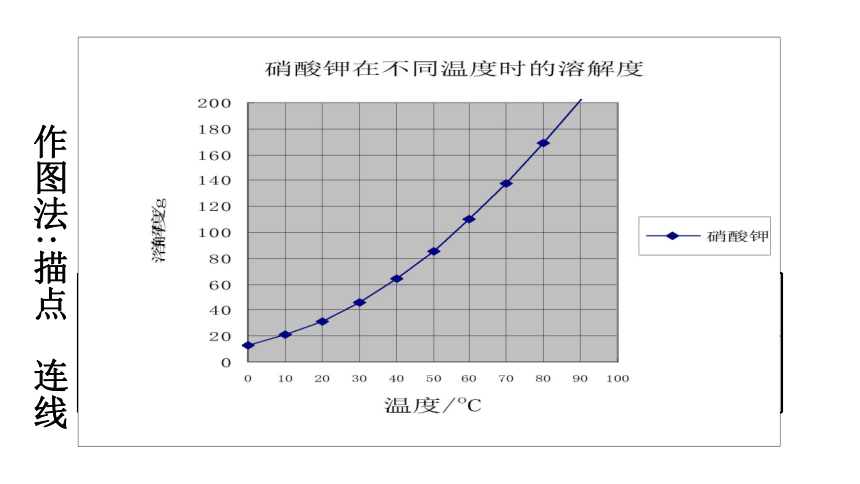
温度/oC 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
硝酸钾在不同温度下的溶解度:
一、固体溶解度的表示方法
1、列表法
作图法:描点 连线
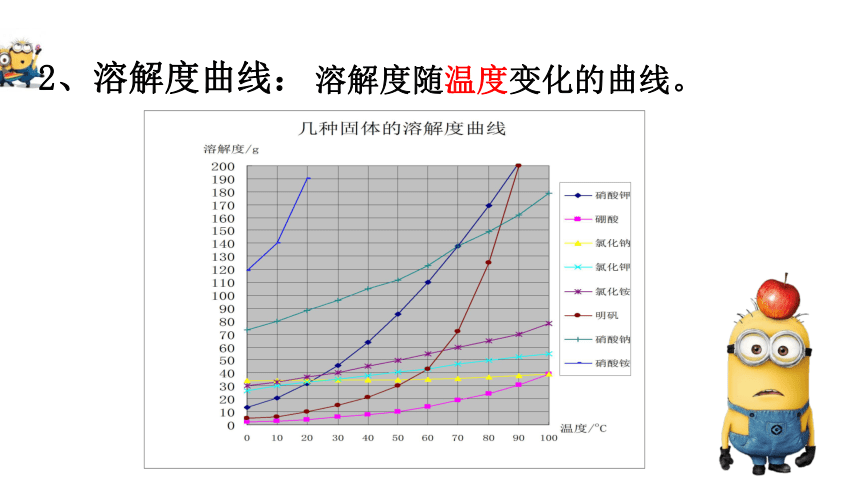
2、溶解度曲线:
溶解度随温度变化的曲线。
二、溶解度曲线的意义和应用
从点、交点、线、面四个角度来分析
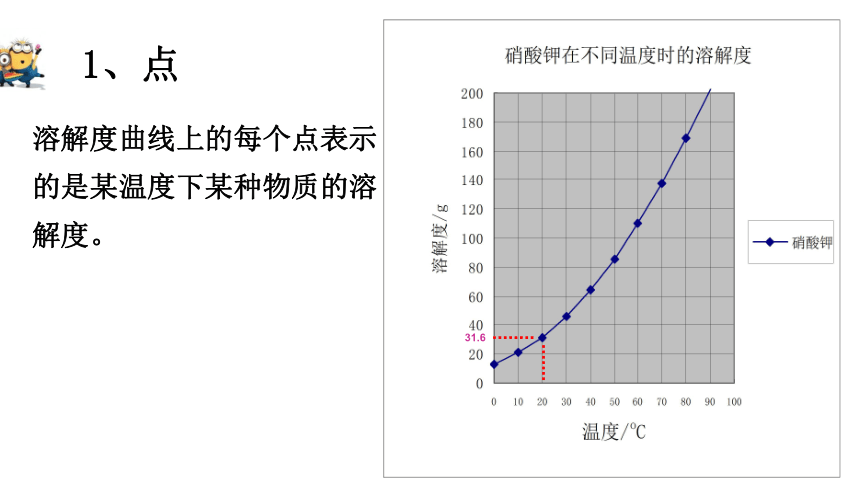
1、点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
31.6
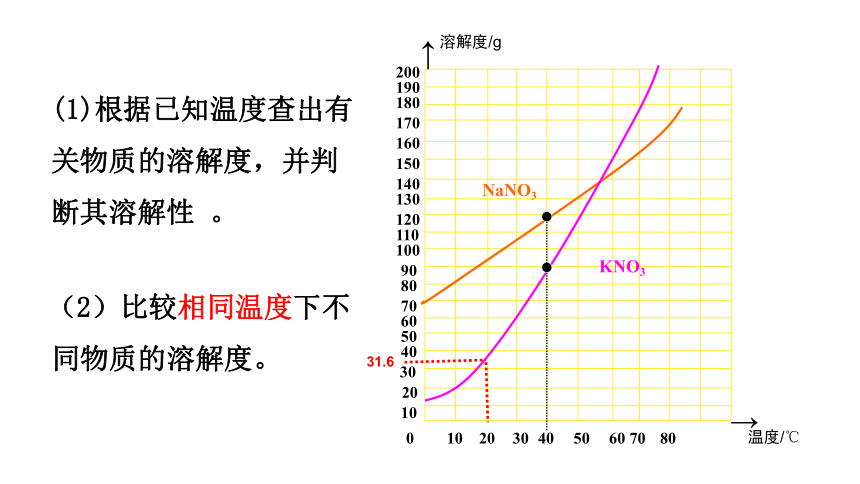
(2)比较相同温度下不同物质的溶解度。
0
10
20
30
40
50
60
70
80
90
100
110
120
130
140
150
160
170
180
190
200
NaNO3
KNO3
10
20
30
40
50
60
70
80
(1)根据已知温度查出有 关物质的溶解度,并判断其溶解性 。
31.6
溶解度/g
温度/℃
↑
→
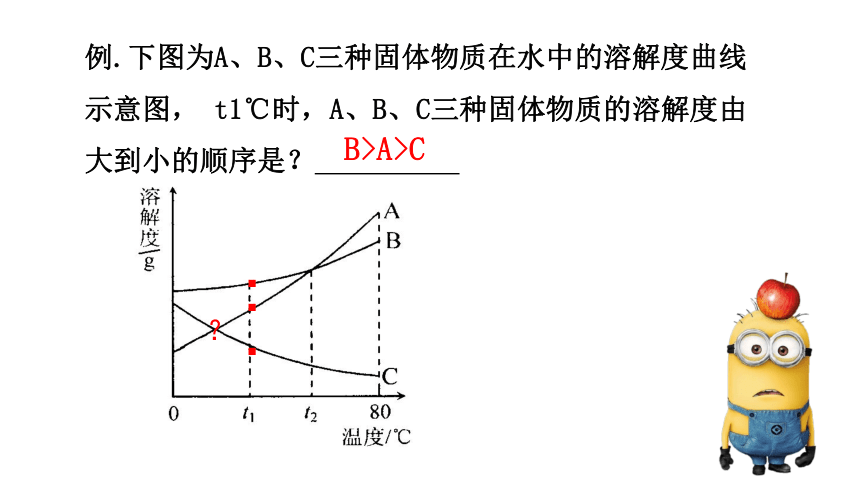
例.下图为A、B、C三种固体物质在水中的溶解度曲线示意图, t1℃时,A、B、C三种固体物质的溶解度由大到小的顺序是?
B>A>C
.
.
.
?
2、交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同。
溶解度/g
温度/℃
0
10
20
30
40
50
60
70
10
20
30
40
50
A
a
b
t2 ℃时,甲和乙的溶解度相同。
P
3、线
溶解度曲线表示某物质在不同温度下的溶解度和溶解度随温度的变化情况。
固体溶解度随温度的变化规律
(1)大部分固体的溶解度随温度的升高而增大。例如,KNO3
溶解度/g
温度/℃
KNO3
NaCl
(2)少数固体的的溶解度随温度的变化不大。例如,NaCl
Ca(OH)2
(3) 极少数固体的溶解度随温度的升高而减小。例如,Ca(OH)2
陡升型
平缓型
下降型
应用:
(1)根据溶解度曲线的走向,可看出物质的溶解度随温度的变化趋势。
溶解度/g
温度/℃
NH4NO3
KNO3
曲线的坡度越大,物质溶解度受温度的影响越大。
曲线的具体应用:
根据溶解度曲线确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
结晶:溶解在溶液中的溶质
从溶液中以晶体形式析出,
这一过程叫做结晶。
结晶的方法:
①冷却热饱和溶液法 (降温结晶法 ):某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,温度降低,溶解度也减小,适合采用此法,如KNO3 。
溶解度/g
温度/℃
KNO3
②蒸发溶剂法 :适用于温度对溶解度影响不大的物质,溶解度曲线“平缓”,如NaCl 。
溶解度/g
温度/℃
NaCl
混合物分离提纯:
如果KNO3中混有少量NaCl,要提纯KNO3,应怎样操作呢?
溶解度/g
温度/℃
KNO3
NaCl
冷却热饱和溶液
(降温结晶 )
思考:如果NaCl中混有少量KNO3,要怎么提纯NaCl?
蒸发结晶
青海湖地区“冬天捞碱,夏天晒盐”的原因是什么?
食盐:主要成分氯化钠,这种物质的溶解度随温度的变化不大,所以,夏天温度高水份蒸发,氯化钠析出。
纯碱:主要成分碳酸钠,这种物质的溶解度随温度的升高而增大,冬天温度低,碳酸钠溶解度减小,水中溶解不了,所以结晶析出。
4、面
曲线上的点表示该温度下该种物质的溶解度,所以此时的溶液恰好饱和。
那么曲线上部面积上的点和下部面积上的点又各自表示什么涵义呢?
溶解度/g
温度/℃
60
0
50
40
30
20
10
70
C
B
A
溶解度/g
温度/℃
A
B
C
0
10
20
30
40
50
60
70
(1)对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液 。
(2)曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且有固体未溶解。
50
练习 :根据右下图的溶解度曲线回答下列问题:
(1)60℃时_____________物质的溶解度最大。
(2)升高温度可使________物质的不饱和溶液变为饱和溶液。
(3)M点表示______________________________。
(4)当A中混有少量B时,可__ _ 法提纯A。
A
C
20 ℃时,物质A和C的溶解度相同
冷却热饱和溶液
课堂练习
题单
课堂小结
固体溶解度的表示方法:
1.列表法 ;
2.作图法-----溶解度曲线。
溶解度曲线的意义和应用
1.主要从点、交点、线、面来讲解。
2.溶解度曲线在结晶和物质提纯中的应用。
九年级化学人教版第九章第二课
《 溶解度的表示方法及应用》
固体溶解度的表示方法及应用
1、如何表示固体溶解度?
在一定温度下,某固态物质在100克溶剂中达到饱和状态时溶解的质量来表示
复 习 回 顾
2、溶解度与溶解性的关系
溶解性
溶解度/g (20℃)
易溶
可溶
微溶
难溶
S>10g
1g
温度/oC 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
硝酸钾在不同温度下的溶解度:
一、固体溶解度的表示方法
1、列表法
作图法:描点 连线
2、溶解度曲线:
溶解度随温度变化的曲线。
二、溶解度曲线的意义和应用
从点、交点、线、面四个角度来分析
1、点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
31.6
(2)比较相同温度下不同物质的溶解度。
0
10
20
30
40
50
60
70
80
90
100
110
120
130
140
150
160
170
180
190
200
NaNO3
KNO3
10
20
30
40
50
60
70
80
(1)根据已知温度查出有 关物质的溶解度,并判断其溶解性 。
31.6
溶解度/g
温度/℃
↑
→
例.下图为A、B、C三种固体物质在水中的溶解度曲线示意图, t1℃时,A、B、C三种固体物质的溶解度由大到小的顺序是?
B>A>C
.
.
.
?
2、交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同。
溶解度/g
温度/℃
0
10
20
30
40
50
60
70
10
20
30
40
50
A
a
b
t2 ℃时,甲和乙的溶解度相同。
P
3、线
溶解度曲线表示某物质在不同温度下的溶解度和溶解度随温度的变化情况。
固体溶解度随温度的变化规律
(1)大部分固体的溶解度随温度的升高而增大。例如,KNO3
溶解度/g
温度/℃
KNO3
NaCl
(2)少数固体的的溶解度随温度的变化不大。例如,NaCl
Ca(OH)2
(3) 极少数固体的溶解度随温度的升高而减小。例如,Ca(OH)2
陡升型
平缓型
下降型
应用:
(1)根据溶解度曲线的走向,可看出物质的溶解度随温度的变化趋势。
溶解度/g
温度/℃
NH4NO3
KNO3
曲线的坡度越大,物质溶解度受温度的影响越大。
曲线的具体应用:
根据溶解度曲线确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
结晶:溶解在溶液中的溶质
从溶液中以晶体形式析出,
这一过程叫做结晶。
结晶的方法:
①冷却热饱和溶液法 (降温结晶法 ):某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,温度降低,溶解度也减小,适合采用此法,如KNO3 。
溶解度/g
温度/℃
KNO3
②蒸发溶剂法 :适用于温度对溶解度影响不大的物质,溶解度曲线“平缓”,如NaCl 。
溶解度/g
温度/℃
NaCl
混合物分离提纯:
如果KNO3中混有少量NaCl,要提纯KNO3,应怎样操作呢?
溶解度/g
温度/℃
KNO3
NaCl
冷却热饱和溶液
(降温结晶 )
思考:如果NaCl中混有少量KNO3,要怎么提纯NaCl?
蒸发结晶
青海湖地区“冬天捞碱,夏天晒盐”的原因是什么?
食盐:主要成分氯化钠,这种物质的溶解度随温度的变化不大,所以,夏天温度高水份蒸发,氯化钠析出。
纯碱:主要成分碳酸钠,这种物质的溶解度随温度的升高而增大,冬天温度低,碳酸钠溶解度减小,水中溶解不了,所以结晶析出。
4、面
曲线上的点表示该温度下该种物质的溶解度,所以此时的溶液恰好饱和。
那么曲线上部面积上的点和下部面积上的点又各自表示什么涵义呢?
溶解度/g
温度/℃
60
0
50
40
30
20
10
70
C
B
A
溶解度/g
温度/℃
A
B
C
0
10
20
30
40
50
60
70
(1)对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液 。
(2)曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且有固体未溶解。
50
练习 :根据右下图的溶解度曲线回答下列问题:
(1)60℃时_____________物质的溶解度最大。
(2)升高温度可使________物质的不饱和溶液变为饱和溶液。
(3)M点表示______________________________。
(4)当A中混有少量B时,可__ _ 法提纯A。
A
C
20 ℃时,物质A和C的溶解度相同
冷却热饱和溶液
课堂练习
题单
课堂小结
固体溶解度的表示方法:
1.列表法 ;
2.作图法-----溶解度曲线。
溶解度曲线的意义和应用
1.主要从点、交点、线、面来讲解。
2.溶解度曲线在结晶和物质提纯中的应用。
同课章节目录
