课题2 溶解度 课件(22张PPT)
图片预览





文档简介
(共22张PPT)
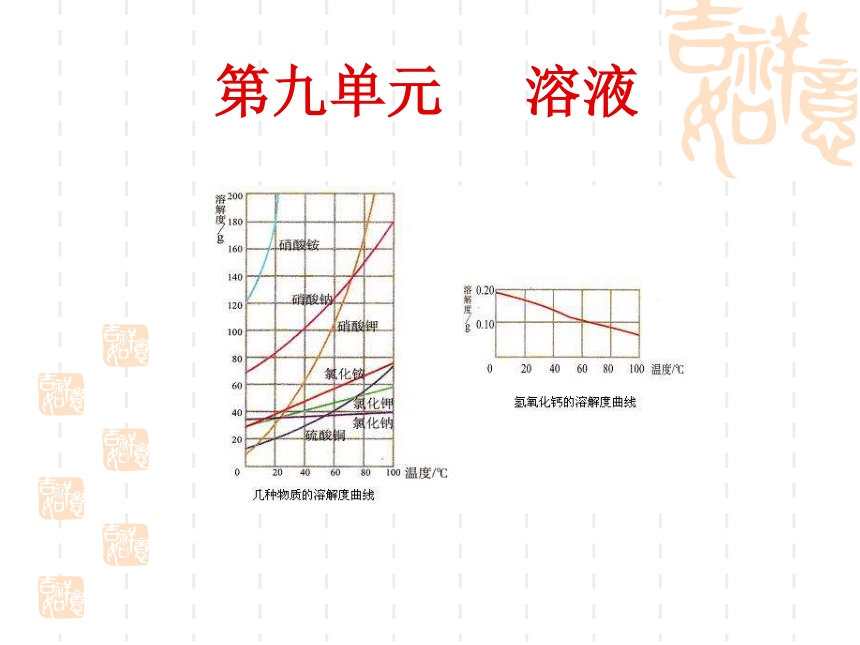
第九单元 溶液
同学们猜一下:下列溶液可能是哪些物质的溶液?
关于溶液,我们需要了解和掌握哪些知识呢?
Cu2+
Fe2+
Fe3+
复习目标:
1.掌握溶液的形成、乳化及物质溶解时的放热和吸热现象;
2.理解饱和溶液与不饱和溶液的概念,掌握它们的区分方法及转化方法;
3. 熟练运用溶解度曲线答题;
4.掌握溶质质量分数的简单计算;熟练掌握化学反应过程中溶质质量分数的计算方法;
5.认识配制溶液的一般步骤;掌握配制溶液过程中误差分析的方法。
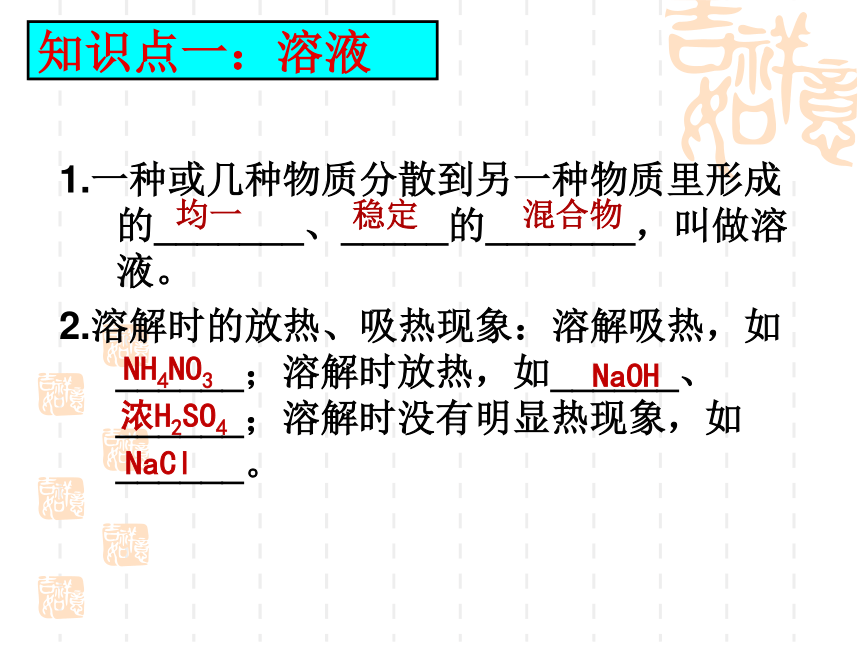
知识点一:溶液
1.一种或几种物质分散到另一种物质里形成的_______、_____的_______,叫做溶液。
2.溶解时的放热、吸热现象:溶解吸热,如______;溶解时放热,如______、______;溶解时没有明显热现象,如______。
均一
稳定
混合物
NH4NO3
NaOH
浓H2SO4
NaCl
【典例1】 (2018,山东潍坊)下列物质不属于溶液的是( )
A.碘酒 B.矿泉水 C.白醋 D.蒸馏水
【典例2】(2018,四川绵阳)阳刚同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以从集镇上购买一种商品来产生制冷效果,他应该购买的是( )
A.硝酸铵 B.小苏打 C.生石灰 D.食盐
D
A
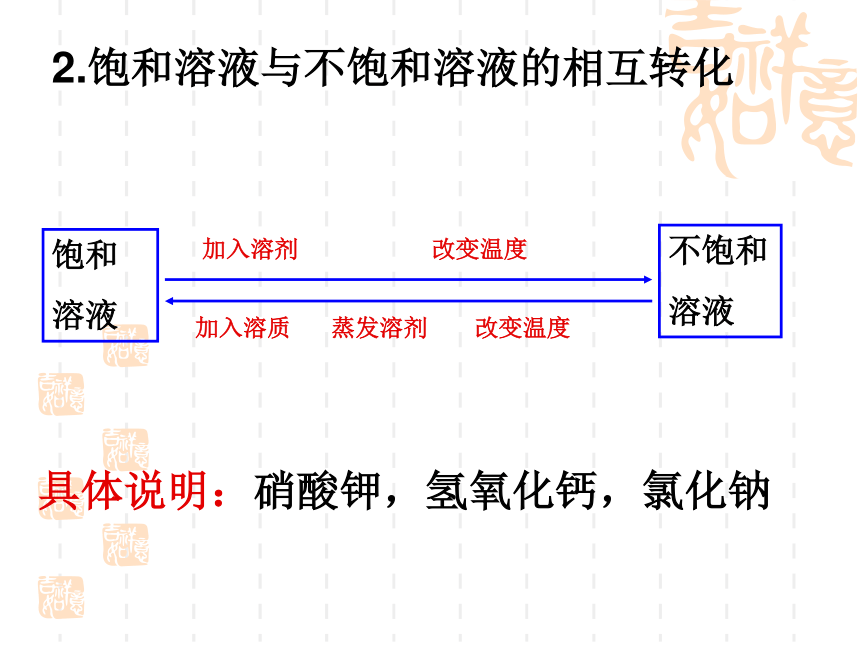
知识点二:饱和溶液与不饱和溶液:
1.概念:
在 下,在 里,不能再溶解某种溶质的溶液,叫该溶质 的饱和溶液。还能继续溶解某种溶质的溶液,叫该溶质的不饱和溶液。
一定温度
一定量的溶剂
2.饱和溶液与不饱和溶液的相互转化
饱和
溶液
不饱和
溶液
改变温度
加入溶质
加入溶剂
改变温度
蒸发溶剂
具体说明:硝酸钾,氢氧化钙,氯化钠
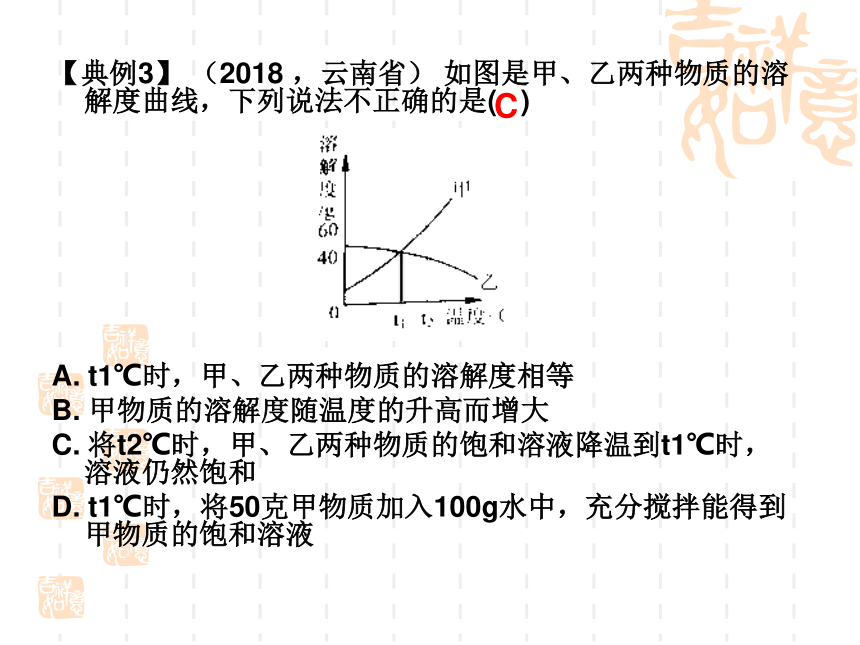
【典例3】 (2018 ,云南省) 如图是甲、乙两种物质的溶解度曲线,下列说法不正确的是( )
A. t1℃时,甲、乙两种物质的溶解度相等
B. 甲物质的溶解度随温度的升高而增大
C. 将t2℃时,甲、乙两种物质的饱和溶液降温到t1℃时,溶液仍然饱和
D. t1℃时,将50克甲物质加入100g水中,充分搅拌能得到甲物质的饱和溶液
C
知识点三:固体物质的溶解度
1.概念:在 下,某固态物质在 g溶剂(通常溶剂为水)里达到 时所溶解的质量。
一定温度
饱和状态
100
(1)前提:一定温度
(2)标准:100克溶剂
(3)状态:饱和状态
(4)单位:克
2.固体溶解度的影响因素
溶质的种类、溶剂的种类、温度
内因
外因
内因
气体的溶解度主要受哪两个因素的影响?是怎样影响的?
⑴对于物质A,点a的含义是: 。
t1℃时A物质的溶解度为40g
⑵点d的含义是:
。
t℃时A物质和C物质的溶解度相等
⑶ t1℃时三种物质的溶解度由大到小的顺序是: 。
C B A
【典例4】已知ABC三种物质的溶解度曲线,请回答:
3、溶解度曲线
⑷t2℃时,等质量三种物质的饱和溶液所含溶质的质量由小到大的顺序为: 。
C B A
⑹若A溶液中含有少量B物质,提取A的方法是: 。
降温结晶
⑺若B溶液中含有少量A物质,提取B的方法是: 。
蒸发结晶
⑻将t2℃时等质量的三种物质的饱和溶液降温至t1℃,析出晶体最多的是 ,没有晶体析出的是 。
A
C
⑸将t1℃140g A的饱和溶液
升温至t2℃时,可用图上
的 点表示,此时溶液
是 状态,然后再加入A物质
40g,可用曲线上的 点表示。
b
不饱和
c
别放松!
精彩继续· · · · ·
精彩继续· · · · ·
⑽t2℃时,将180gA的饱和溶液冷却至t1℃,析出晶体的质量为: 。
⑼t1℃时,将25g固体A溶于50g水中,所得溶液的质量为 。
70g
40g
⑿使接近饱和的A、B、C溶液达
到饱和,均可采用的方法是 ,对C还可采用的方法为 。
⒀向100gt1℃的水中加入45gA固体,发现全部溶解,一段时间后又有部分A的
晶体析出。你认为“全部溶解”的原因可能
是 。
加溶质、蒸发溶剂
升温
A固体溶于水时放热
知识点四:溶质的质量分数
1.概念:溶质质量分数= ___________
2.饱和溶液中:溶质质量分数= ____________
3.关于溶液稀释的计算,关键是根据“稀释前后,____的质量不变“解题。
×100%
×100%
溶质
【典例5】 (2018,海南省)在农业生产上,常用质量分数为16%的氯化钠溶液选种,现要配制该氯化钠溶液100kg,需要氯化钠固体和水的质量各是多少?
【典例6】实验室新进37%的浓盐酸,要把5 g该浓盐酸稀释为5%的稀盐酸,需要水______克。
知识点五:化学反应中溶质的质量分数的计算
【典例7】 (2018,云南省)请回答并完成下列计算。
(1) 实验室要配制50克溶质质量分数为8%的氢氧化钠溶液,需称取 g氢氧化钠固体。
(2) 像上述配制好的溶液中加入50克稀硫酸,恰好完全反应,求反应后所得溶液中溶质的质量分数。
(反应的化学方程式 2NaOH+H2SO4= Na2SO4+2H2O) 相对分子质量NaOH-40 H2SO4-98 Na2SO4-142
题意分析:
(1)可以运用的是哪一种纯净物的质量?
(2)恰好反应后,溶液中的溶质是什么?如何计算它的质量?
(3)反应后所得溶液的质量如何计算?
1. 在溶液中进行的反应,实际反应的是溶质!带入计算的量应为溶质的质量!
求反应后所得溶液的溶质质量分数时,计算反应后的溶液质量时,一般根据质量守恒定律进行计算比较简单。
M剩余溶液=M加入的所有物质质量总和-M气体-M沉淀
化学方程式与溶质质量分数相结合的简单计算
注意要点:
知识点六:配制一定溶质质量分数的溶液
【典例8】 (2018,四川自贡) 某同学配制50g9%化的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 填序号),其中操作错误的是 (填序号)
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氧化钠 g。
(3)量水时选用的量筒的量程最合适的是 (填字母),读数时视线要与量筒内 保持水平。
A.10mL B.25mL C.50mL D.100mL
②①⑤③④
①
广口瓶
4.5
C
凹液面最低处
【典例9】(2018,河南省)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作不会导致结果偏小的是
( )
A.用量筒量取水时仰视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯
D.转移已配好的溶液时,有少量溶液溅出
D
知识点1:溶液的定义及应用
知识点2:饱和溶液的定义以及饱和溶液与不饱和溶液
知识点3:溶解度曲线上相应点的应用
知识点4:物理变化中溶质的质量分数的计算
知识点5:化学反应中溶质的质量分数的计算找出方程式-找出纯净物的质量-求反应后溶液的质量
谢谢大家
第九单元 溶液
同学们猜一下:下列溶液可能是哪些物质的溶液?
关于溶液,我们需要了解和掌握哪些知识呢?
Cu2+
Fe2+
Fe3+
复习目标:
1.掌握溶液的形成、乳化及物质溶解时的放热和吸热现象;
2.理解饱和溶液与不饱和溶液的概念,掌握它们的区分方法及转化方法;
3. 熟练运用溶解度曲线答题;
4.掌握溶质质量分数的简单计算;熟练掌握化学反应过程中溶质质量分数的计算方法;
5.认识配制溶液的一般步骤;掌握配制溶液过程中误差分析的方法。
知识点一:溶液
1.一种或几种物质分散到另一种物质里形成的_______、_____的_______,叫做溶液。
2.溶解时的放热、吸热现象:溶解吸热,如______;溶解时放热,如______、______;溶解时没有明显热现象,如______。
均一
稳定
混合物
NH4NO3
NaOH
浓H2SO4
NaCl
【典例1】 (2018,山东潍坊)下列物质不属于溶液的是( )
A.碘酒 B.矿泉水 C.白醋 D.蒸馏水
【典例2】(2018,四川绵阳)阳刚同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以从集镇上购买一种商品来产生制冷效果,他应该购买的是( )
A.硝酸铵 B.小苏打 C.生石灰 D.食盐
D
A
知识点二:饱和溶液与不饱和溶液:
1.概念:
在 下,在 里,不能再溶解某种溶质的溶液,叫该溶质 的饱和溶液。还能继续溶解某种溶质的溶液,叫该溶质的不饱和溶液。
一定温度
一定量的溶剂
2.饱和溶液与不饱和溶液的相互转化
饱和
溶液
不饱和
溶液
改变温度
加入溶质
加入溶剂
改变温度
蒸发溶剂
具体说明:硝酸钾,氢氧化钙,氯化钠
【典例3】 (2018 ,云南省) 如图是甲、乙两种物质的溶解度曲线,下列说法不正确的是( )
A. t1℃时,甲、乙两种物质的溶解度相等
B. 甲物质的溶解度随温度的升高而增大
C. 将t2℃时,甲、乙两种物质的饱和溶液降温到t1℃时,溶液仍然饱和
D. t1℃时,将50克甲物质加入100g水中,充分搅拌能得到甲物质的饱和溶液
C
知识点三:固体物质的溶解度
1.概念:在 下,某固态物质在 g溶剂(通常溶剂为水)里达到 时所溶解的质量。
一定温度
饱和状态
100
(1)前提:一定温度
(2)标准:100克溶剂
(3)状态:饱和状态
(4)单位:克
2.固体溶解度的影响因素
溶质的种类、溶剂的种类、温度
内因
外因
内因
气体的溶解度主要受哪两个因素的影响?是怎样影响的?
⑴对于物质A,点a的含义是: 。
t1℃时A物质的溶解度为40g
⑵点d的含义是:
。
t℃时A物质和C物质的溶解度相等
⑶ t1℃时三种物质的溶解度由大到小的顺序是: 。
C B A
【典例4】已知ABC三种物质的溶解度曲线,请回答:
3、溶解度曲线
⑷t2℃时,等质量三种物质的饱和溶液所含溶质的质量由小到大的顺序为: 。
C B A
⑹若A溶液中含有少量B物质,提取A的方法是: 。
降温结晶
⑺若B溶液中含有少量A物质,提取B的方法是: 。
蒸发结晶
⑻将t2℃时等质量的三种物质的饱和溶液降温至t1℃,析出晶体最多的是 ,没有晶体析出的是 。
A
C
⑸将t1℃140g A的饱和溶液
升温至t2℃时,可用图上
的 点表示,此时溶液
是 状态,然后再加入A物质
40g,可用曲线上的 点表示。
b
不饱和
c
别放松!
精彩继续· · · · ·
精彩继续· · · · ·
⑽t2℃时,将180gA的饱和溶液冷却至t1℃,析出晶体的质量为: 。
⑼t1℃时,将25g固体A溶于50g水中,所得溶液的质量为 。
70g
40g
⑿使接近饱和的A、B、C溶液达
到饱和,均可采用的方法是 ,对C还可采用的方法为 。
⒀向100gt1℃的水中加入45gA固体,发现全部溶解,一段时间后又有部分A的
晶体析出。你认为“全部溶解”的原因可能
是 。
加溶质、蒸发溶剂
升温
A固体溶于水时放热
知识点四:溶质的质量分数
1.概念:溶质质量分数= ___________
2.饱和溶液中:溶质质量分数= ____________
3.关于溶液稀释的计算,关键是根据“稀释前后,____的质量不变“解题。
×100%
×100%
溶质
【典例5】 (2018,海南省)在农业生产上,常用质量分数为16%的氯化钠溶液选种,现要配制该氯化钠溶液100kg,需要氯化钠固体和水的质量各是多少?
【典例6】实验室新进37%的浓盐酸,要把5 g该浓盐酸稀释为5%的稀盐酸,需要水______克。
知识点五:化学反应中溶质的质量分数的计算
【典例7】 (2018,云南省)请回答并完成下列计算。
(1) 实验室要配制50克溶质质量分数为8%的氢氧化钠溶液,需称取 g氢氧化钠固体。
(2) 像上述配制好的溶液中加入50克稀硫酸,恰好完全反应,求反应后所得溶液中溶质的质量分数。
(反应的化学方程式 2NaOH+H2SO4= Na2SO4+2H2O) 相对分子质量NaOH-40 H2SO4-98 Na2SO4-142
题意分析:
(1)可以运用的是哪一种纯净物的质量?
(2)恰好反应后,溶液中的溶质是什么?如何计算它的质量?
(3)反应后所得溶液的质量如何计算?
1. 在溶液中进行的反应,实际反应的是溶质!带入计算的量应为溶质的质量!
求反应后所得溶液的溶质质量分数时,计算反应后的溶液质量时,一般根据质量守恒定律进行计算比较简单。
M剩余溶液=M加入的所有物质质量总和-M气体-M沉淀
化学方程式与溶质质量分数相结合的简单计算
注意要点:
知识点六:配制一定溶质质量分数的溶液
【典例8】 (2018,四川自贡) 某同学配制50g9%化的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 填序号),其中操作错误的是 (填序号)
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氧化钠 g。
(3)量水时选用的量筒的量程最合适的是 (填字母),读数时视线要与量筒内 保持水平。
A.10mL B.25mL C.50mL D.100mL
②①⑤③④
①
广口瓶
4.5
C
凹液面最低处
【典例9】(2018,河南省)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作不会导致结果偏小的是
( )
A.用量筒量取水时仰视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯
D.转移已配好的溶液时,有少量溶液溅出
D
知识点1:溶液的定义及应用
知识点2:饱和溶液的定义以及饱和溶液与不饱和溶液
知识点3:溶解度曲线上相应点的应用
知识点4:物理变化中溶质的质量分数的计算
知识点5:化学反应中溶质的质量分数的计算找出方程式-找出纯净物的质量-求反应后溶液的质量
谢谢大家
同课章节目录
