人教版(2019)高一化学必修第二册 第六章 第一节 化学反应与能量变化 化学反应与电能 课件(共34张ppt)
文档属性
| 名称 | 人教版(2019)高一化学必修第二册 第六章 第一节 化学反应与能量变化 化学反应与电能 课件(共34张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 00:00:00 | ||
图片预览







文档简介
(共34张PPT)
第六章
第一节 化学反应与能量变化之
化学反应与电能
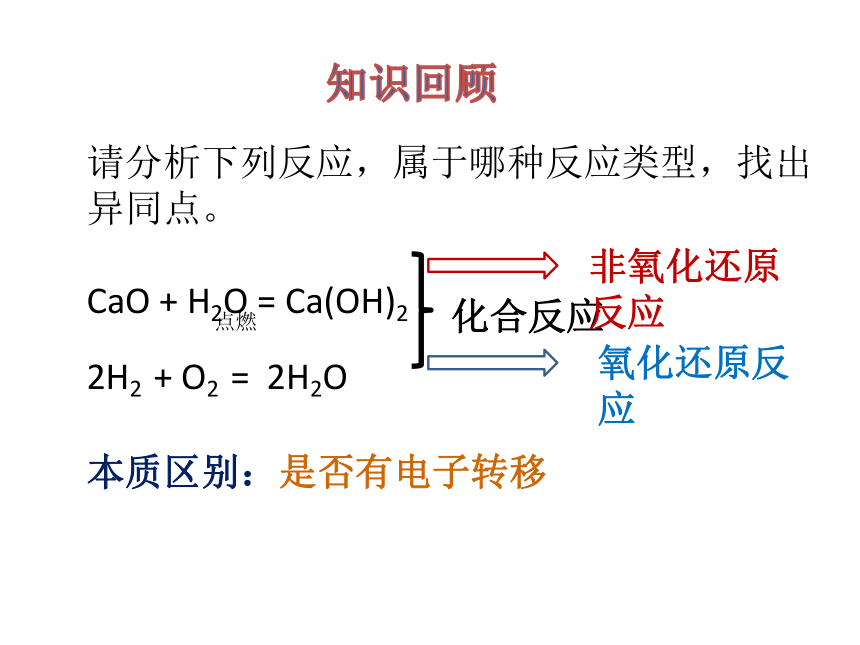
请分析下列反应,属于哪种反应类型,找出异同点。
CaO + H2O = Ca(OH)2
2H2 + O2 = 2H2O
点燃
非氧化还原反应
氧化还原反应
本质区别:是否有电子转移
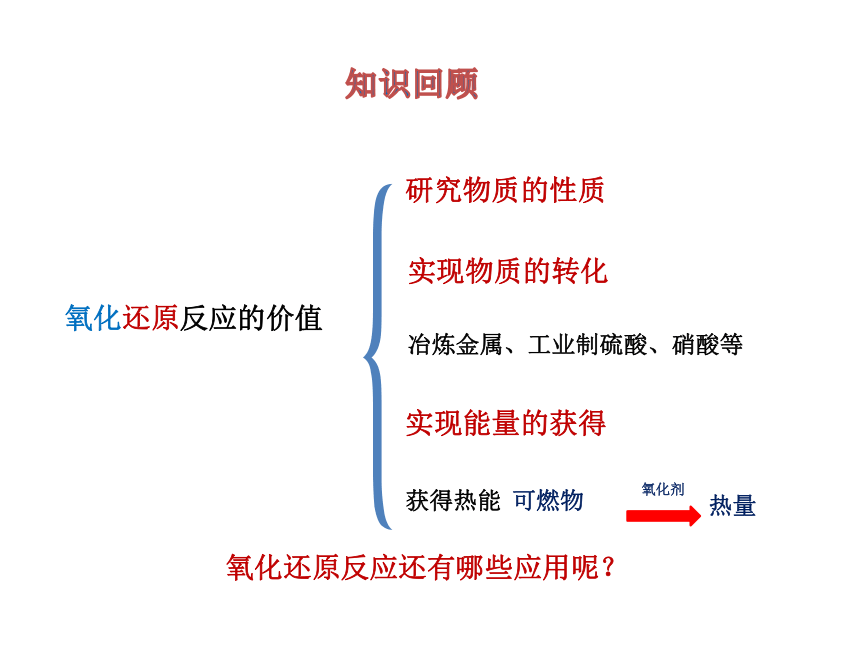
氧化还原反应的价值
研究物质的性质
实现物质的转化
实现能量的获得
冶炼金属、工业制硫酸、硝酸等
氧化还原反应还有哪些应用呢?
Zn + H2SO4 = ZnSO4 + H2
2e-
如何才能让锌与稀硫酸的反应,实现电子的定向移动呢?
笔记本电脑电池
手机锂电池
铅蓄电池
新能源汽车电池
科学史话
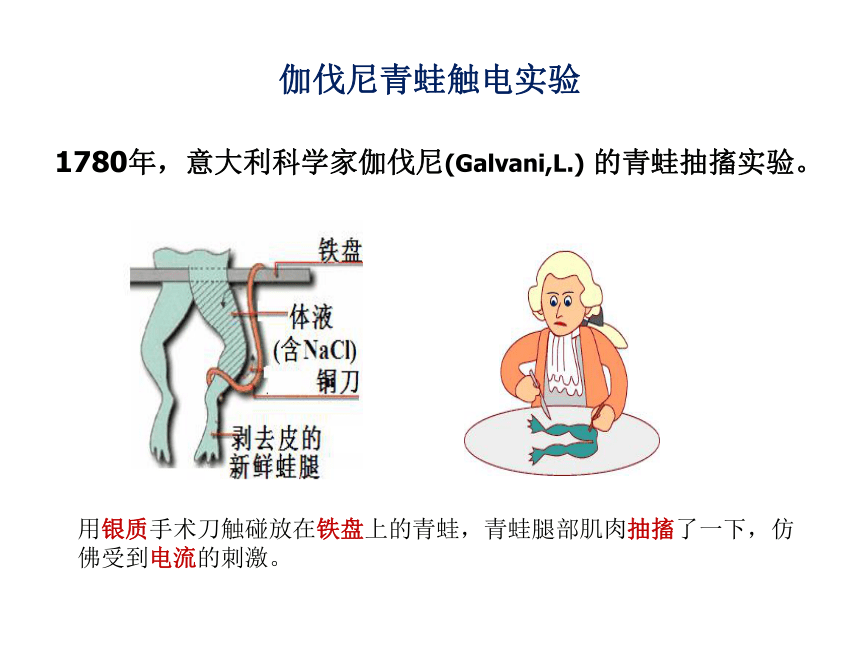
1780年,意大利科学家伽伐尼(Galvani,L.) 的青蛙抽搐实验。
伽伐尼青蛙触电实验
用银质手术刀触碰放在铁盘上的青蛙,青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。
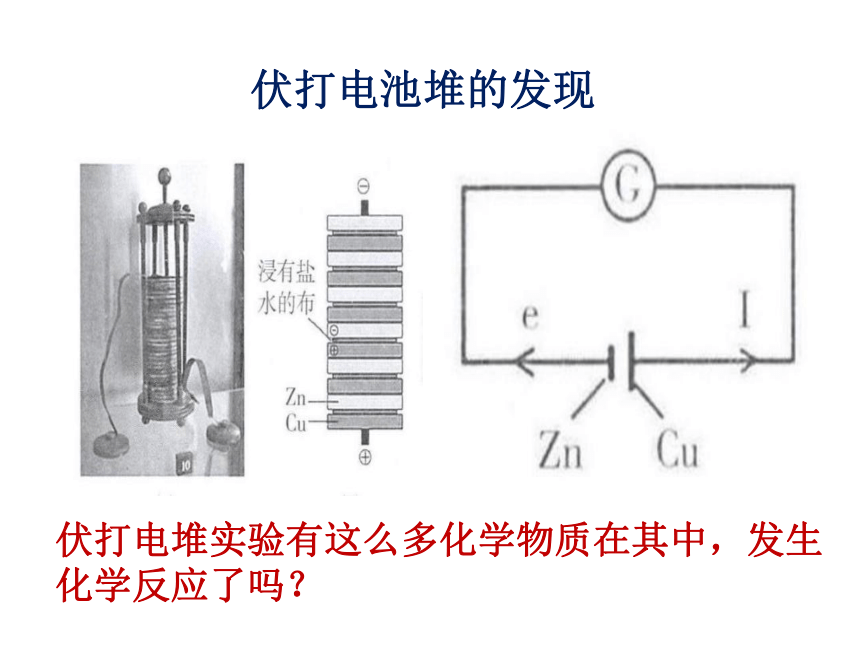
伏打电池堆的发现
1800年,意大利物理学家伏特用锌片和铜片夹以盐水浸润的纸片叠成电池堆。
伏打电池堆的发现
伏打电堆实验有这么多化学物质在其中,发生化学反应了吗?
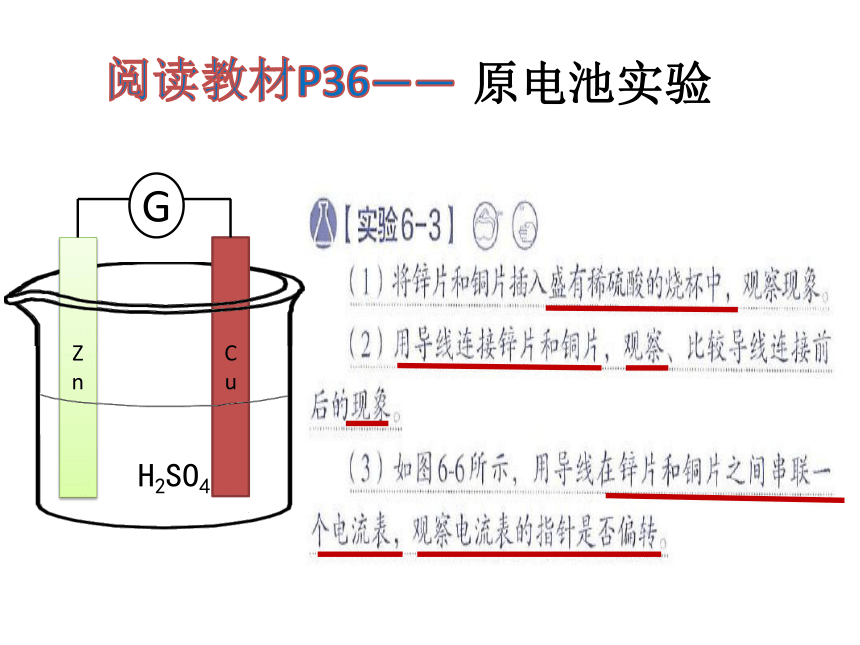
原电池实验
实验现象
铜片上有气体产生,电流表指针偏转
1.本实验发生化学变化了吗?推测铜片表面产生的是什么气体?
2.氢气是溶液中什么微粒产生的?H+变成H2发生了怎样的变化?
3.根据产生了电流,即电子的定向移动,推测给氢离子的电子是哪方提供的?
4.锌和氢离子分别发生哪一种类型的化学反应?
铜片表面产生的是氢气
锌失去电子给氢离子
锌发生失电子的反应,氢离子发生得电子的反应
电子的定向移动(电流)——
有得失电子的反应
小结
要有俩个电极,两电极能传输电子,有能传导离子的电解质溶液,有得电子、失电子的电极反应物。
是关于我们怎样做事的知识,即经验型信息,如技术、技巧、工艺、方法等。
俩电极可以是活性不同的金属片
俩电极可以是活泼金属与碳棒
电池的正负极分别是什么?判断依据是什么?
04
铜片起什么作用呢?
03
为什么溶液中的氢离子会在铜片表面得到电子?
02
什么情况下铜片表面才会有氢气生成?
01
有氢离子在铜片得到电子
锌片失去电子通过导线转移到铜片上
溶液中的氢离子移到铜片一极
铜片是传输电子的,做导体
电子流出的一极为负极,电子流入一极为正极
剖析原理
2H+ + 2e- —> H2↑
e-
e-
e-
Zn – 2e- —> Zn2+
负极
正极
Zn + 2H+ = Zn2+ + H2↑
?
下列关于原电池的叙述中正确的是 ( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和稀硫酸构成的原电池工作时,锌片上有6.5 g锌
溶解,正极上就有0.1 g氢气生成
B
Zn + 2H+ = Zn2+ + H2↑
65g 2g
6.5g 0.2g
?
抽提模型
正极
负极
e-
失去电子
氧化反应
得到电子
还原反应
电解质溶液
阳离子
阴离子
氧化还原反应
原电池的通用模型
寻找清洁、环保型电池——燃料电池
模型应用
2H2 + O2 = 2H2O
总结提升
Zn - 2e- = Zn2+
氧化反应
2H+ + 2e- = H2
还原反应
H2SO4溶液
还原剂升价,失电子发生氧化反应
氧化剂降价,得电子发生还原反应
化学能
热能
机械能
电能
燃料燃烧
蒸汽轮机
发电机
传统的大型火力发电的能量利用率为40%
燃料电池的能量利用率可达到80%
下列哪些化学反应可以设计成原电池?
A. Na2CO3 + 2HCl = CO2 + H2O + 2NaCl
B.Zn + CuSO4 = Cu + ZnSO4
C.CH4 + 2O2 = CO2 + 2H2O
D.2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
点燃
第六章
第一节 化学反应与能量变化之
化学反应与电能
请分析下列反应,属于哪种反应类型,找出异同点。
CaO + H2O = Ca(OH)2
2H2 + O2 = 2H2O
点燃
非氧化还原反应
氧化还原反应
本质区别:是否有电子转移
氧化还原反应的价值
研究物质的性质
实现物质的转化
实现能量的获得
冶炼金属、工业制硫酸、硝酸等
氧化还原反应还有哪些应用呢?
Zn + H2SO4 = ZnSO4 + H2
2e-
如何才能让锌与稀硫酸的反应,实现电子的定向移动呢?
笔记本电脑电池
手机锂电池
铅蓄电池
新能源汽车电池
科学史话
1780年,意大利科学家伽伐尼(Galvani,L.) 的青蛙抽搐实验。
伽伐尼青蛙触电实验
用银质手术刀触碰放在铁盘上的青蛙,青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。
伏打电池堆的发现
1800年,意大利物理学家伏特用锌片和铜片夹以盐水浸润的纸片叠成电池堆。
伏打电池堆的发现
伏打电堆实验有这么多化学物质在其中,发生化学反应了吗?
原电池实验
实验现象
铜片上有气体产生,电流表指针偏转
1.本实验发生化学变化了吗?推测铜片表面产生的是什么气体?
2.氢气是溶液中什么微粒产生的?H+变成H2发生了怎样的变化?
3.根据产生了电流,即电子的定向移动,推测给氢离子的电子是哪方提供的?
4.锌和氢离子分别发生哪一种类型的化学反应?
铜片表面产生的是氢气
锌失去电子给氢离子
锌发生失电子的反应,氢离子发生得电子的反应
电子的定向移动(电流)——
有得失电子的反应
小结
要有俩个电极,两电极能传输电子,有能传导离子的电解质溶液,有得电子、失电子的电极反应物。
是关于我们怎样做事的知识,即经验型信息,如技术、技巧、工艺、方法等。
俩电极可以是活性不同的金属片
俩电极可以是活泼金属与碳棒
电池的正负极分别是什么?判断依据是什么?
04
铜片起什么作用呢?
03
为什么溶液中的氢离子会在铜片表面得到电子?
02
什么情况下铜片表面才会有氢气生成?
01
有氢离子在铜片得到电子
锌片失去电子通过导线转移到铜片上
溶液中的氢离子移到铜片一极
铜片是传输电子的,做导体
电子流出的一极为负极,电子流入一极为正极
剖析原理
2H+ + 2e- —> H2↑
e-
e-
e-
Zn – 2e- —> Zn2+
负极
正极
Zn + 2H+ = Zn2+ + H2↑
?
下列关于原电池的叙述中正确的是 ( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和稀硫酸构成的原电池工作时,锌片上有6.5 g锌
溶解,正极上就有0.1 g氢气生成
B
Zn + 2H+ = Zn2+ + H2↑
65g 2g
6.5g 0.2g
?
抽提模型
正极
负极
e-
失去电子
氧化反应
得到电子
还原反应
电解质溶液
阳离子
阴离子
氧化还原反应
原电池的通用模型
寻找清洁、环保型电池——燃料电池
模型应用
2H2 + O2 = 2H2O
总结提升
Zn - 2e- = Zn2+
氧化反应
2H+ + 2e- = H2
还原反应
H2SO4溶液
还原剂升价,失电子发生氧化反应
氧化剂降价,得电子发生还原反应
化学能
热能
机械能
电能
燃料燃烧
蒸汽轮机
发电机
传统的大型火力发电的能量利用率为40%
燃料电池的能量利用率可达到80%
下列哪些化学反应可以设计成原电池?
A. Na2CO3 + 2HCl = CO2 + H2O + 2NaCl
B.Zn + CuSO4 = Cu + ZnSO4
C.CH4 + 2O2 = CO2 + 2H2O
D.2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
点燃
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
