鲁教版九年级上册化学第三节 氧气课件(共26张PPT)
文档属性
| 名称 | 鲁教版九年级上册化学第三节 氧气课件(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 15:18:52 | ||
图片预览








文档简介
(共26张PPT)
第三节 氧气
——氧气的性质
猜谜语
一物质真奇妙,
虽说不燃烧,
燃烧离不了,
登高潜水都需要,
急救病人有功劳,
植物制造它,没它活不了。
氧气
燃料燃烧
动植物呼吸
铁生锈
★●●
学习目标:
1、通过实验探究,认识氧气的性质。
2、能从微观角度分析化学反应现象的不同。
3、了解自然界中氧的循环,感悟氧循环对人类的重要意义。
氧气的物理性质
1. 色、味、态:
2. 密度:
3.溶解性:
4. 沸、熔点:
无色、无味的气体。
比空气密度略大。
不易溶于水,1L水只能溶解30ml氧气。
无色气体
淡蓝色液体
淡蓝色固体
-183℃
-218℃
氧气贮存在天蓝色钢瓶中
氧气的化学性质
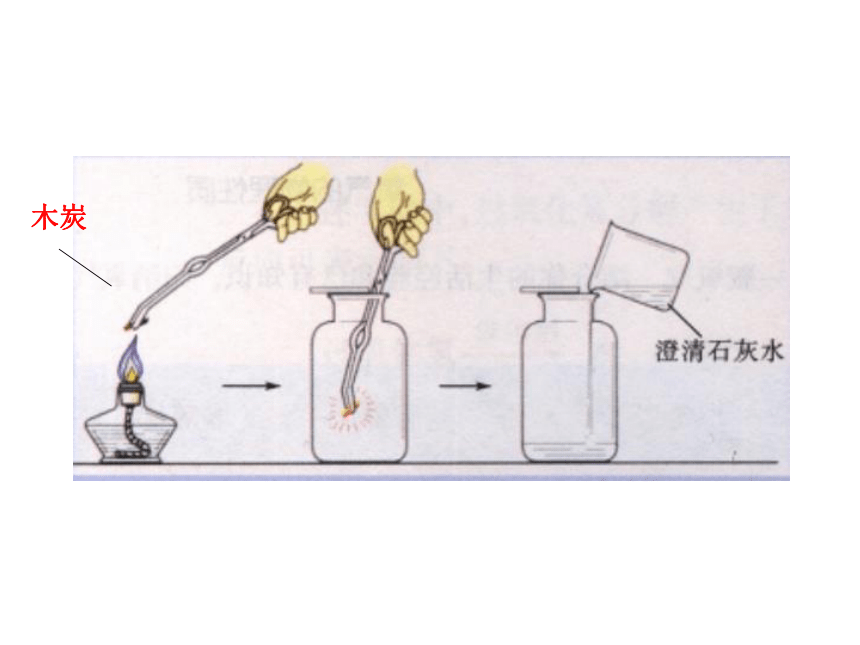
实验一:用坩埚钳夹持木炭,加热,点燃,观察现象;将木炭由上往下慢慢放入氧气中,观察现象;倒入澄清石灰水,稍振荡,观察现象.
实验二:用坩埚钳夹住铁丝,点燃火柴梗,待火柴梗燃烧接近结束时,将铁丝由上往下慢慢伸入集气瓶中(底部留水),观察现象和最后产物
实验三:点燃蜡烛,观察蜡烛在空气中燃烧现象,将蜡烛由上往下慢慢伸入集气瓶中,观察蜡烛在氧气中燃烧现象(注意观察瓶壁);倒入澄清石灰水,稍振荡,观察现象
木炭
铁丝
蜡烛
·木炭在空气中燃烧和在氧气中燃烧剧烈程度明显不同,原因是什么?你能否从微观角度试着解释?
观察与思考
分子之间欲发生反应,其首要条件是分子之间接触碰撞。在空气中,含量较多的是氮气,氧气分子含量相对较少,木炭与氧分子碰撞机会少,而在纯氧气中则大大增加了碰撞机会。
氧气浓度不同
思考与讨论:
1.为什么要将铁丝在火柴梗上绕成螺旋状
增大与氧气的接触面积
2.为什么火柴梗即将燃尽时才伸入集气瓶中?
防止火柴燃烧消耗过多氧气
3.为什么瓶中要加入少量的水或铺一层沙?
防止熔化的生成物溅落下来,炸裂
瓶底。
明察秋毫
1、观察生成物,指出物质在组成上有何相似之处?2、观察下列反应,指出这些反应有何相同之处?
碳 + 氧气 二氧化碳(CO2)
点燃
铁 + 氧气 氧化三铁(Fe3O4)
点燃
石蜡 + 氧气 二氧化碳 + 水(H2O)
点燃
1、有两种元素组成的化合物,如果其中一种元素是氧,这样的化合物叫做氧化物。
2、这些有氧气参加的化学反应属于
氧化反应。
总结:
★●●
物质与氧气发生的化学反应,属于氧化反应。
注意:有的没有氧气参加的化学反应
也属于氧化反应。
例:H2+CuO Cu+H20
氧化反应不是基本反应类型。
加热
判断:氧化反应都是化合反应( )
举例说明:
石蜡+氧气
二氧化碳+水
点燃
×
在自然界中,许多物质都能与氧气反应消耗氧气,那么空气中的氧气是否会因此而减少呢?为什么?
不会,自然界中的氧气含量相 对恒定.
1、取A、B两个密闭的玻璃钟罩,在A、B钟罩中如图分别放入植物和蜡烛,然后将两个钟罩放在阳光充足的地方。
2、观察到的现象:
。
A
B
3、实验结论: 。
A钟罩中蜡烛一会儿就熄灭,B中很长时间才熄灭
绿色植物光合作用产生氧气
在大自然中,消耗氧气的途径主要有哪些?产生氧气的途径主要是什么?
自然界中的氧循环
物质燃烧
生物呼吸
食物腐烂
……
O2
CO2
植物
光合作用
剧烈氧化反应
缓慢氧化反应
对照学习目标,看看今天的学习任务有没有完成?
你有什么收获、什么感受愿意和大家分享?
O2的性质
物理性质
化学性质
色、味、态
密度
水溶性
三态变化
C+O2 CO2
点燃
Fe+O2 Fe3O4
点燃
石蜡+O2 CO2+H2O
点燃
氧化反应
自然界中的氧循环
氧气的产生途径
氧气的消耗途径
1、
2、
氧气是我们身边常见的物质,以下有关氧气的叙述不正确的是 ( )
A.氧气具有可燃性
B.氧气能提供动植物呼吸
C.氧气能支持燃烧
D.某些物质在空气中不能燃烧,但在氧气中能燃烧
A
2.细铁丝在氧气中燃烧时的反应现象是 ( )
A. 产生光彩夺目的火焰,生成黑色固体
B.剧烈燃烧,火星四射,生成黑色固体
C.铁丝红热,熔化
D.产生蓝色火焰,生成黑色固体
B
3、下列物质属于氧化物的是( )
A O2 B SiO2 C NaOH D H2SO4
B
4、下列不属于氧气在大自然中的消耗途径的是( )
A、生物的呼吸 B、緑色植物的光合作用
C、物质在空气中的燃烧 D、物质在空气中的缓慢氧化
B
拓展延伸:下列反应不是属于氧化反应的是( )
A、碳 + 氧气 二氧化碳
B、镁 + 氧气 氧化镁
C、氢气 + 氧化铜 铜+水
D、碳酸钙 氧化钙+二氧化钙
点燃
点燃
加热
高温
D
作业:
课后挑战自我1—6题
第三节 氧气
——氧气的性质
猜谜语
一物质真奇妙,
虽说不燃烧,
燃烧离不了,
登高潜水都需要,
急救病人有功劳,
植物制造它,没它活不了。
氧气
燃料燃烧
动植物呼吸
铁生锈
★●●
学习目标:
1、通过实验探究,认识氧气的性质。
2、能从微观角度分析化学反应现象的不同。
3、了解自然界中氧的循环,感悟氧循环对人类的重要意义。
氧气的物理性质
1. 色、味、态:
2. 密度:
3.溶解性:
4. 沸、熔点:
无色、无味的气体。
比空气密度略大。
不易溶于水,1L水只能溶解30ml氧气。
无色气体
淡蓝色液体
淡蓝色固体
-183℃
-218℃
氧气贮存在天蓝色钢瓶中
氧气的化学性质
实验一:用坩埚钳夹持木炭,加热,点燃,观察现象;将木炭由上往下慢慢放入氧气中,观察现象;倒入澄清石灰水,稍振荡,观察现象.
实验二:用坩埚钳夹住铁丝,点燃火柴梗,待火柴梗燃烧接近结束时,将铁丝由上往下慢慢伸入集气瓶中(底部留水),观察现象和最后产物
实验三:点燃蜡烛,观察蜡烛在空气中燃烧现象,将蜡烛由上往下慢慢伸入集气瓶中,观察蜡烛在氧气中燃烧现象(注意观察瓶壁);倒入澄清石灰水,稍振荡,观察现象
木炭
铁丝
蜡烛
·木炭在空气中燃烧和在氧气中燃烧剧烈程度明显不同,原因是什么?你能否从微观角度试着解释?
观察与思考
分子之间欲发生反应,其首要条件是分子之间接触碰撞。在空气中,含量较多的是氮气,氧气分子含量相对较少,木炭与氧分子碰撞机会少,而在纯氧气中则大大增加了碰撞机会。
氧气浓度不同
思考与讨论:
1.为什么要将铁丝在火柴梗上绕成螺旋状
增大与氧气的接触面积
2.为什么火柴梗即将燃尽时才伸入集气瓶中?
防止火柴燃烧消耗过多氧气
3.为什么瓶中要加入少量的水或铺一层沙?
防止熔化的生成物溅落下来,炸裂
瓶底。
明察秋毫
1、观察生成物,指出物质在组成上有何相似之处?2、观察下列反应,指出这些反应有何相同之处?
碳 + 氧气 二氧化碳(CO2)
点燃
铁 + 氧气 氧化三铁(Fe3O4)
点燃
石蜡 + 氧气 二氧化碳 + 水(H2O)
点燃
1、有两种元素组成的化合物,如果其中一种元素是氧,这样的化合物叫做氧化物。
2、这些有氧气参加的化学反应属于
氧化反应。
总结:
★●●
物质与氧气发生的化学反应,属于氧化反应。
注意:有的没有氧气参加的化学反应
也属于氧化反应。
例:H2+CuO Cu+H20
氧化反应不是基本反应类型。
加热
判断:氧化反应都是化合反应( )
举例说明:
石蜡+氧气
二氧化碳+水
点燃
×
在自然界中,许多物质都能与氧气反应消耗氧气,那么空气中的氧气是否会因此而减少呢?为什么?
不会,自然界中的氧气含量相 对恒定.
1、取A、B两个密闭的玻璃钟罩,在A、B钟罩中如图分别放入植物和蜡烛,然后将两个钟罩放在阳光充足的地方。
2、观察到的现象:
。
A
B
3、实验结论: 。
A钟罩中蜡烛一会儿就熄灭,B中很长时间才熄灭
绿色植物光合作用产生氧气
在大自然中,消耗氧气的途径主要有哪些?产生氧气的途径主要是什么?
自然界中的氧循环
物质燃烧
生物呼吸
食物腐烂
……
O2
CO2
植物
光合作用
剧烈氧化反应
缓慢氧化反应
对照学习目标,看看今天的学习任务有没有完成?
你有什么收获、什么感受愿意和大家分享?
O2的性质
物理性质
化学性质
色、味、态
密度
水溶性
三态变化
C+O2 CO2
点燃
Fe+O2 Fe3O4
点燃
石蜡+O2 CO2+H2O
点燃
氧化反应
自然界中的氧循环
氧气的产生途径
氧气的消耗途径
1、
2、
氧气是我们身边常见的物质,以下有关氧气的叙述不正确的是 ( )
A.氧气具有可燃性
B.氧气能提供动植物呼吸
C.氧气能支持燃烧
D.某些物质在空气中不能燃烧,但在氧气中能燃烧
A
2.细铁丝在氧气中燃烧时的反应现象是 ( )
A. 产生光彩夺目的火焰,生成黑色固体
B.剧烈燃烧,火星四射,生成黑色固体
C.铁丝红热,熔化
D.产生蓝色火焰,生成黑色固体
B
3、下列物质属于氧化物的是( )
A O2 B SiO2 C NaOH D H2SO4
B
4、下列不属于氧气在大自然中的消耗途径的是( )
A、生物的呼吸 B、緑色植物的光合作用
C、物质在空气中的燃烧 D、物质在空气中的缓慢氧化
B
拓展延伸:下列反应不是属于氧化反应的是( )
A、碳 + 氧气 二氧化碳
B、镁 + 氧气 氧化镁
C、氢气 + 氧化铜 铜+水
D、碳酸钙 氧化钙+二氧化钙
点燃
点燃
加热
高温
D
作业:
课后挑战自我1—6题
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
