人教版高中化学必修二第一章第二节元素周期律课件(17张)
文档属性
| 名称 | 人教版高中化学必修二第一章第二节元素周期律课件(17张) |

|
|
| 格式 | zip | ||
| 文件大小 | 390.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 21:00:31 | ||
图片预览






文档简介
(共17张PPT)
1.2.1 元素周期律
1—18元素原子的核外电子排布
元素原子的核外电子排布呈周期性的变化
探究问题1
1、元素核外电子排布的周期性变化
结论
11~18
3~10
1~2
稀有气体原子最外层电子数
最外层电子数
电子层数
原子序数
1
2
3
1→2
1→8
1→8
2
8
8
随原子序数的递增,元素原子最外层电子排布呈(1-8)周期性变化。(第一周期除外)
测量依据不同
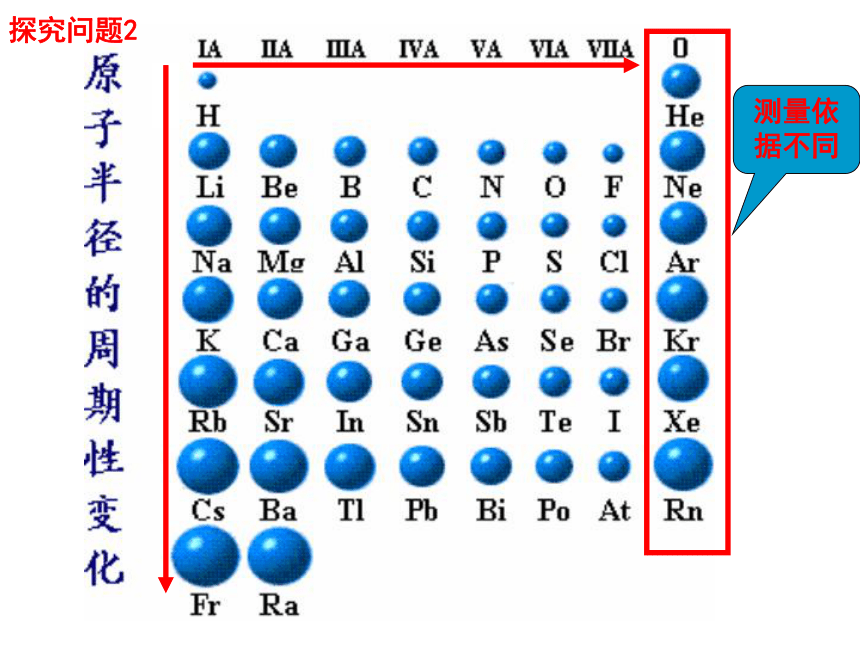
探究问题2
元素原子半径数据
原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号
原子半径
nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 ----
原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号
原子半径
nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099 ----
Li
Be
B
C
O
N
F
Ne
Na
Mg
Al
Si
S
P
Cl
Ar
结论: 同周期元素随着原子序数的递增 ,元素的原子半径呈现从大到小的周期性变化(稀有气体除外)。
探究问题3
结论:随着原子序数的递增,元素的最高正价呈现+1——+7(O、F除外)、最低负化合价
-4 —— -1周期性变化
科学探究4:如何比较Na、Mg、Al元素
金属性的强弱?
与水反应 Na Mg
实验现象
化学方程式
结论
浮、熔、游、响、红,常温下剧烈反应
常温下缓慢反应,加热至沸腾,镁
表面冒气泡且变红
元素的金属性:Na > Mg
1、Na、Mg与水反应实验对比
2、Mg、Al与盐酸反应实验对比
与盐酸反应 Mg Al
实验现象
化学方程式
结论
镁带表面产生大量气泡,反应剧烈
元素的金属性:Mg > Al
铝片表面产生气泡,反应不如镁剧烈
Na Mg Al
元素的金属性逐渐减弱
小结:
如何比较Si、P、S、Cl元素非金属性的强弱?
Si P S Cl
元素的非金属性逐渐增强
小结:
第三周期元素性质的递变性:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
其他周期的元素也有类似的规律:
随着核电荷数的增加,同周期元素的
金属性逐渐减弱,非金属性逐渐增强
元素的性质随着原子序数
的递增而呈现周期性的变
化规律。
元素周期律——
元 素 周 期 律
实质:原子的核外电子排布周期性的变化。
知识信息反馈1:
元素金属性强弱的对比方法:
单质与水(或酸)反应的剧烈程度
最高价氧化物对应水化物的碱性
金属单质间的置换
依据元素周期表
下列说法能证明钾元素比镁元素金属性强的是( )
A、金属钾与冷水剧烈反应,镁与冷水 几乎没有现象。
B、KOH的碱性比Mg(OH)2强
C、金属钾与MgCl2的水溶液反应可置换出金属镁
D、在化学反应中,钾失去1个电子,镁失去2个电子
AB
当堂练习
知识信息反馈2:
元素非金属性强弱的对比方法:
单质与氢气化合的难易
最高价氧化物对应水化物的酸性
非金属单质间的置换
依据元素周期表
其氢化物的稳定性
当堂练习
下列说法能够证明氯元素的非金属性比硫元素强的是( )
A. HClO3的酸性比H2SO3强
B. HCl的酸性比H2S强
C. HCl的稳定性比H2S强
D. 氯气与氢气化合的条件要比硫与氢气化合的条件更容易。
CD
1.2.1 元素周期律
1—18元素原子的核外电子排布
元素原子的核外电子排布呈周期性的变化
探究问题1
1、元素核外电子排布的周期性变化
结论
11~18
3~10
1~2
稀有气体原子最外层电子数
最外层电子数
电子层数
原子序数
1
2
3
1→2
1→8
1→8
2
8
8
随原子序数的递增,元素原子最外层电子排布呈(1-8)周期性变化。(第一周期除外)
测量依据不同
探究问题2
元素原子半径数据
原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号
原子半径
nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 ----
原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号
原子半径
nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099 ----
Li
Be
B
C
O
N
F
Ne
Na
Mg
Al
Si
S
P
Cl
Ar
结论: 同周期元素随着原子序数的递增 ,元素的原子半径呈现从大到小的周期性变化(稀有气体除外)。
探究问题3
结论:随着原子序数的递增,元素的最高正价呈现+1——+7(O、F除外)、最低负化合价
-4 —— -1周期性变化
科学探究4:如何比较Na、Mg、Al元素
金属性的强弱?
与水反应 Na Mg
实验现象
化学方程式
结论
浮、熔、游、响、红,常温下剧烈反应
常温下缓慢反应,加热至沸腾,镁
表面冒气泡且变红
元素的金属性:Na > Mg
1、Na、Mg与水反应实验对比
2、Mg、Al与盐酸反应实验对比
与盐酸反应 Mg Al
实验现象
化学方程式
结论
镁带表面产生大量气泡,反应剧烈
元素的金属性:Mg > Al
铝片表面产生气泡,反应不如镁剧烈
Na Mg Al
元素的金属性逐渐减弱
小结:
如何比较Si、P、S、Cl元素非金属性的强弱?
Si P S Cl
元素的非金属性逐渐增强
小结:
第三周期元素性质的递变性:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
其他周期的元素也有类似的规律:
随着核电荷数的增加,同周期元素的
金属性逐渐减弱,非金属性逐渐增强
元素的性质随着原子序数
的递增而呈现周期性的变
化规律。
元素周期律——
元 素 周 期 律
实质:原子的核外电子排布周期性的变化。
知识信息反馈1:
元素金属性强弱的对比方法:
单质与水(或酸)反应的剧烈程度
最高价氧化物对应水化物的碱性
金属单质间的置换
依据元素周期表
下列说法能证明钾元素比镁元素金属性强的是( )
A、金属钾与冷水剧烈反应,镁与冷水 几乎没有现象。
B、KOH的碱性比Mg(OH)2强
C、金属钾与MgCl2的水溶液反应可置换出金属镁
D、在化学反应中,钾失去1个电子,镁失去2个电子
AB
当堂练习
知识信息反馈2:
元素非金属性强弱的对比方法:
单质与氢气化合的难易
最高价氧化物对应水化物的酸性
非金属单质间的置换
依据元素周期表
其氢化物的稳定性
当堂练习
下列说法能够证明氯元素的非金属性比硫元素强的是( )
A. HClO3的酸性比H2SO3强
B. HCl的酸性比H2S强
C. HCl的稳定性比H2S强
D. 氯气与氢气化合的条件要比硫与氢气化合的条件更容易。
CD
