人教版高中化学选修4第三章第三节3.3专题:离子浓度的大小比较课件 (共22张PPT)
文档属性
| 名称 | 人教版高中化学选修4第三章第三节3.3专题:离子浓度的大小比较课件 (共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 486.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 21:04:34 | ||
图片预览








文档简介
(共22张PPT)
1、电离理论:
② 多元弱酸电离是分步,主要由第一步决定
① 弱电解质电离是微弱的
如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)
>
>
>
>
>
>
>
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
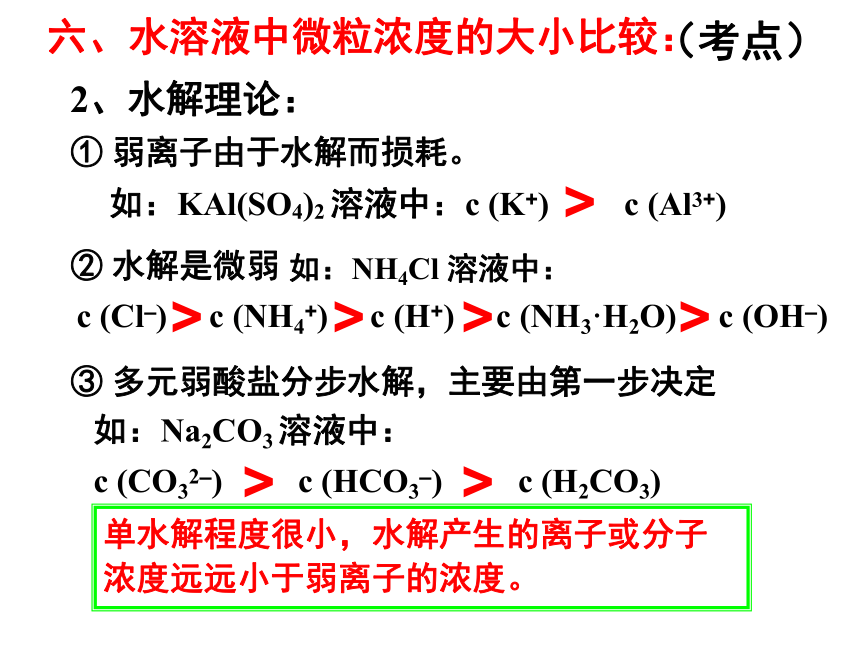
2、水解理论:
① 弱离子由于水解而损耗。
如:KAl(SO4)2 溶液中:c (K+) c (Al3+)
② 水解是微弱
③ 多元弱酸盐分步水解,主要由第一步决定
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)
如:Na2CO3 溶液中:
c (CO32–) c (HCO3–) c (H2CO3)
>
>
>
>
>
>
>
单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。
如:NH4Cl 溶液中:
六、水溶液中微粒浓度的大小比较:
(考点)
3、电荷守恒
如:NH4Cl 溶液中
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
六、水溶液中微粒浓度的大小比较:
(考点)
又如:Na2S 溶液
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )
六、水溶液中微粒浓度的大小比较:
(考点)
4、物料守恒
(元素or原子守恒)
如:a mol / L 的Na2CO3 溶液中
n(Na) : n(C) =2 : 1
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
如:Na2S 溶液
∵ n(Na) : n(S) =2 : 1
因此:c (Na+ ) = 2 [ c ( S2–) + c (HS–) + c (H2S) ]
如:NaHCO3溶液
c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3)
六、水溶液中微粒浓度的大小比较:
(考点)
5、质子(H+)守恒
可由电荷守恒与物料守恒共同推导
如:在K2S中
c(OH-) = c(HS-) + c(H3O+) + 2c(H2S)
解题指导
电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。 多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。
(1)弱电解质只有微弱电离,多元弱酸分步电离,且电离程度依次减小。
七、离子浓度大小比较方法
1.紧抓两个“微弱”
(2)弱酸(碱)根离子的水解是微弱的,多元弱酸根分步水解,且水解程度依次减小。
2.牢记三个守恒
(1)电荷守恒
(2)物料守恒
(3)质子守恒
3、明确常见规律
①强酸的酸式盐只电离不水解
NaHSO4=Na++H++SO42-
②多元弱酸的酸式盐要考虑酸根离子的电离程度和水解程度的相对大小。
电离>水解:HSO3-, H2PO4-
水解>电离:HCO3-, HPO42-, HS-
(1)酸式盐
(2)混合溶液
离子浓度大小比较题型
1.单一溶质溶液中离子浓度大小关系:
(1)H2SO3溶液中,各离子浓度大小关系为 。
(2)在0.1 mol/L的NH3·H2O溶液中,NH3·H2O、 NH4+、 OH-、 H+的浓度由大到小的顺序是
C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+)
C(H+) >c(HSO3-) >c(SO32-) >c(OH-)
(3)在氯化铵溶液中,下列关系式正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)>c(OH-)
√
解题归纳:
一种物质作溶质:
1.写出溶液中溶质、溶剂的电离、水解方程式。
2.根据电离、水解的程度大小作出判断。正盐完全电离,水电离程度很小。弱离子水解程度一般较小,多元弱酸根分步水解,且一级水解>二级水解。
弱酸:酸>H+>酸式酸根离子>酸根离子> OH-
2、多元弱酸是分步电离的,且电离程度依次减小。
如:在H3PO4溶液中
C(H3PO4)>C(H+)>C(H2PO4-)>C(HPO42-)>C(PO43-)>C(OH-)
例:用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-) 大于c(Na+),对该混合溶液下列判断正确的是( )
A、c(H+)>c(OH-)
B、c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
C、c(CH3COOH)>c(CH3COO-)
D、c(CH3COO-)+c(OH-)=0.1 mol·L-1
3、两种溶液混合后不同离子浓度的比较:
⑴、两种物质混合不反应:
AB
例:100 mL 0.1 mol·L-1 醋酸与50 mL 0.2 mol·L-1 NaOH溶
液混合,在所得溶液中( )
A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C、c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
D、c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
1.将0.4 mol/LNH4Cl溶液和0.2 mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )
A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O)
B、 c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
C、 c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)
D、 c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
A
D
⑵、两种物质恰好完全反应:
⑶、两种物质反应,其中一种有剩余:
2.把0.02 mol·L-1 HAc溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(Ac-)>c(Na+)
B、c(HAc)>c(Ac-)
C、2c(H+)=c(Ac-)-c(HAc)
D、c(HAc)+c(Ac-)=0.01 mol·L-1
3.将0.2 mol·L-1 CH3COOK 与0.1 mol·L-1盐酸等体积混合后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的关系正确的是( )
A、c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B、c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
AD
D
解题小结:
两种(或多种)物质相混合:先考虑这两种物质能否发生反应、再考虑反应后溶液中剩余的物质是强电解质还是弱电解质。如果恰好完全反应,则考虑生成的物质是什么,然后按照只有一物质作溶质进行处理;
当溶液中同时存在能水解的盐和弱酸、弱碱时,若不特别注明,则溶液通常是电离程度大于水解程度。
思考题:常温下,pH=2的某酸HA溶液与pH=12
的某碱BOH溶液等体积混合,所得混合
溶液的pH=8.7,下列说法中正确的是
A.HA一定是强酸,BOH可能是弱碱
B.HA可能为强酸,BOH一定为弱碱
C.盐BA的水溶液一定显碱性
D.盐BA的水溶液中A—一定水解
正确答案:B
2、在0.1 mol/LNaHSO3溶液中存在着微粒浓度的关系式,正确的是
A.c(Na+)>c(HSO3-)> c(SO32-)> c(H+)>c(OH-)
B.c(Na+)+c(H+)= c(HSO3-)+ c(SO32-)+c(OH-)
C.c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+ c(OH-)
D.c(Na+)= c(HSO3-)+c(SO32-)+ c(H2SO3)
CD
B
1.将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )
A、c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B、c(NH4+)>c(Cl-)> c(OH-)>c(H+)
C、c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D、c(NH4+)>c(Cl-)>c(H+)>c(OH-)
[现学现用]
4.在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是:
A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C、c(Na+)=c(HCO3-)>c(OH-)>c(H+)
D、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
BD
C
[现学现用]
3.常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中各离子浓度关系正确的是( )
A. c(HCOO-)>c(Na+)
B. c(HCOO-)<c(Na+)
C. c(HCOO-)=c(Na+)
D. 无法确定c(HCOO-)与C(Na+)的关系
4、不同溶液中同一离子浓度的比较
例1.相同浓度的下列溶液中,c(CO32-)的大小关系依次为
①Na2CO3 ②NaHCO3 ③H2CO3
④(NH4)2CO3 ⑤NH4HCO3
①④②⑤③
例2:等物质的量的下列溶液中,NH4+的浓度由大到小的顺序是
①NH4Cl ②NH4HCO3 ③ NH4HSO4
④ NH4NO3
③>①=④>②
知 识 小 结
一、溶液中微粒浓度大小比较:
1.紧抓两个“微弱”
2.牢记三个守恒
3.明确常见规律
(1)酸式盐
(2)混合溶液
二、离子浓度大小比较的题型
1、单一溶质溶液中离子浓度大小关系
3、两种溶液混合后不同离子浓度的比较
2、多元弱酸溶液
4、不同溶液中同一离子大小比较
1、电离理论:
② 多元弱酸电离是分步,主要由第一步决定
① 弱电解质电离是微弱的
如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)
>
>
>
>
>
>
>
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
2、水解理论:
① 弱离子由于水解而损耗。
如:KAl(SO4)2 溶液中:c (K+) c (Al3+)
② 水解是微弱
③ 多元弱酸盐分步水解,主要由第一步决定
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)
如:Na2CO3 溶液中:
c (CO32–) c (HCO3–) c (H2CO3)
>
>
>
>
>
>
>
单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。
如:NH4Cl 溶液中:
六、水溶液中微粒浓度的大小比较:
(考点)
3、电荷守恒
如:NH4Cl 溶液中
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
六、水溶液中微粒浓度的大小比较:
(考点)
又如:Na2S 溶液
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )
六、水溶液中微粒浓度的大小比较:
(考点)
4、物料守恒
(元素or原子守恒)
如:a mol / L 的Na2CO3 溶液中
n(Na) : n(C) =2 : 1
∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
如:Na2S 溶液
∵ n(Na) : n(S) =2 : 1
因此:c (Na+ ) = 2 [ c ( S2–) + c (HS–) + c (H2S) ]
如:NaHCO3溶液
c (Na+)=c (HCO3–) + c (CO32–) + c (H2CO3)
六、水溶液中微粒浓度的大小比较:
(考点)
5、质子(H+)守恒
可由电荷守恒与物料守恒共同推导
如:在K2S中
c(OH-) = c(HS-) + c(H3O+) + 2c(H2S)
解题指导
电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。 多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。
(1)弱电解质只有微弱电离,多元弱酸分步电离,且电离程度依次减小。
七、离子浓度大小比较方法
1.紧抓两个“微弱”
(2)弱酸(碱)根离子的水解是微弱的,多元弱酸根分步水解,且水解程度依次减小。
2.牢记三个守恒
(1)电荷守恒
(2)物料守恒
(3)质子守恒
3、明确常见规律
①强酸的酸式盐只电离不水解
NaHSO4=Na++H++SO42-
②多元弱酸的酸式盐要考虑酸根离子的电离程度和水解程度的相对大小。
电离>水解:HSO3-, H2PO4-
水解>电离:HCO3-, HPO42-, HS-
(1)酸式盐
(2)混合溶液
离子浓度大小比较题型
1.单一溶质溶液中离子浓度大小关系:
(1)H2SO3溶液中,各离子浓度大小关系为 。
(2)在0.1 mol/L的NH3·H2O溶液中,NH3·H2O、 NH4+、 OH-、 H+的浓度由大到小的顺序是
C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+)
C(H+) >c(HSO3-) >c(SO32-) >c(OH-)
(3)在氯化铵溶液中,下列关系式正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)>c(OH-)
√
解题归纳:
一种物质作溶质:
1.写出溶液中溶质、溶剂的电离、水解方程式。
2.根据电离、水解的程度大小作出判断。正盐完全电离,水电离程度很小。弱离子水解程度一般较小,多元弱酸根分步水解,且一级水解>二级水解。
弱酸:酸>H+>酸式酸根离子>酸根离子> OH-
2、多元弱酸是分步电离的,且电离程度依次减小。
如:在H3PO4溶液中
C(H3PO4)>C(H+)>C(H2PO4-)>C(HPO42-)>C(PO43-)>C(OH-)
例:用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-) 大于c(Na+),对该混合溶液下列判断正确的是( )
A、c(H+)>c(OH-)
B、c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
C、c(CH3COOH)>c(CH3COO-)
D、c(CH3COO-)+c(OH-)=0.1 mol·L-1
3、两种溶液混合后不同离子浓度的比较:
⑴、两种物质混合不反应:
AB
例:100 mL 0.1 mol·L-1 醋酸与50 mL 0.2 mol·L-1 NaOH溶
液混合,在所得溶液中( )
A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C、c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
D、c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
1.将0.4 mol/LNH4Cl溶液和0.2 mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )
A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O)
B、 c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
C、 c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)
D、 c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
A
D
⑵、两种物质恰好完全反应:
⑶、两种物质反应,其中一种有剩余:
2.把0.02 mol·L-1 HAc溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(Ac-)>c(Na+)
B、c(HAc)>c(Ac-)
C、2c(H+)=c(Ac-)-c(HAc)
D、c(HAc)+c(Ac-)=0.01 mol·L-1
3.将0.2 mol·L-1 CH3COOK 与0.1 mol·L-1盐酸等体积混合后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的关系正确的是( )
A、c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B、c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
AD
D
解题小结:
两种(或多种)物质相混合:先考虑这两种物质能否发生反应、再考虑反应后溶液中剩余的物质是强电解质还是弱电解质。如果恰好完全反应,则考虑生成的物质是什么,然后按照只有一物质作溶质进行处理;
当溶液中同时存在能水解的盐和弱酸、弱碱时,若不特别注明,则溶液通常是电离程度大于水解程度。
思考题:常温下,pH=2的某酸HA溶液与pH=12
的某碱BOH溶液等体积混合,所得混合
溶液的pH=8.7,下列说法中正确的是
A.HA一定是强酸,BOH可能是弱碱
B.HA可能为强酸,BOH一定为弱碱
C.盐BA的水溶液一定显碱性
D.盐BA的水溶液中A—一定水解
正确答案:B
2、在0.1 mol/LNaHSO3溶液中存在着微粒浓度的关系式,正确的是
A.c(Na+)>c(HSO3-)> c(SO32-)> c(H+)>c(OH-)
B.c(Na+)+c(H+)= c(HSO3-)+ c(SO32-)+c(OH-)
C.c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+ c(OH-)
D.c(Na+)= c(HSO3-)+c(SO32-)+ c(H2SO3)
CD
B
1.将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )
A、c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B、c(NH4+)>c(Cl-)> c(OH-)>c(H+)
C、c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D、c(NH4+)>c(Cl-)>c(H+)>c(OH-)
[现学现用]
4.在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是:
A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C、c(Na+)=c(HCO3-)>c(OH-)>c(H+)
D、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
BD
C
[现学现用]
3.常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中各离子浓度关系正确的是( )
A. c(HCOO-)>c(Na+)
B. c(HCOO-)<c(Na+)
C. c(HCOO-)=c(Na+)
D. 无法确定c(HCOO-)与C(Na+)的关系
4、不同溶液中同一离子浓度的比较
例1.相同浓度的下列溶液中,c(CO32-)的大小关系依次为
①Na2CO3 ②NaHCO3 ③H2CO3
④(NH4)2CO3 ⑤NH4HCO3
①④②⑤③
例2:等物质的量的下列溶液中,NH4+的浓度由大到小的顺序是
①NH4Cl ②NH4HCO3 ③ NH4HSO4
④ NH4NO3
③>①=④>②
知 识 小 结
一、溶液中微粒浓度大小比较:
1.紧抓两个“微弱”
2.牢记三个守恒
3.明确常见规律
(1)酸式盐
(2)混合溶液
二、离子浓度大小比较的题型
1、单一溶质溶液中离子浓度大小关系
3、两种溶液混合后不同离子浓度的比较
2、多元弱酸溶液
4、不同溶液中同一离子大小比较
