2020年高二化学人教选修4同步导学提分教程:4.3 第2课时《电解原理的应用》课时检测【 解析】
文档属性
| 名称 | 2020年高二化学人教选修4同步导学提分教程:4.3 第2课时《电解原理的应用》课时检测【 解析】 |  | |
| 格式 | zip | ||
| 文件大小 | 241.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 21:07:25 | ||
图片预览


文档简介
2020年高二化学人教选修4同步导学提分教程:
——《电解原理的应用》课时检测
1.将含有0.4 mol CuSO4和0.2 mol NaCl的水溶液1 L,用惰性电极电解一段时间后,在一个电极上得到0.3 mol Cu,另一个电极上析出气体在标准状况下的体积为( )
A.4.48 L B.5.6 L
C.6.72 L D.13.44 L
答案 A
解析 阴极反应为Cu2++2e-===Cu,因为反应的n(Cu2+)=0.3 mol,总n(Cu2+)=0.4 mol,说明Cu2+过量,阴极共得到0.6 mol电子。由得失电子守恒可知,阳极应失去0.6 mol电子。阳极:首先2Cl--2e-===Cl2↑,因为0.2 mol Cl-只能失去0.2 mol电子,另外0.4 mol电子只能由水失去,阳极反应还有2H2O-4e-===4H++O2↑,则阳极共放出气体体积(0.1 mol+0.1 mol)×22.4 L/mol=4.48 L,故应选A。
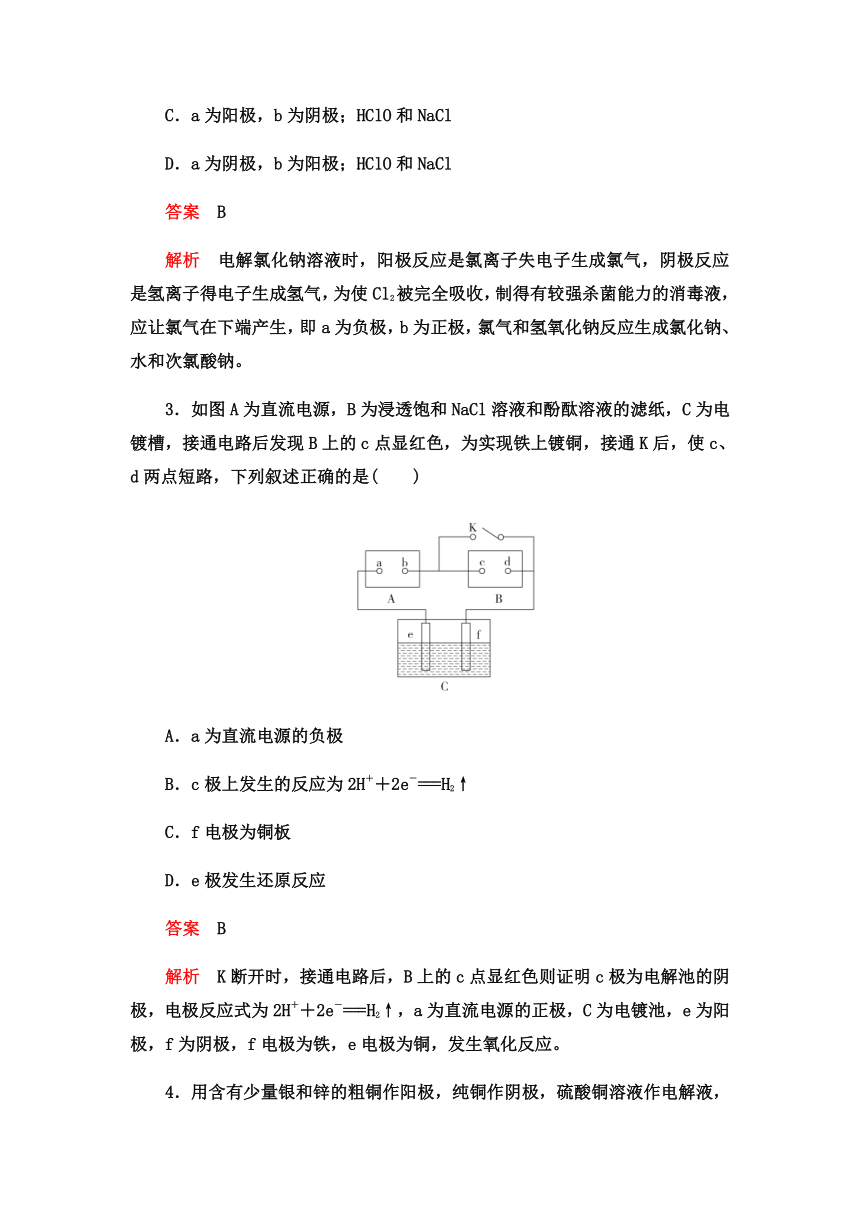
2. 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和NaCl溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
答案 B
解析 电解氯化钠溶液时,阳极反应是氯离子失电子生成氯气,阴极反应是氢离子得电子生成氢气,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,应让氯气在下端产生,即a为负极,b为正极,氯气和氢氧化钠反应生成氯化钠、水和次氯酸钠。
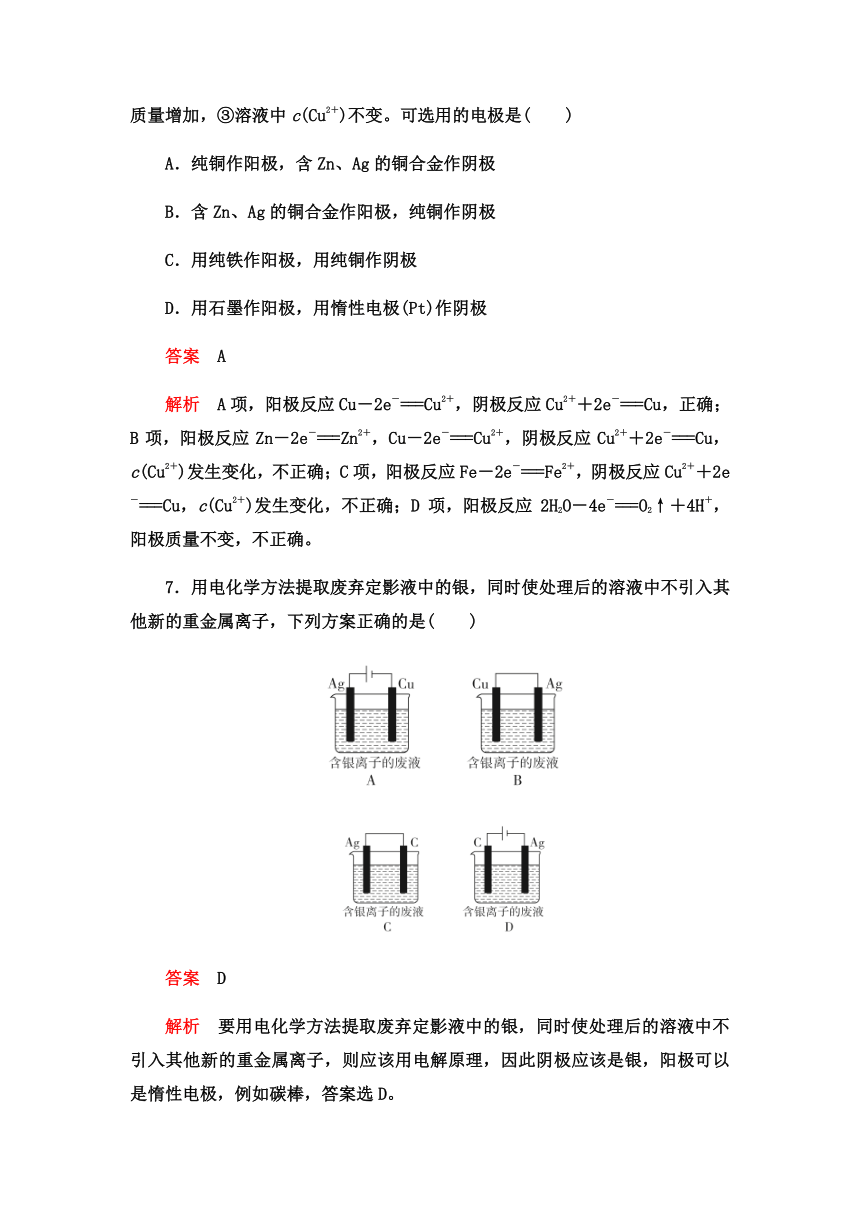
3.如图A为直流电源,B为浸透饱和NaCl溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,为实现铁上镀铜,接通K后,使c、d两点短路,下列叙述正确的是( )
A.a为直流电源的负极
B.c极上发生的反应为2H++2e-===H2↑
C.f电极为铜板
D.e极发生还原反应
答案 B
解析 K断开时,接通电路后,B上的c点显红色则证明c极为电解池的阴极,电极反应式为2H++2e-===H2↑,a为直流电源的正极,C为电镀池,e为阳极,f为阴极,f电极为铁,e电极为铜,发生氧化反应。
4.用含有少量银和锌的粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解液,通电一段时间后,阳极的质量减轻了6.4 g,下列说法正确的是( )
A.电解质溶液的质量增加了6.4 g
B.阴极的质量增加了6.4 g
C.阴极增加的质量小于6.4 g
D.溶液中Cu2+浓度保持不变
答案 C
解析 在阳极上有锌与铜两种单质放电,而在阴极上只有Cu2+放电且锌的摩尔质量大于铜的摩尔质量,当阳极的质量减轻6.4 g时,转移的电子少于0.2 mol,故在阴极上析出的铜少于0.1 mol,质量小于6.4 g;由于相同时间内两极上转移的电子数目相等,阴极上析出的铜比阳极上溶解的铜多,故溶液中Cu2+浓度减小。
5.金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
答案 D
解析 电解时,阳极失去电子发生氧化反应,失电子的金属为Zn、Fe和Ni,A中的电极反应式错误;电解过程中阳极失电子的金属(依次是Zn、Fe、Ni)与在阴极得电子生成的金属(Ni)不同,阳极质量的减少量与阴极质量的增加量不一定相等,B错误;电解后溶液中阳离子除含有Fe2+、Zn2+、H+外还有Ni2+,C错误。
6.电解CuSO4溶液时,若要达到以下三点要求:①阳极质量减少,②阴极质量增加,③溶液中c(Cu2+)不变。可选用的电极是( )
A.纯铜作阳极,含Zn、Ag的铜合金作阴极
B.含Zn、Ag的铜合金作阳极,纯铜作阴极
C.用纯铁作阳极,用纯铜作阴极
D.用石墨作阳极,用惰性电极(Pt)作阴极
答案 A
解析 A项,阳极反应Cu-2e-===Cu2+,阴极反应Cu2++2e-===Cu,正确;B项,阳极反应Zn-2e-===Zn2+,Cu-2e-===Cu2+,阴极反应Cu2++2e-===Cu,c(Cu2+)发生变化,不正确;C项,阳极反应Fe-2e-===Fe2+,阴极反应Cu2++2e-===Cu,c(Cu2+)发生变化,不正确;D项,阳极反应2H2O-4e-===O2↑+4H+,阳极质量不变,不正确。
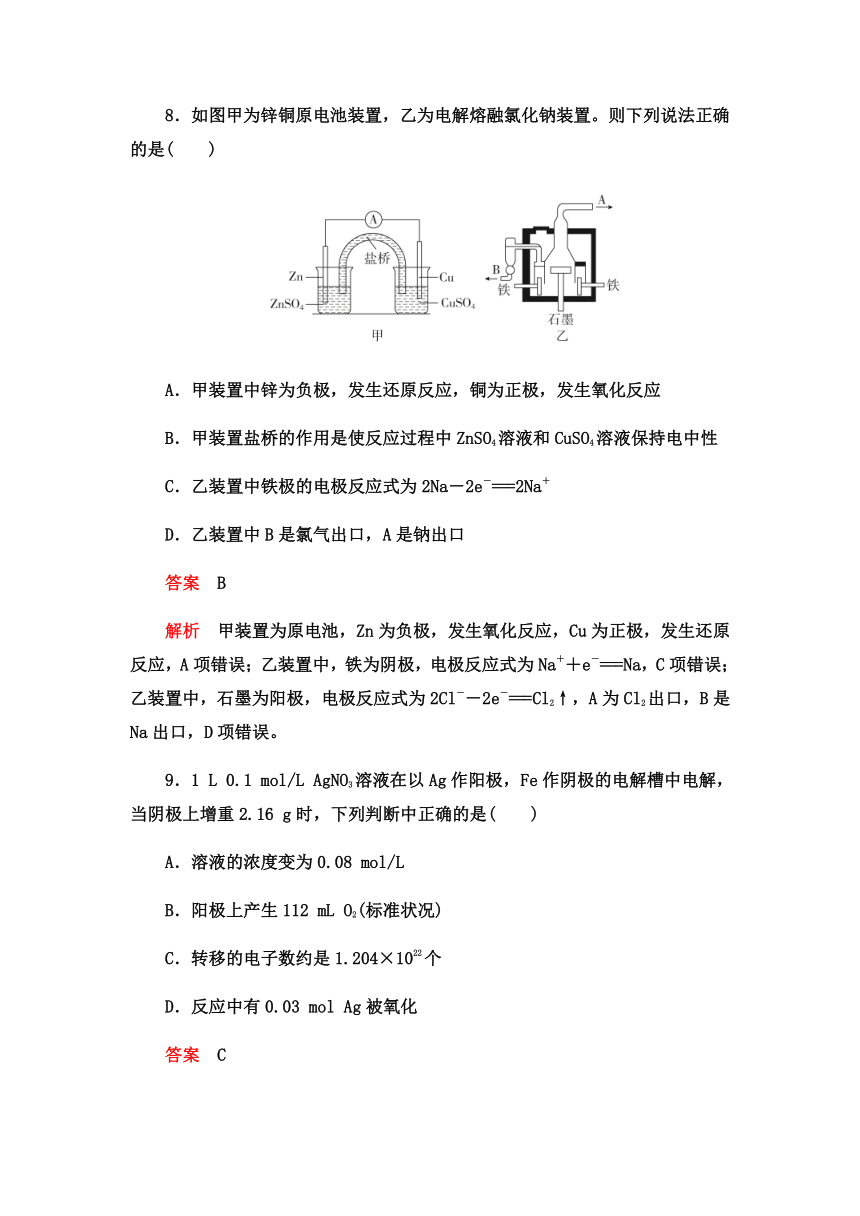
7.用电化学方法提取废弃定影液中的银,同时使处理后的溶液中不引入其他新的重金属离子,下列方案正确的是( )
答案 D
解析 要用电化学方法提取废弃定影液中的银,同时使处理后的溶液中不引入其他新的重金属离子,则应该用电解原理,因此阴极应该是银,阳极可以是惰性电极,例如碳棒,答案选D。
8.如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是( )
A.甲装置中锌为负极,发生还原反应,铜为正极,发生氧化反应
B.甲装置盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性
C.乙装置中铁极的电极反应式为2Na-2e-===2Na+
D.乙装置中B是氯气出口,A是钠出口
答案 B
解析 甲装置为原电池,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,A项错误;乙装置中,铁为阴极,电极反应式为Na++e-===Na,C项错误;乙装置中,石墨为阳极,电极反应式为2Cl--2e-===Cl2↑,A为Cl2出口,B是Na出口,D项错误。
9.1 L 0.1 mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16 g时,下列判断中正确的是( )
A.溶液的浓度变为0.08 mol/L
B.阳极上产生112 mL O2(标准状况)
C.转移的电子数约是1.204×1022个
D.反应中有0.03 mol Ag被氧化
答案 C
解析 Ag作阳极,阳极反应式为Ag-e-===Ag+;阴极上反应式为Ag++e-===Ag。当阴极上增重2.16 g时,转移电子为0.02 mol,即约1.204×1022个,故C正确。
10.21世纪是钛的世纪,在800~1000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生氧化反应
C.阴极发生的反应为TiO2+2e-===Ti+2O2-
D.每生成0.1 mol钛,转移电子0.2 mol
答案 B
解析 由O2-移动方向可知b为电源正极,A项错误;b为电源正极,石墨电极上发生氧化反应,B项正确;阴极发生的反应为TiO2+4e-===Ti+2O2-,C项错误;每生成0.1 mol钛,转移电子0.4 mol,D项错误。
11.电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
A.a极与电源的负极相连
B.a电极反应式:2H2O+2e-===H2↑+2OH-
C.离子交换膜d为阴离子交换膜
D.产物丙为硫酸溶液
答案 D
解析 据装置图分析可知是电解装置,电解硫酸钠溶液,实质是电解水,气体甲与气体乙的体积比约为1∶2,气体甲为氧气,气体乙为氢气,阳极生成氧气,电极反应4OH--4e-===2H2O+O2↑,阴极生成氢气,2H++2e-===H2↑,所以a电极是阳极,b电极是阴极,在阳极室得到硫酸,在阴极室得到氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜。
12.利用图中所示装置(电极均为惰性电极)可吸收SO2。下列说法正确的是( )
A.a为直流电源的负极
B.阴极的电极反应式为2HSO+2H++e-===S2O+2H2O
C.阳极的电极反应式为SO2+2H2O-2e-===SO+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
答案 C
解析 A项,从图中左侧知,SO2转化成H2SO4,S从+4价升高到+6价,失去电子,则为阳极,对应的a为正极,错误;B项,得2e-,错误;C项,阳极为SO2失去电子生成SO,正确;D项,H+应移向阴极,错误。
13.如图两个装置中用滴有酚酞的NaCl溶液作电解质溶液,进行化学能和电能相互转化的研究。
请回答:
(1)写出两个铁电极上的电极反应式。
甲:______________________________________________________;
乙:____________________________________________________________。
(2)乙装置中________电极(填“Fe”或“石墨”)附近的溶液变红。
(3)检验乙中石墨电极反应产物的方法及现象是_________________________
__________________________________________________________。
(4)如果起始时乙中盛有足量的一定浓度的CuSO4溶液,反应一段时间后,要使溶液恢复到起始状态,可向溶液中加入一定量的__________(填化学式)。
(5)“84消毒液”是常用的消毒剂。电解氯化钠稀溶液可制备“84消毒液”,装置如图所示。通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学反应方程式:________________________。
答案 (1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)Fe (3)用湿润的淀粉-KI试纸靠近石墨电极所在一侧的支管口,试纸变蓝 (4)CuO
(5)NaCl+H2ONaClO+H2↑
解析 (1)甲是原电池。铁作负极失去电子变成Fe2+;乙中铁是阴极,H+在阴极放电生成H2。
(2)由于电解时阴极附近生成OH-,故铁电极附近变红色。
(3)石墨电极上产生的是氯气,可用淀粉-KI试纸检验。
(4)电解CuSO4溶液可得到H2SO4、Cu和O2:2CuSO4+2H2O2Cu+2H2SO4+O2↑,故加入适量的CuO即可。
(5)“84消毒液”的主要成分是NaClO,电解时阴极产生H2,阳极产生Cl2,电解反应为2NaCl+2H2O2NaOH+H2↑+Cl2↑,Cl2被NaOH溶液吸收生成NaCl、NaClO和H2O,反应为Cl2+2NaOH===NaCl+NaClO+H2O,两个反应方程式相加即得出NaCl+H2ONaClO+H2↑。
14.ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:________________________________;图中b电极为________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________ mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:__________________________。
答案 (1)Cl--5e-+2H2O===ClO2↑+4H+ 阴极
(2)0.01 变大
(3)2ClO2+2CN-===N2+2CO2+2Cl-
解析 (1)电解液中阳离子由左至右迁移,故左边是阳极,右边是阴极(b是阴极)。
(2)阴极产生的是H2,n(H2)=0.005 mol,需要转移的电子为0.01 mol,通过阳离子交换膜的为Na+和H+,故n(Na+)+n(H+)=0.01 mol;阴极区H+放电,pH变大。
