人教版 选修五 有机化学基础 第二章 第二节 芳香烃 第一课时 苯的性质(共21张PPT)
文档属性
| 名称 | 人教版 选修五 有机化学基础 第二章 第二节 芳香烃 第一课时 苯的性质(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-16 21:49:29 | ||
图片预览



文档简介
(共21张PPT)
第二章 烃和卤代烃
第二节 芳香烃
苯的结构和物理性质
1
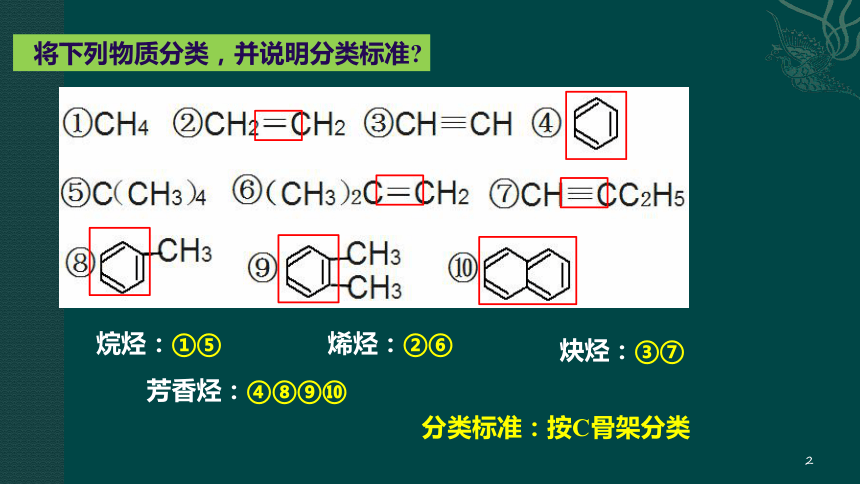
将下列物质分类,并说明分类标准?
烷烃:①⑤
烯烃:②⑥
炔烃:③⑦
芳香烃:④⑧⑨⑩
分类标准:按C骨架分类
2
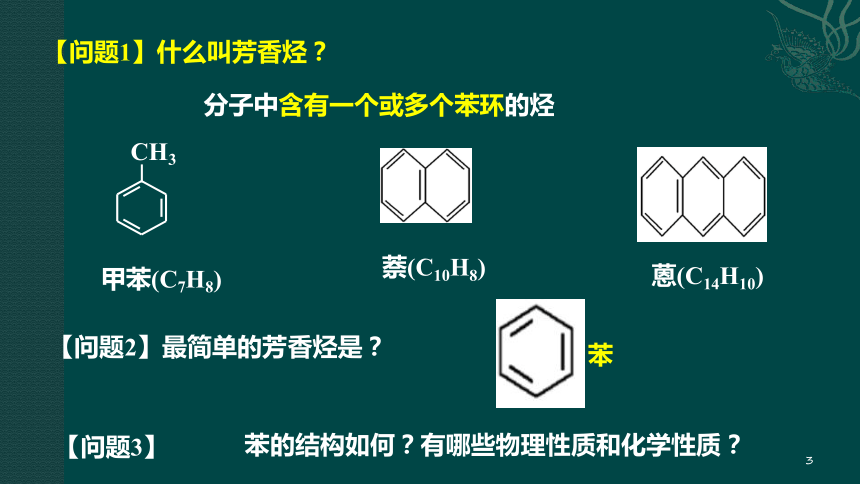
【问题1】什么叫芳香烃?
分子中含有一个或多个苯环的烃
【问题2】最简单的芳香烃是?
苯
CH3
甲苯(C7H8)
萘(C10H8)
蒽(C14H10)
【问题3】
苯的结构如何?有哪些物理性质和化学性质?
3
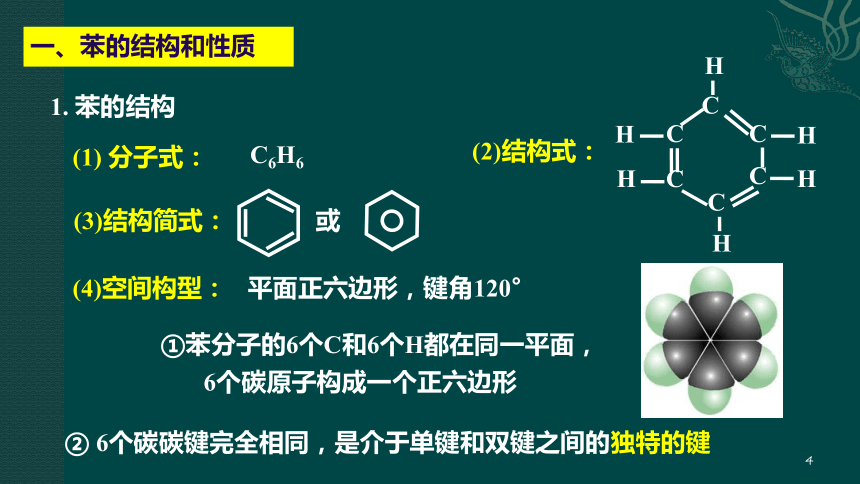
一、苯的结构和性质
(1) 分子式:
C6H6
1. 苯的结构
C
C
C
C
C
C
H
H
H
H
H
H
(2)结构式:
或
(3)结构简式:
平面正六边形,键角120°
(4)空间构型:
①苯分子的6个C和6个H都在同一平面,6个碳原子构成一个正六边形
② 6个碳碳键完全相同,是介于单键和双键之间的独特的键
4
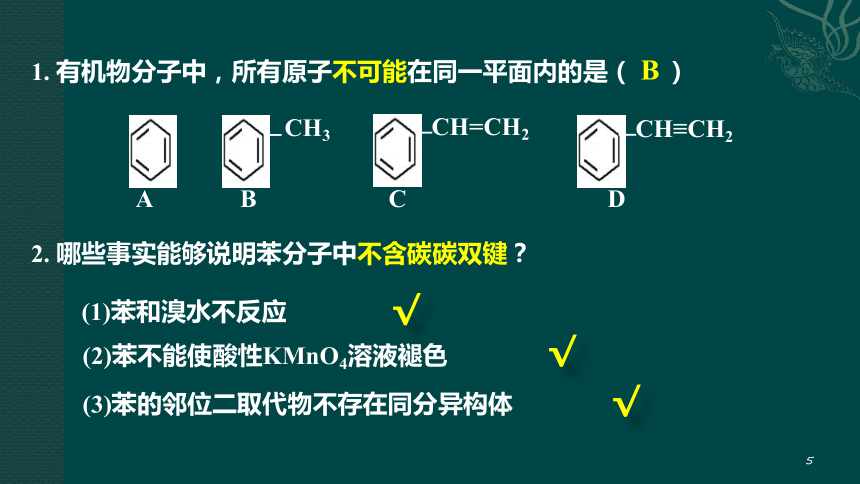
1. 有机物分子中,所有原子不可能在同一平面内的是( )
CH=CH2
CH≡CH2
CH3
A B C D
(1)苯和溴水不反应
(2)苯不能使酸性KMnO4溶液褪色
(3)苯的邻位二取代物不存在同分异构体
2. 哪些事实能够说明苯分子中不含碳碳双键?
B
√
√
√
5
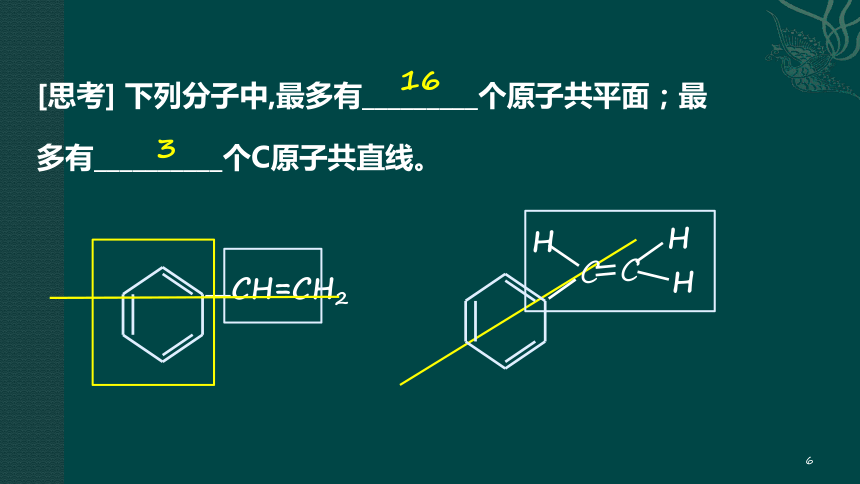
[思考] 下列分子中,最多有_________个原子共平面;最多有__________个C原子共直线。
CH=CH2
16
3
C
C
H
H
H
6
芳香杀手
2. 苯的物理性质
无色、有特殊气味、密度比水小、不溶于水、易溶于有机溶剂的有毒液体。
室内环境中的苯污染主要来自含苯胶黏剂、油漆、涂料和防水材料的溶剂或稀释剂 。
苯的毒性(一类致癌物)
可引起急性中毒,麻痹中枢神经,需要充分漱口,喝水,尽快洗胃。长期吸入会导致再生障碍性贫血,严重者会引起白血病。
7
第二章 烃和卤代烃
第二节 芳香烃
苯的化学性质
8
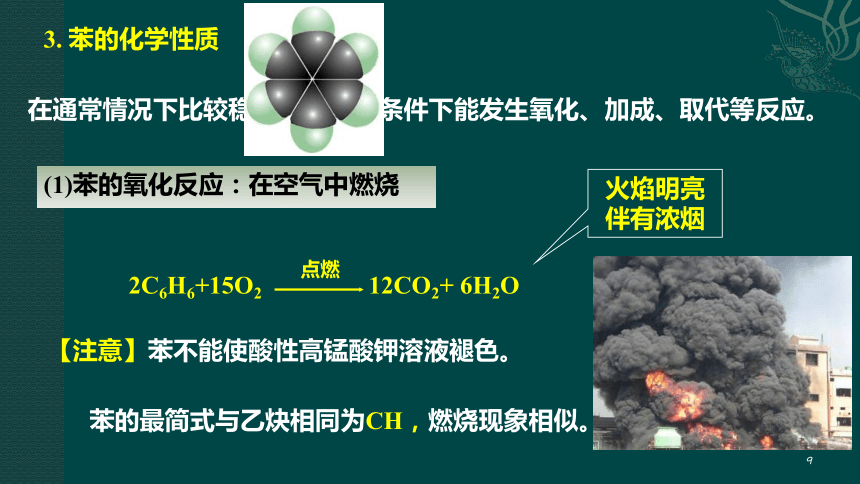
3. 苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
(1)苯的氧化反应:在空气中燃烧
2C6H6+15O2 12CO2+ 6H2O
点燃
【注意】苯不能使酸性高锰酸钾溶液褪色。
火焰明亮伴有浓烟
苯的最简式与乙炔相同为CH,燃烧现象相似。
9
(2)苯的取代反应(卤代、硝化、磺化)
+ Br2
Br
+ HBr
Fe
2. 溴苯是密度比水大的无色液体。
【注意】1.催化剂Fe与Br2反应生成FeBr3起催化剂作用,该反应是放热反应。
有白雾生成
10
硝基苯为无色、具有苦杏仁味的油状液体,其密度大于水
+ HNO3(浓)
NO2
+ H2O
浓H2SO4
50~60℃
浓硫酸作用:催化剂、吸水剂
加热方式:水浴加热
硝基苯
11
(3)苯的加成反应(与H2、Cl2)
(环己烷)
+3 H2
Ni
加热加压
磺化反应———浓硫酸是反应物
。
。
C6H6+3Cl2 C6H6Cl6
(六氯环己烷)
苯磺酸
12
反应的化学方程式 反应条件
苯与溴发生取代反应
苯与浓硝酸发生取代反应
苯与氢气发生加成反应
液溴,铁做催化剂
50℃~60℃水浴加热、浓硫酸做催化剂吸水剂
镍做催化剂,加热
C6H6+3H2
C6H12
Ni
13
第二章 烃和卤代烃
第二节 芳香烃
溴苯和硝基苯的制备方案
14
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
请同学们设计实验时,考虑以下问题:
1.选用装置 2.加入药品的顺序
3.如何控温 4.产物提纯 等
15
1.溴是一种易挥发有剧毒的药品
2.溴的密度比苯大
3.溴与苯的反应非常缓慢,常用铁粉作为催化剂
4.该反应是放热反应,不需要加热
【苯与溴的实验设计】
16
2Fe + 3Br2 = 2FeBr3
+ Br2
Br
+ HBr
FeBr3
AgNO3 +HBr = AgBr↓ +HNO3
设计制备溴苯实验方案
【主要仪器】圆底烧瓶、长导管、锥形瓶、铁架台等
【药品】苯、液溴、铁粉、硝酸银溶液
【反应原理】取代反应。实际起催化作用的是FeBr3
溴苯溶解溴成褐色
17
18
溴苯的提纯实验方案
根据苯与溴反应的特点,得出杂质种类
苯、溴、溴化氢
1、水洗洗去溴与苯反应生成的氢溴酸.(HBr易溶于水而其它不易溶于水)
2、用氢氧化钠洗去溴单质(溴和氢氧化钠反应)
3、用水洗去多余的氢氧化钠(理由如1)
4、干燥剂除去多余的水
5、蒸馏分离溴苯与苯,(两者沸点不同,笨的沸点小,被蒸馏出,溴苯留在母液中)
有几个同学设计如下的实验装置用来检验HBr气体,我们来看看是否合理?
CCl4
19
硝基苯
设计苯的硝化反应实验方案
1.苯与硝酸的反应在50 ℃ --60℃ 时产物是硝基苯,温 度过高会有副产物。
2. 硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4 .苯和硝酸都易挥发。
硝基苯,无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
20
21
1、水洗:除去大部分可溶性杂质(H2SO4、HNO3等)
2、NaOH洗涤:除去所有的酸性杂质(H2SO4、HNO3等)
3、水洗:除去NaOH
4、干燥剂:除去水
5、蒸馏:除去有机杂质(苯等)
硝基苯的提纯实验方案
根据硝基苯制备的特点,得出杂质种类
苯、硫酸、硝酸
第二章 烃和卤代烃
第二节 芳香烃
苯的结构和物理性质
1
将下列物质分类,并说明分类标准?
烷烃:①⑤
烯烃:②⑥
炔烃:③⑦
芳香烃:④⑧⑨⑩
分类标准:按C骨架分类
2
【问题1】什么叫芳香烃?
分子中含有一个或多个苯环的烃
【问题2】最简单的芳香烃是?
苯
CH3
甲苯(C7H8)
萘(C10H8)
蒽(C14H10)
【问题3】
苯的结构如何?有哪些物理性质和化学性质?
3
一、苯的结构和性质
(1) 分子式:
C6H6
1. 苯的结构
C
C
C
C
C
C
H
H
H
H
H
H
(2)结构式:
或
(3)结构简式:
平面正六边形,键角120°
(4)空间构型:
①苯分子的6个C和6个H都在同一平面,6个碳原子构成一个正六边形
② 6个碳碳键完全相同,是介于单键和双键之间的独特的键
4
1. 有机物分子中,所有原子不可能在同一平面内的是( )
CH=CH2
CH≡CH2
CH3
A B C D
(1)苯和溴水不反应
(2)苯不能使酸性KMnO4溶液褪色
(3)苯的邻位二取代物不存在同分异构体
2. 哪些事实能够说明苯分子中不含碳碳双键?
B
√
√
√
5
[思考] 下列分子中,最多有_________个原子共平面;最多有__________个C原子共直线。
CH=CH2
16
3
C
C
H
H
H
6
芳香杀手
2. 苯的物理性质
无色、有特殊气味、密度比水小、不溶于水、易溶于有机溶剂的有毒液体。
室内环境中的苯污染主要来自含苯胶黏剂、油漆、涂料和防水材料的溶剂或稀释剂 。
苯的毒性(一类致癌物)
可引起急性中毒,麻痹中枢神经,需要充分漱口,喝水,尽快洗胃。长期吸入会导致再生障碍性贫血,严重者会引起白血病。
7
第二章 烃和卤代烃
第二节 芳香烃
苯的化学性质
8
3. 苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
(1)苯的氧化反应:在空气中燃烧
2C6H6+15O2 12CO2+ 6H2O
点燃
【注意】苯不能使酸性高锰酸钾溶液褪色。
火焰明亮伴有浓烟
苯的最简式与乙炔相同为CH,燃烧现象相似。
9
(2)苯的取代反应(卤代、硝化、磺化)
+ Br2
Br
+ HBr
Fe
2. 溴苯是密度比水大的无色液体。
【注意】1.催化剂Fe与Br2反应生成FeBr3起催化剂作用,该反应是放热反应。
有白雾生成
10
硝基苯为无色、具有苦杏仁味的油状液体,其密度大于水
+ HNO3(浓)
NO2
+ H2O
浓H2SO4
50~60℃
浓硫酸作用:催化剂、吸水剂
加热方式:水浴加热
硝基苯
11
(3)苯的加成反应(与H2、Cl2)
(环己烷)
+3 H2
Ni
加热加压
磺化反应———浓硫酸是反应物
。
。
C6H6+3Cl2 C6H6Cl6
(六氯环己烷)
苯磺酸
12
反应的化学方程式 反应条件
苯与溴发生取代反应
苯与浓硝酸发生取代反应
苯与氢气发生加成反应
液溴,铁做催化剂
50℃~60℃水浴加热、浓硫酸做催化剂吸水剂
镍做催化剂,加热
C6H6+3H2
C6H12
Ni
13
第二章 烃和卤代烃
第二节 芳香烃
溴苯和硝基苯的制备方案
14
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
请同学们设计实验时,考虑以下问题:
1.选用装置 2.加入药品的顺序
3.如何控温 4.产物提纯 等
15
1.溴是一种易挥发有剧毒的药品
2.溴的密度比苯大
3.溴与苯的反应非常缓慢,常用铁粉作为催化剂
4.该反应是放热反应,不需要加热
【苯与溴的实验设计】
16
2Fe + 3Br2 = 2FeBr3
+ Br2
Br
+ HBr
FeBr3
AgNO3 +HBr = AgBr↓ +HNO3
设计制备溴苯实验方案
【主要仪器】圆底烧瓶、长导管、锥形瓶、铁架台等
【药品】苯、液溴、铁粉、硝酸银溶液
【反应原理】取代反应。实际起催化作用的是FeBr3
溴苯溶解溴成褐色
17
18
溴苯的提纯实验方案
根据苯与溴反应的特点,得出杂质种类
苯、溴、溴化氢
1、水洗洗去溴与苯反应生成的氢溴酸.(HBr易溶于水而其它不易溶于水)
2、用氢氧化钠洗去溴单质(溴和氢氧化钠反应)
3、用水洗去多余的氢氧化钠(理由如1)
4、干燥剂除去多余的水
5、蒸馏分离溴苯与苯,(两者沸点不同,笨的沸点小,被蒸馏出,溴苯留在母液中)
有几个同学设计如下的实验装置用来检验HBr气体,我们来看看是否合理?
CCl4
19
硝基苯
设计苯的硝化反应实验方案
1.苯与硝酸的反应在50 ℃ --60℃ 时产物是硝基苯,温 度过高会有副产物。
2. 硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4 .苯和硝酸都易挥发。
硝基苯,无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
20
21
1、水洗:除去大部分可溶性杂质(H2SO4、HNO3等)
2、NaOH洗涤:除去所有的酸性杂质(H2SO4、HNO3等)
3、水洗:除去NaOH
4、干燥剂:除去水
5、蒸馏:除去有机杂质(苯等)
硝基苯的提纯实验方案
根据硝基苯制备的特点,得出杂质种类
苯、硫酸、硝酸
