人教版 选修五 有机化学基础 第二章 第一节 脂肪烃 炔烃(共21张PPT)
文档属性
| 名称 | 人教版 选修五 有机化学基础 第二章 第一节 脂肪烃 炔烃(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-16 21:53:25 | ||
图片预览








文档简介
(共21张PPT)
第二章 烃和卤代烃
第一节 脂肪烃
炔烃
1
三、炔烃
分子里含有碳碳三键的一类脂肪烃称为炔烃。
1、概念:
2、炔烃的通式:CnH2n-2 (n≥2)
(1)物理性质:随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
(2)化学性质:能发生氧化反应,加成反应。
3、炔烃的通性:
2
1. 乙炔的分子结构:
电子式:
H—C≡C—H
结构简式:
CH≡CH
结构式:
直线型,
空间结构:
分子式:
C2H2
或 HC≡CH
键角1800
球棍模型
比例模型
含有叁键结构的相邻四原子在同一直线上
四、乙炔
3
碳碳叁键属于不饱和键,且一强两弱,易断裂,化学性质较活泼。
乙烷 乙烯 乙炔
348 KJ/mol
615 KJ/mol
812 KJ/mol
【结论】
碳碳键键能对比:
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。说明叁键中有二个键不稳定,容易断裂,有一个键较稳定。
【分析】
4
在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构,请问在炔烃分子中是否也存在顺反异构?
5
甲烷 乙烯 乙炔
结构简式
结构特点
空间结构
CH4
CH2=CH2
CH≡CH
全部单键,
饱和
有碳碳双键,
不饱和
有碳碳三键,不饱和
6
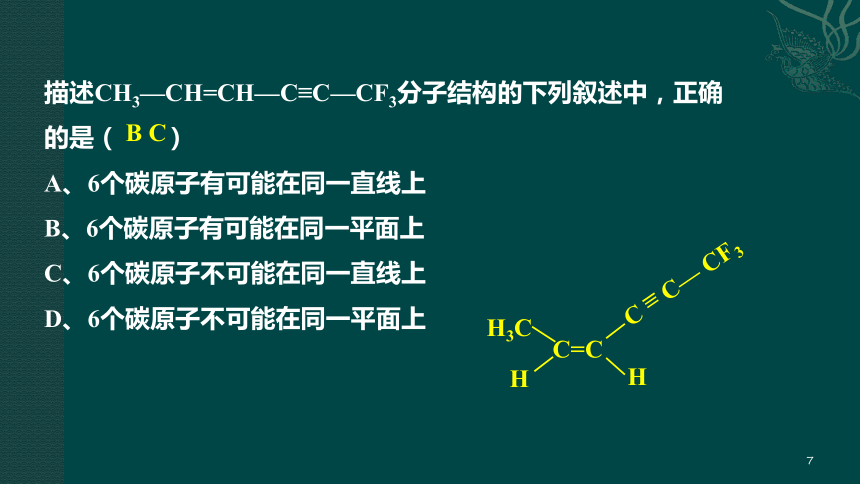
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )
A、6个碳原子有可能在同一直线上
B、6个碳原子有可能在同一平面上
C、6个碳原子不可能在同一直线上
D、6个碳原子不可能在同一平面上
B C
H
H
C=C
H3C
C = C— CF3
7
⑵ 乙炔的实验室制法
CaC2+2H2O C2H2↑+Ca(OH)2
②反应原理:
① 原料:电石(CaC2)与 H2O
2. 乙炔的制法
⑴ 工业制法
——甲烷裂解法
2CH4 CH≡CH +3 H2
1500 ℃
碳化钙
CaC2+2H—OH
C2H2↑+Ca(OH)2 +127KJ
8
③装置特点:
i. 装置不能用启普发生器,改用广口瓶和长颈漏斗
ii. 实验中常用饱和食盐水代替水
固体 +液体 气体
a.碳化钙与水反应较剧烈,难以控反制应速率;
b.放出的大量热量,操作不当会使启普发生器炸裂。
降低碳化钙与水的接触面积,得到平稳的乙炔气流。
反应装置
9
下列那种装置可以用来做为乙炔的制取装置?
A
B
C
D
E
F
固+液,
不需加热
A
B
C
D
E
F
BF
√
√
10
实验室中使用分液漏斗而不使用长颈漏斗,因为长颈漏斗不能控制水的用量。水加太多,反应会太剧烈。
√
×
11
④净化:
杂质——H2S、PH3、水蒸气等
通常将气体通过CuSO4溶液除去H2S和PH3,再通过碱石灰除去水蒸气。
H2S + CuSO4 = CuS↓ + H2SO4
⑤收集:
排水集气法
注意:
12
i. 电石工业制法——
生石灰和焦炭在电炉中高温反应
电炉
CaO + 3C CaC2 + CO?
ii. 制取乙炔气体时在导气管口附近塞入少量棉花
目的:为防止产生的泡沫涌入导管。
制取:收集一集气瓶乙炔气体,观察其物理性质
3. 物理性质:
实验 现象
将纯净的乙炔通入盛有KMnO4酸性溶液的试管中
将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
点燃验纯后的乙炔
乙炔是无色、无味的气体,微溶于水
?
?
?
13
4. 乙炔的化学性质:
⑴ 氧化反应:
①可燃性
火焰明亮,并伴有浓烟
2C2H2+5O2 4CO2+2H2O(l)
点燃
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
注意
14
甲烷、乙烯、乙炔的燃烧
C2H4
CH4
C2H2
15
⑵加成反应
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
②被氧化剂氧化
①催化加氢
使酸性KMnO4溶液褪色
△
CH≡CH+H2 CH2=CH2
△
CH2=CH2+H2 CH3—CH3
乙烯
乙烷
溶液褪色
16
⑵使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
使溴水褪色
17
△
CH≡CH+H2O CH3CHO
⑶与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
3.加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
聚乙炔
(制导电高分子材料)
18
实验 现象
将纯净的乙炔通入盛有KMnO4酸性溶液的试管中
将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
点燃验纯后的乙炔
溶液紫色逐渐褪去
溴的颜色逐渐褪去,生成无色易溶于四氯化碳的物质
火焰明亮,并伴有浓烟
实验探究
19
⑴乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
⑵乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
5.乙炔的用途
20
四、炔烃
化学性质(与乙炔相似)
(1)氧化反应
①燃烧:
②与酸性高锰酸钾溶液反应:
酸性高锰酸钾溶液褪色
(2)加成反应
溴水褪色
火焰明亮,伴有大量黑烟
21
第二章 烃和卤代烃
第一节 脂肪烃
炔烃
1
三、炔烃
分子里含有碳碳三键的一类脂肪烃称为炔烃。
1、概念:
2、炔烃的通式:CnH2n-2 (n≥2)
(1)物理性质:随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
(2)化学性质:能发生氧化反应,加成反应。
3、炔烃的通性:
2
1. 乙炔的分子结构:
电子式:
H—C≡C—H
结构简式:
CH≡CH
结构式:
直线型,
空间结构:
分子式:
C2H2
或 HC≡CH
键角1800
球棍模型
比例模型
含有叁键结构的相邻四原子在同一直线上
四、乙炔
3
碳碳叁键属于不饱和键,且一强两弱,易断裂,化学性质较活泼。
乙烷 乙烯 乙炔
348 KJ/mol
615 KJ/mol
812 KJ/mol
【结论】
碳碳键键能对比:
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。说明叁键中有二个键不稳定,容易断裂,有一个键较稳定。
【分析】
4
在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构,请问在炔烃分子中是否也存在顺反异构?
5
甲烷 乙烯 乙炔
结构简式
结构特点
空间结构
CH4
CH2=CH2
CH≡CH
全部单键,
饱和
有碳碳双键,
不饱和
有碳碳三键,不饱和
6
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )
A、6个碳原子有可能在同一直线上
B、6个碳原子有可能在同一平面上
C、6个碳原子不可能在同一直线上
D、6个碳原子不可能在同一平面上
B C
H
H
C=C
H3C
C = C— CF3
7
⑵ 乙炔的实验室制法
CaC2+2H2O C2H2↑+Ca(OH)2
②反应原理:
① 原料:电石(CaC2)与 H2O
2. 乙炔的制法
⑴ 工业制法
——甲烷裂解法
2CH4 CH≡CH +3 H2
1500 ℃
碳化钙
CaC2+2H—OH
C2H2↑+Ca(OH)2 +127KJ
8
③装置特点:
i. 装置不能用启普发生器,改用广口瓶和长颈漏斗
ii. 实验中常用饱和食盐水代替水
固体 +液体 气体
a.碳化钙与水反应较剧烈,难以控反制应速率;
b.放出的大量热量,操作不当会使启普发生器炸裂。
降低碳化钙与水的接触面积,得到平稳的乙炔气流。
反应装置
9
下列那种装置可以用来做为乙炔的制取装置?
A
B
C
D
E
F
固+液,
不需加热
A
B
C
D
E
F
BF
√
√
10
实验室中使用分液漏斗而不使用长颈漏斗,因为长颈漏斗不能控制水的用量。水加太多,反应会太剧烈。
√
×
11
④净化:
杂质——H2S、PH3、水蒸气等
通常将气体通过CuSO4溶液除去H2S和PH3,再通过碱石灰除去水蒸气。
H2S + CuSO4 = CuS↓ + H2SO4
⑤收集:
排水集气法
注意:
12
i. 电石工业制法——
生石灰和焦炭在电炉中高温反应
电炉
CaO + 3C CaC2 + CO?
ii. 制取乙炔气体时在导气管口附近塞入少量棉花
目的:为防止产生的泡沫涌入导管。
制取:收集一集气瓶乙炔气体,观察其物理性质
3. 物理性质:
实验 现象
将纯净的乙炔通入盛有KMnO4酸性溶液的试管中
将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
点燃验纯后的乙炔
乙炔是无色、无味的气体,微溶于水
?
?
?
13
4. 乙炔的化学性质:
⑴ 氧化反应:
①可燃性
火焰明亮,并伴有浓烟
2C2H2+5O2 4CO2+2H2O(l)
点燃
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
注意
14
甲烷、乙烯、乙炔的燃烧
C2H4
CH4
C2H2
15
⑵加成反应
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
②被氧化剂氧化
①催化加氢
使酸性KMnO4溶液褪色
△
CH≡CH+H2 CH2=CH2
△
CH2=CH2+H2 CH3—CH3
乙烯
乙烷
溶液褪色
16
⑵使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
使溴水褪色
17
△
CH≡CH+H2O CH3CHO
⑶与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
3.加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
聚乙炔
(制导电高分子材料)
18
实验 现象
将纯净的乙炔通入盛有KMnO4酸性溶液的试管中
将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
点燃验纯后的乙炔
溶液紫色逐渐褪去
溴的颜色逐渐褪去,生成无色易溶于四氯化碳的物质
火焰明亮,并伴有浓烟
实验探究
19
⑴乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
⑵乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
5.乙炔的用途
20
四、炔烃
化学性质(与乙炔相似)
(1)氧化反应
①燃烧:
②与酸性高锰酸钾溶液反应:
酸性高锰酸钾溶液褪色
(2)加成反应
溴水褪色
火焰明亮,伴有大量黑烟
21
