2020年高二化学选修4人教版 第二章 化学反应速率化学平衡(图象)(共31张PPT)
文档属性
| 名称 | 2020年高二化学选修4人教版 第二章 化学反应速率化学平衡(图象)(共31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 459.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-17 22:00:30 | ||
图片预览


文档简介
(共31张PPT)
化学平衡
常见化学平衡图像问题的处理
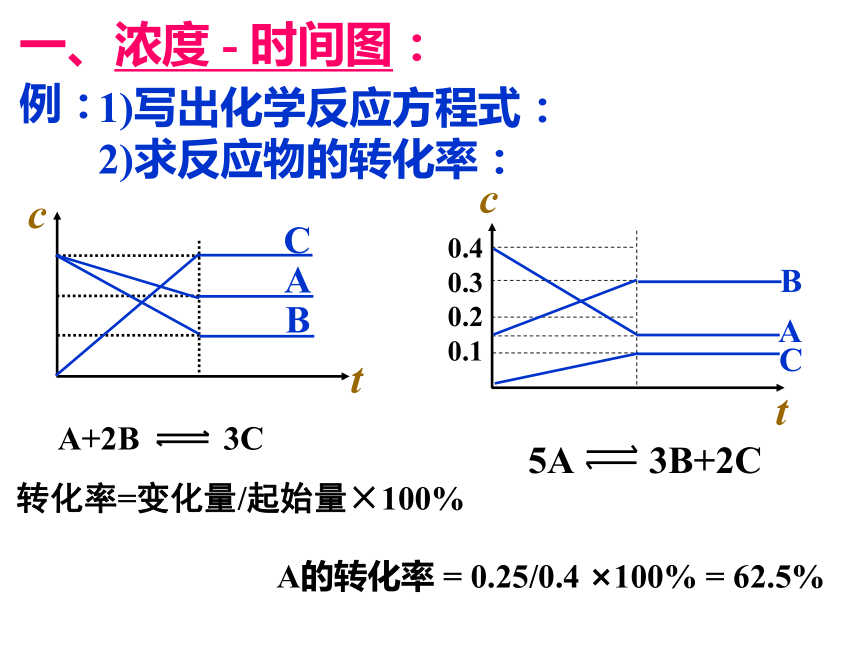
一、浓度 - 时间图:
t
c
C
A
B
1)写出化学反应方程式:
2)求反应物的转化率:
A+2B 3C
转化率=变化量/起始量×100%
A
B
C
t
c
0.4
0.3
0.2
0.1
例:
5A 3B+2C
A的转化率 = 0.25/0.4 ×100% = 62.5%
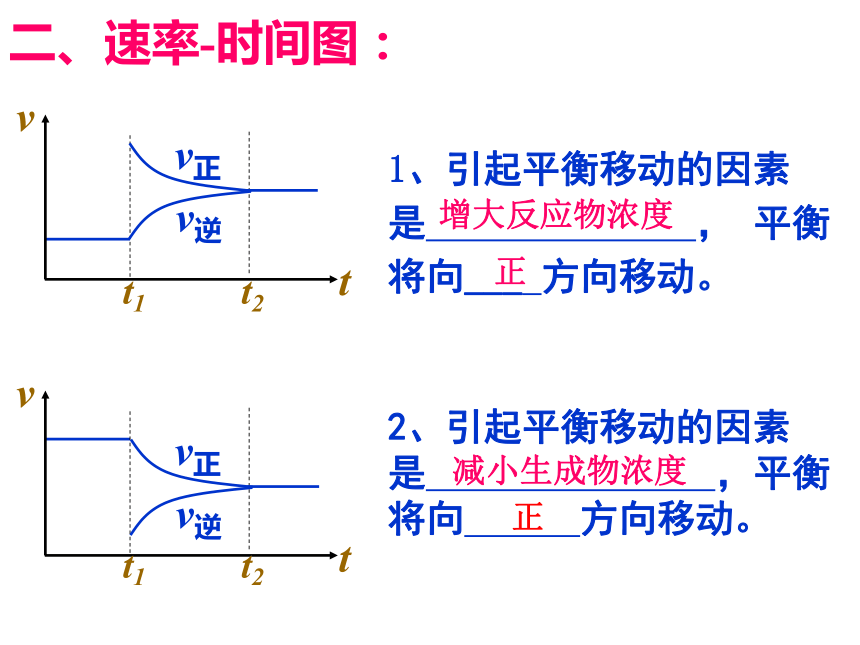
二、速率-时间图:
t
v
v正
v逆
t1 t2
1、引起平衡移动的因素
是 , 平衡将向___ 方向移动。
增大反应物浓度
正
t
v
v正
v逆
t1 t2
2、引起平衡移动的因素是 ,平衡
将向 方向移动。
减小生成物浓度
正
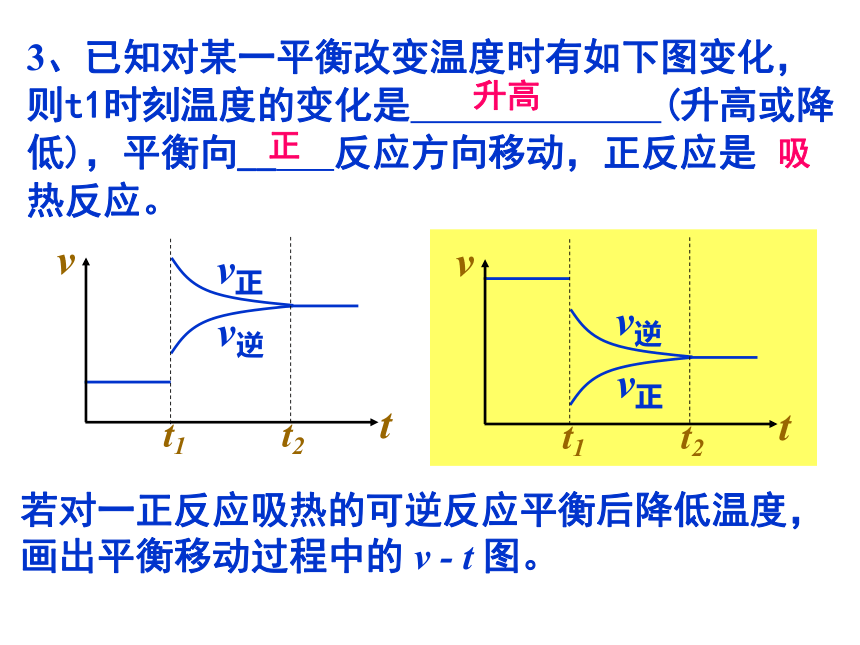
3、已知对某一平衡改变温度时有如下图变化,则t1时刻温度的变化是 (升高或降低),平衡向__ 反应方向移动,正反应是 热反应。
t1 t2
t
v
v正
v逆
升高
正
吸
若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。
t1 t2
t
v
v逆
v正
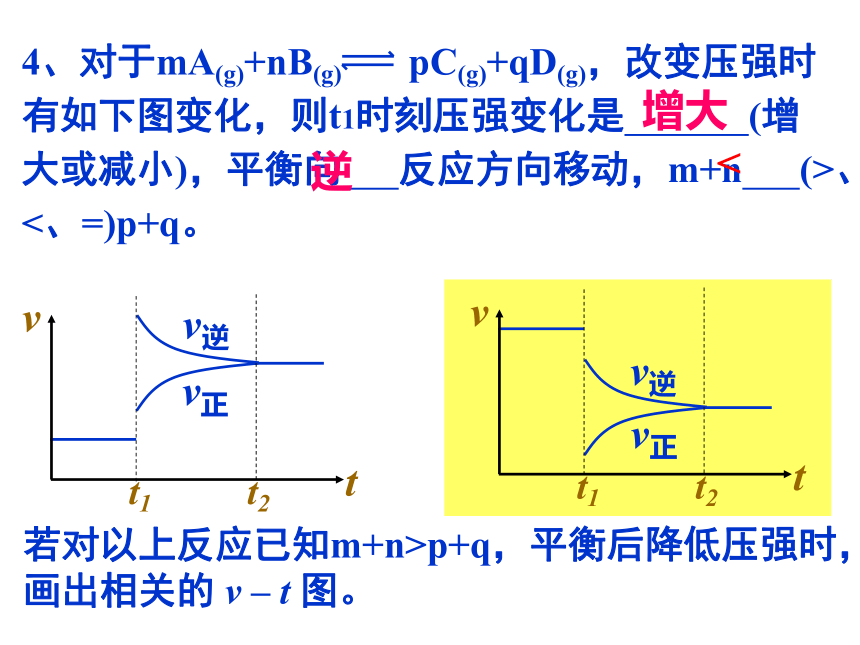
4、对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则t1时刻压强变化是 (增大或减小),平衡向 反应方向移动,m+n (>、<、=)p+q。
v逆
t1 t2
t
v
v正
增大
逆
<
若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
v逆
t1 t2
t
v
v正
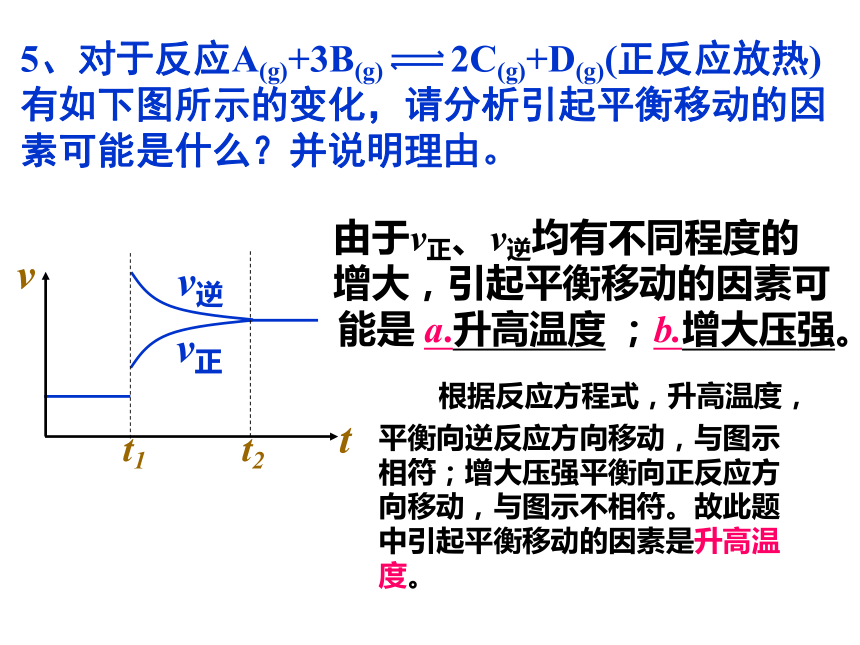
5、对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
由于v正、v逆均有不同程度的
增大,引起平衡移动的因素可
能是 a.升高温度 ;b.增大压强。
根据反应方程式,升高温度,
平衡向逆反应方向移动,与图示
相符;增大压强平衡向正反应方
向移动,与图示不相符。故此题
中引起平衡移动的因素是升高温
度。
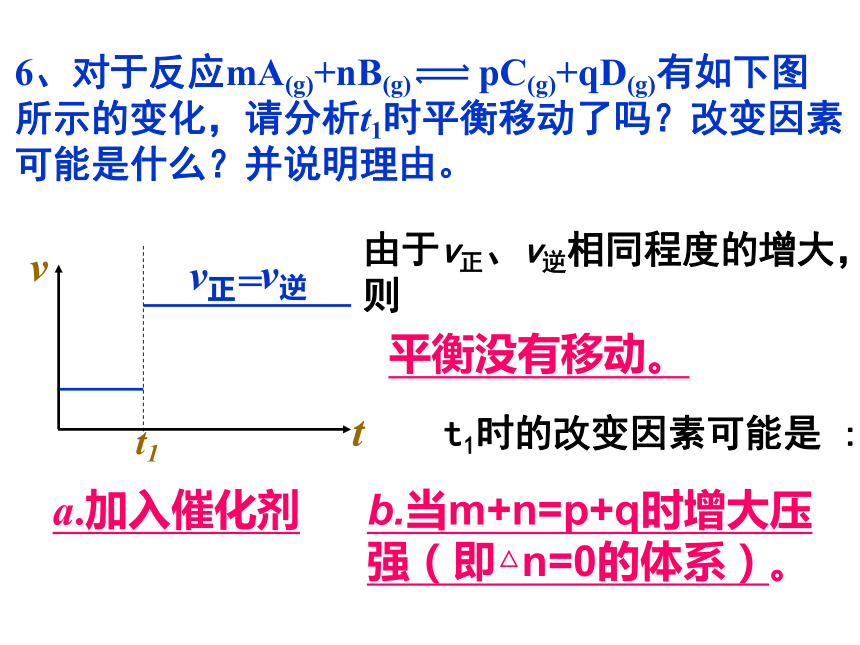
6、对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时平衡移动了吗?改变因素可能是什么?并说明理由。
v逆
t1
t
v
v正
由于v正、v逆相同程度的增大,则
t1时的改变因素可能是 :
a.加入催化剂
b.当m+n=p+q时增大压强(即△n=0的体系)。
平衡没有移动。
=
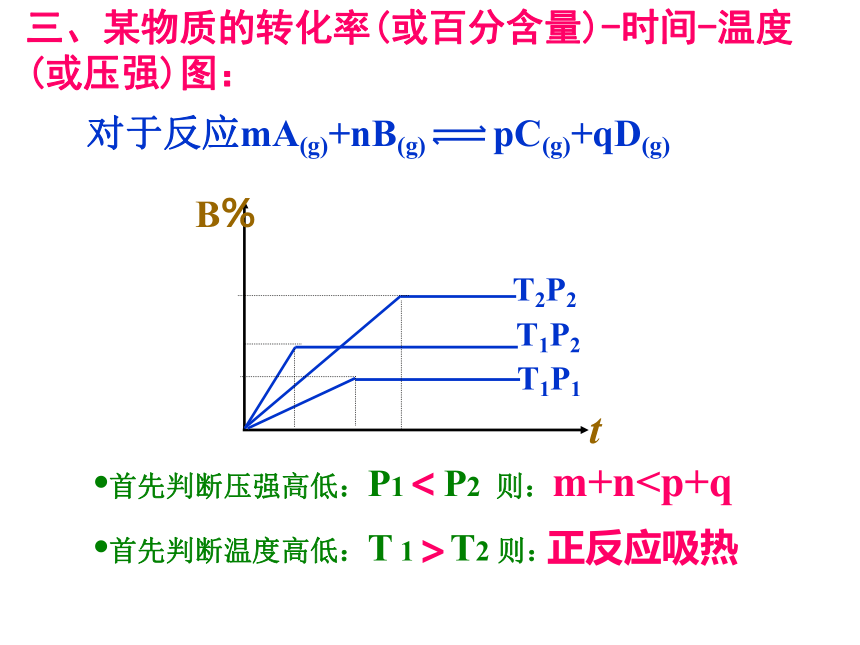
三、某物质的转化率(或百分含量)-时间-温度(或压强)图(先拐先平,温度、压强均更高)
t
A的转化率
T1
T2
对于反应mA(g)+nB(g) pC(g)+qD(g)
T1 T2 正反应吸热
t
B的转化率
P1
P2
P1 P2 m+nt
T1
T2
A%
正反应 热
C%
t
P1
P2
m+n p+q
>
<
放
=
三、某物质的转化率(或百分含量)-时间-温度 (或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
B%
T2P2
T1P2
T1P1
?首先判断压强高低:P1 P2 则:
?首先判断温度高低:T 1 T2 则:
<
>
m+n正反应吸热
P
A%
500℃
200℃
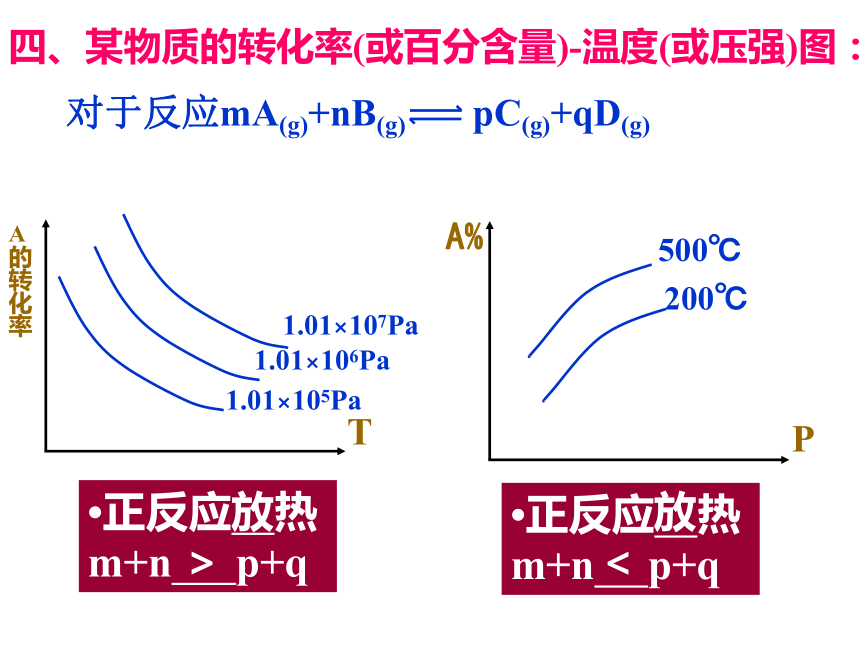
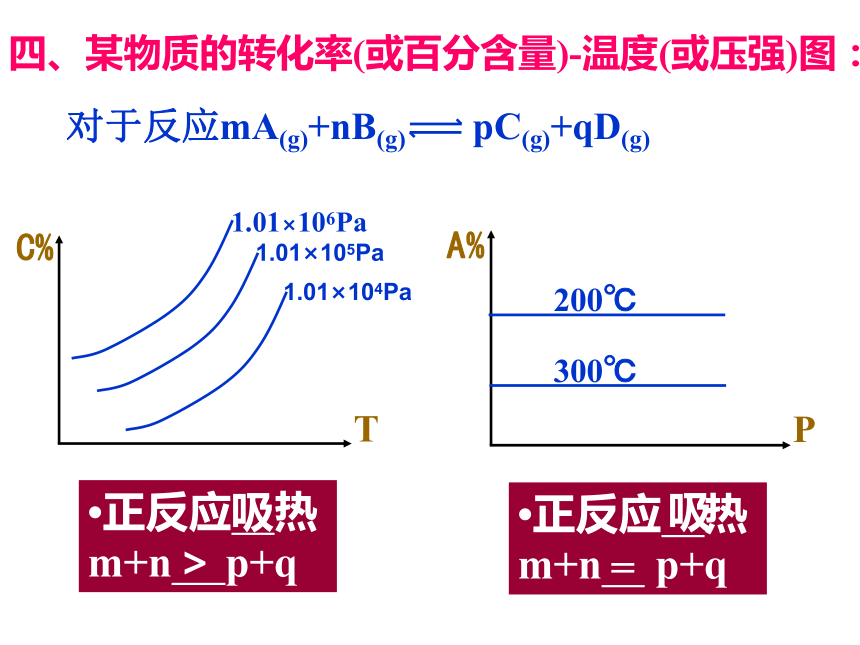
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01×107Pa
1.01×106Pa
1.01×105Pa
?正反应 热m+n p+q
?正反应 热m+n p+q
放
>
放
<
T
C%
1.01×106Pa
1.01×105Pa
1.01×104Pa
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
?正反应 热m+n p+q
P
A%
300℃
200℃
?正反应 热m+n p+q
吸
吸
>
=
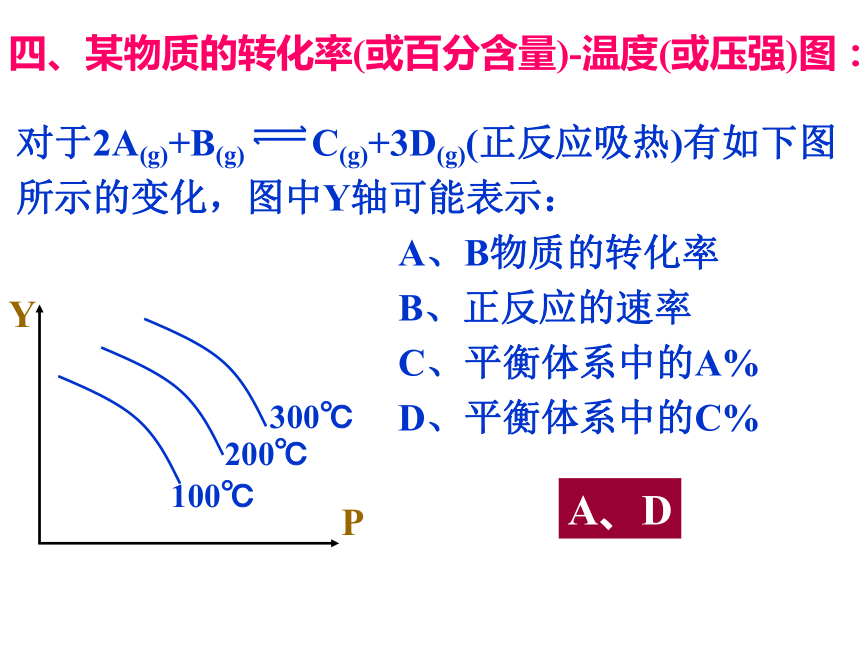
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
P
Y
100℃
200℃
300℃
A、D
五、其它:
T
v
v逆
v正
T1
T2
?正反应 热
T
v
v正
v逆
?正反应 热
T
C%
450℃
?正反应 热
P
A%
P1
?m+n p+q
对于反应mA(g)+nB(g) pC(g)+qD(g)
吸
吸
放
<
图象题步骤:
(1). 看图象:
①.看坐标轴
②.看线的走势
③.看点(即起点、折点、交点、终点),
④.作辅助线(如等温线、等压线、平衡线等),
⑤.看量的变化(如浓度变化、温度变化等)。
(2).想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3).作判断:根据图象中表现的关系与所学规律相对比,作出符合题目要求的判断。
1.在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是 ( )
B
?
2. mA(s) + nB(g) wC(g) + Q (Q>0)的可逆反应,在
恒温的条件下B的百分含量(B%)与压强P的关系如图所
示,有关叙述正确的是 ( )
A.m + n < w
B.n > w
C.X点时混合物的v正 > v逆
D.X点比Y点混合物的反应
速率慢
A
P1
?
CD
t
c
C
A
B
t
v
v正
v逆
t1 t2
反应物浓度减小,生成物浓度增大;变量比等于计量数之比,会书写化学方程式、计算反应物转化率。
t1时刻图象一点连续、一点突跃是浓度变化对平衡影响的特征。
各类图象的归纳小结:
t1 t2
t
v
v正
v逆
v逆
t1
t
v
v正
t1时刻改变的条件:
增大压强或升高温度
t1时刻改变的条件:
加入催化剂;增大压强对△n=0的气体体系;
t
A的转化率
T1
T2
解题思路:
先从拐点向横轴作垂线:先拐先平,先达平衡的线对应的温度、压强更高。
再从拐点向纵轴作垂线,分析温度、压强升高时,转化率或含量的变化,判断平衡移动的方向,从而确定反应的热效应或物质计量数。
t
T1
T2
A%
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
T
v
v正
v逆
两个变量影响平衡:
1、直接看横轴:温度升高,
图象的变化趋势,分析温度
对平衡的影响。
2、再向横轴作垂线(即在等
温时),分析表压强对平衡的
影响。
交点代表平衡,之后能够看出平衡的移动方向。
C%
t
0
T2 P2
T1 P2
T1 P1
例题1. 对于 m A (g) + n B (g) p C (g) △H=Q 有如图所示的变化,则:
①p1与 p2 的关系是 ;
②m + n 与p的关系是 ;
③T1 与 T2的关系是 ;
④Q与 0 的关系是 。
P2 > P1
T2 < T1
m+n > p
0 < Q
例题2. 在某一容积一定的密闭容器中,可逆反应:
A(g)+ B(g) x C(g); ?H <0
符合下列图象(I)所表示的关系。由此推断对图象(II)的正确说法是( )。
A. P3 > P4 , Y轴表示 A 的转化率
B. P3 > P4 , Y轴表示 B的百分含量
C. P3 > P4 , Y轴表示 混合气体密度
D. P3 > P4 , Y轴表示 混合气体平均分子量
C%
t
0
T2 P2
T1 P2
T1 P1
C%
T
0
p3
p4
A D
1:如图所示,反应X(g)+3Y(g) 2Z(g) (正反应为放热反应),在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线应为( )
O
T
p1
p2
Φ(Z)
O
T
Φ(Z)
O
T
Φ(Z)
O
T
Φ(Z)
p1
p1
p1
p2
p2
p2
A
B
C
D
C
2:反应2X(g)+Y(g) 2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如图所示。下述判断正确的是( )
A.T1 B.T1p2
C.T1>T2,p1>p2
D.T1>T2,p1
n(Z)
t
O
T1,p2
T2,p1
T2,p2
C
3、某逆反应为:A(g)+B(g) 3C(g),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数 φ(C)与反应时间t的关系。
⑴若图甲中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。
⑵若图乙中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是 (填“吸热”或“放热”)反应。
⑶若图丙中的a、b两条曲线分别表示在不同压强时的情况,则曲
线 表示的是压强较大时的情况。
φ(C)
φ(C)
φ(C)
0
t
0
0
a
a
b
b
甲
100℃
200℃
乙
丙
t
t
b
吸热
b
4. 如图是某合成氨反应时的反应速率随时间的变化曲线:
(1) t0时反应从哪方开始?向哪个方向进行?
(2) t1、 t2 、 t3时刻分别改变了什么条件? 平衡移动的方
向怎样?
N2 + 3H2 2NH3 (正反应是放热)
5. 用来表示可逆反应2A(g) + B(g) 2C(g) △=Q (Q< 0 ),
正确图像是图中的 ( )
6.对于可逆反应 2AB3(g) A2(g) +3B2(g) (正反应中吸热反应),下列图像正确的是( )
υ
υ逆
υ正
温度
A.
AB3%
100℃
时间
500℃
B.
AB3%
时间
1×106Pa
1×105Pa
C.
AB3%
压强
100℃
500℃
D.
BD
7.在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下同时任其发生反应:A2(g) + 3B2(g) 2AB3(g)。分别 在某一同时刻测得其中AB3所占的体积分数变化如图所示,
下列说法中不正确的是 ( )
A.正反应是放热反应
B.E、F二点尚未达到平衡
C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态
8.可逆反应N2 + 3H2 2NH3 (正反应是放热),从反应开始
经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒
时,又达到新的平衡状态。试根据t2 ~ t3 秒曲线判断,下列图1、
图2所表示的平衡移动方向和变化条件各是什么?
9.某可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是 ( )
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应
B D
化学平衡
常见化学平衡图像问题的处理
一、浓度 - 时间图:
t
c
C
A
B
1)写出化学反应方程式:
2)求反应物的转化率:
A+2B 3C
转化率=变化量/起始量×100%
A
B
C
t
c
0.4
0.3
0.2
0.1
例:
5A 3B+2C
A的转化率 = 0.25/0.4 ×100% = 62.5%
二、速率-时间图:
t
v
v正
v逆
t1 t2
1、引起平衡移动的因素
是 , 平衡将向___ 方向移动。
增大反应物浓度
正
t
v
v正
v逆
t1 t2
2、引起平衡移动的因素是 ,平衡
将向 方向移动。
减小生成物浓度
正
3、已知对某一平衡改变温度时有如下图变化,则t1时刻温度的变化是 (升高或降低),平衡向__ 反应方向移动,正反应是 热反应。
t1 t2
t
v
v正
v逆
升高
正
吸
若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。
t1 t2
t
v
v逆
v正
4、对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则t1时刻压强变化是 (增大或减小),平衡向 反应方向移动,m+n (>、<、=)p+q。
v逆
t1 t2
t
v
v正
增大
逆
<
若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
v逆
t1 t2
t
v
v正
5、对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
由于v正、v逆均有不同程度的
增大,引起平衡移动的因素可
能是 a.升高温度 ;b.增大压强。
根据反应方程式,升高温度,
平衡向逆反应方向移动,与图示
相符;增大压强平衡向正反应方
向移动,与图示不相符。故此题
中引起平衡移动的因素是升高温
度。
6、对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时平衡移动了吗?改变因素可能是什么?并说明理由。
v逆
t1
t
v
v正
由于v正、v逆相同程度的增大,则
t1时的改变因素可能是 :
a.加入催化剂
b.当m+n=p+q时增大压强(即△n=0的体系)。
平衡没有移动。
=
三、某物质的转化率(或百分含量)-时间-温度(或压强)图(先拐先平,温度、压强均更高)
t
A的转化率
T1
T2
对于反应mA(g)+nB(g) pC(g)+qD(g)
T1 T2 正反应吸热
t
B的转化率
P1
P2
P1 P2 m+n
T1
T2
A%
正反应 热
C%
t
P1
P2
m+n p+q
>
<
放
=
三、某物质的转化率(或百分含量)-时间-温度 (或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
B%
T2P2
T1P2
T1P1
?首先判断压强高低:P1 P2 则:
?首先判断温度高低:T 1 T2 则:
<
>
m+n
P
A%
500℃
200℃
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01×107Pa
1.01×106Pa
1.01×105Pa
?正反应 热m+n p+q
?正反应 热m+n p+q
放
>
放
<
T
C%
1.01×106Pa
1.01×105Pa
1.01×104Pa
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于反应mA(g)+nB(g) pC(g)+qD(g)
?正反应 热m+n p+q
P
A%
300℃
200℃
?正反应 热m+n p+q
吸
吸
>
=
四、某物质的转化率(或百分含量)-温度(或压强)图:
对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%
P
Y
100℃
200℃
300℃
A、D
五、其它:
T
v
v逆
v正
T1
T2
?正反应 热
T
v
v正
v逆
?正反应 热
T
C%
450℃
?正反应 热
P
A%
P1
?m+n p+q
对于反应mA(g)+nB(g) pC(g)+qD(g)
吸
吸
放
<
图象题步骤:
(1). 看图象:
①.看坐标轴
②.看线的走势
③.看点(即起点、折点、交点、终点),
④.作辅助线(如等温线、等压线、平衡线等),
⑤.看量的变化(如浓度变化、温度变化等)。
(2).想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3).作判断:根据图象中表现的关系与所学规律相对比,作出符合题目要求的判断。
1.在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是 ( )
B
?
2. mA(s) + nB(g) wC(g) + Q (Q>0)的可逆反应,在
恒温的条件下B的百分含量(B%)与压强P的关系如图所
示,有关叙述正确的是 ( )
A.m + n < w
B.n > w
C.X点时混合物的v正 > v逆
D.X点比Y点混合物的反应
速率慢
A
P1
?
CD
t
c
C
A
B
t
v
v正
v逆
t1 t2
反应物浓度减小,生成物浓度增大;变量比等于计量数之比,会书写化学方程式、计算反应物转化率。
t1时刻图象一点连续、一点突跃是浓度变化对平衡影响的特征。
各类图象的归纳小结:
t1 t2
t
v
v正
v逆
v逆
t1
t
v
v正
t1时刻改变的条件:
增大压强或升高温度
t1时刻改变的条件:
加入催化剂;增大压强对△n=0的气体体系;
t
A的转化率
T1
T2
解题思路:
先从拐点向横轴作垂线:先拐先平,先达平衡的线对应的温度、压强更高。
再从拐点向纵轴作垂线,分析温度、压强升高时,转化率或含量的变化,判断平衡移动的方向,从而确定反应的热效应或物质计量数。
t
T1
T2
A%
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
T
v
v正
v逆
两个变量影响平衡:
1、直接看横轴:温度升高,
图象的变化趋势,分析温度
对平衡的影响。
2、再向横轴作垂线(即在等
温时),分析表压强对平衡的
影响。
交点代表平衡,之后能够看出平衡的移动方向。
C%
t
0
T2 P2
T1 P2
T1 P1
例题1. 对于 m A (g) + n B (g) p C (g) △H=Q 有如图所示的变化,则:
①p1与 p2 的关系是 ;
②m + n 与p的关系是 ;
③T1 与 T2的关系是 ;
④Q与 0 的关系是 。
P2 > P1
T2 < T1
m+n > p
0 < Q
例题2. 在某一容积一定的密闭容器中,可逆反应:
A(g)+ B(g) x C(g); ?H <0
符合下列图象(I)所表示的关系。由此推断对图象(II)的正确说法是( )。
A. P3 > P4 , Y轴表示 A 的转化率
B. P3 > P4 , Y轴表示 B的百分含量
C. P3 > P4 , Y轴表示 混合气体密度
D. P3 > P4 , Y轴表示 混合气体平均分子量
C%
t
0
T2 P2
T1 P2
T1 P1
C%
T
0
p3
p4
A D
1:如图所示,反应X(g)+3Y(g) 2Z(g) (正反应为放热反应),在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线应为( )
O
T
p1
p2
Φ(Z)
O
T
Φ(Z)
O
T
Φ(Z)
O
T
Φ(Z)
p1
p1
p1
p2
p2
p2
A
B
C
D
C
2:反应2X(g)+Y(g) 2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如图所示。下述判断正确的是( )
A.T1
C.T1>T2,p1>p2
D.T1>T2,p1
n(Z)
t
O
T1,p2
T2,p1
T2,p2
C
3、某逆反应为:A(g)+B(g) 3C(g),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数 φ(C)与反应时间t的关系。
⑴若图甲中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。
⑵若图乙中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是 (填“吸热”或“放热”)反应。
⑶若图丙中的a、b两条曲线分别表示在不同压强时的情况,则曲
线 表示的是压强较大时的情况。
φ(C)
φ(C)
φ(C)
0
t
0
0
a
a
b
b
甲
100℃
200℃
乙
丙
t
t
b
吸热
b
4. 如图是某合成氨反应时的反应速率随时间的变化曲线:
(1) t0时反应从哪方开始?向哪个方向进行?
(2) t1、 t2 、 t3时刻分别改变了什么条件? 平衡移动的方
向怎样?
N2 + 3H2 2NH3 (正反应是放热)
5. 用来表示可逆反应2A(g) + B(g) 2C(g) △=Q (Q< 0 ),
正确图像是图中的 ( )
6.对于可逆反应 2AB3(g) A2(g) +3B2(g) (正反应中吸热反应),下列图像正确的是( )
υ
υ逆
υ正
温度
A.
AB3%
100℃
时间
500℃
B.
AB3%
时间
1×106Pa
1×105Pa
C.
AB3%
压强
100℃
500℃
D.
BD
7.在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下同时任其发生反应:A2(g) + 3B2(g) 2AB3(g)。分别 在某一同时刻测得其中AB3所占的体积分数变化如图所示,
下列说法中不正确的是 ( )
A.正反应是放热反应
B.E、F二点尚未达到平衡
C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态
8.可逆反应N2 + 3H2 2NH3 (正反应是放热),从反应开始
经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3秒
时,又达到新的平衡状态。试根据t2 ~ t3 秒曲线判断,下列图1、
图2所表示的平衡移动方向和变化条件各是什么?
9.某可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是 ( )
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应
B D
