2.2化学能转化为电能(第2课时 )同步课件13页
文档属性
| 名称 | 2.2化学能转化为电能(第2课时 )同步课件13页 |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-16 16:55:56 | ||
图片预览



文档简介
(共14张PPT)
第三单元 化学能与电能的转化
化学能转化为电能
第2课 时
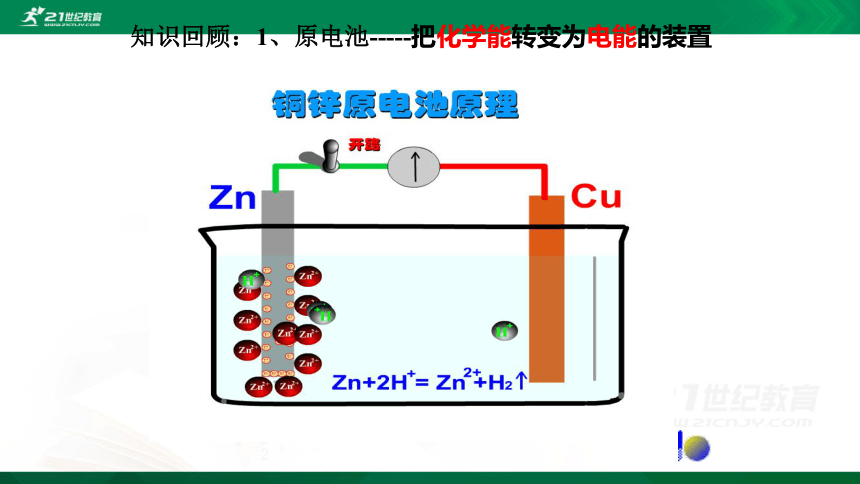
知识回顾:1、原电池-----把化学能转变为电能的装置
工作原理
电极
正
极
负
极
定义:
电子流出(失电子)的一极
电极材料:
较活泼金属
定义:
电极材料:
电子流入(得电子)的一极
较不活泼金属或碳棒
电极
反应
负极:
正极:
电解质溶液中的阳离子得电子,发生还原反应
电极本身失电子,发生氧化反应
电池反应:
两电极反应式相加
电子流动方向:
负极 导线 正极
溶液中离子
移动方向:
阳离子移向正极
阴离子移向负极
负极
正极
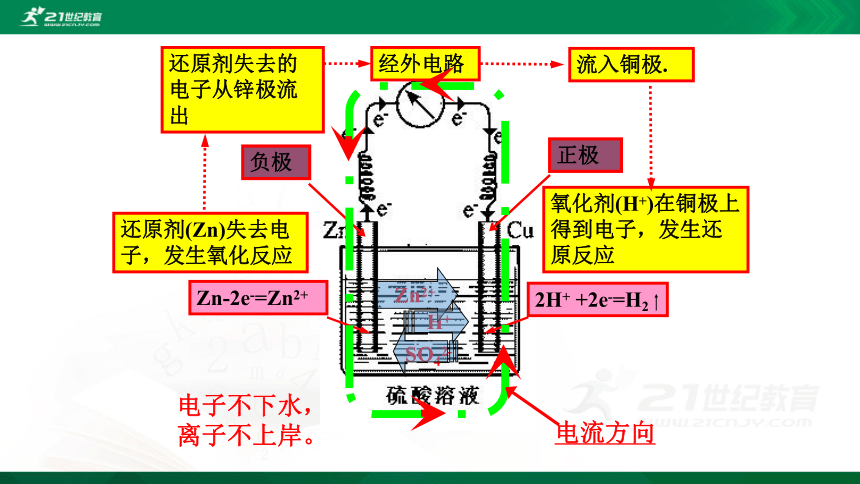
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
电子不下水,
离子不上岸。
2、构成原电池的条件
能自发发生氧化还原反应,同时满足以下三个条件:
①有两种活泼性不同的金属(或一个导电的非金属单质)作电极
②电极材料均插入电解质溶液中
③两极相连形成闭合电路
⑶、电极反应式 :
负极: .
正极: .
负极 ,正极 。
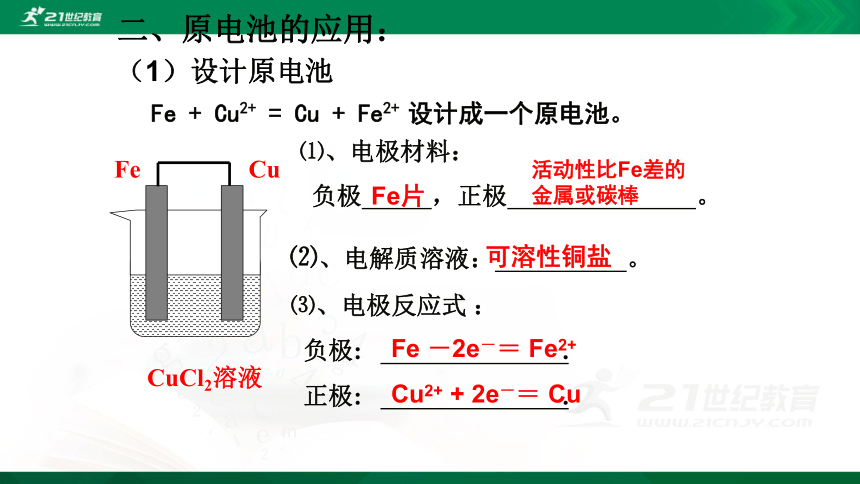
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
⑴、电极材料:
可溶性铜盐
Fe片
活动性比Fe差的金属或碳棒
Fe -2e-= Fe2+
Cu2+ + 2e-= Cu
CuCl2溶液
Fe
Cu
二、原电池的应用:
(1)设计原电池
⑵、电解质溶液: 。
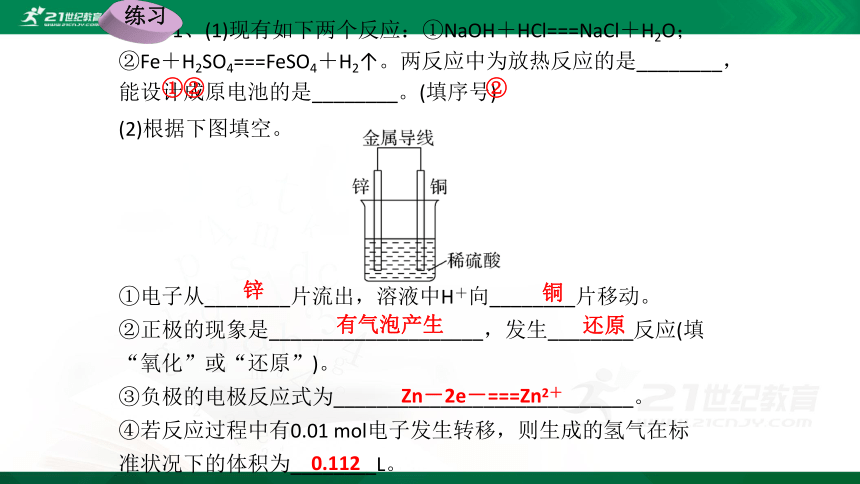
1、(1)现有如下两个反应:①NaOH+HCl===NaCl+H2O;②Fe+H2SO4===FeSO4+H2↑。两反应中为放热反应的是________,能设计成原电池的是________。(填序号)
(2)根据下图填空。
①电子从________片流出,溶液中H+向________片移动。
②正极的现象是____________________,发生________反应(填“氧化”或“还原”)。
③负极的电极反应式为____________________________。
④若反应过程中有0.01 mol电子发生转移,则生成的氢气在标准状况下的体积为________L。
①②
②
锌
铜
有气泡产生
还原
Zn-2e-===Zn2+
0.112
练习
(2)判断金属活泼性
金属活泼性:
负极>正极
在原电池:
金属
性强
负极
发生氧化反应
电子流出
溶解的一极
金属
性弱
正极
发生还原反应
电子流入
有气泡产生的一极
质量增加的一极
2、把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此4种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
②
A>B
C>D
A>C
D>B
练习
3、A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别放入等浓度盐酸中,D比A反应剧烈。将Cu浸入B的盐溶液中无明显变化,如果把Cu浸入C的盐溶液中,有金属C析出。其活动顺序为:( )
A、DCAB B、DABC
C、DBAC D、BADC
B
练习
(3)加快反应速率
粗 Zn
纯 Zn
+H2SO4
快
慢
比如:在锌与稀硫酸反应时,
滴2滴硫酸铜溶液,生成氢气的
速率变快,为什么?
4、等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
练习
A B C D
D
5、在等体积等物质的量浓度适量的稀硫酸a、b,分别加入两支相同的试管中,然后加入过量的两份锌粉,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
练习
A B C D
A
Zn
Cu
ZnSO4
CuSO4
⑴、电极反应式 :
负极: .
正极: .
(2)、总反应:
Zn - 2e-= Zn2+
Cu2+ + 2e- = Cu
Zn + Cu2+=Zn2++Cu
e-
—
+
?
Cl- K+
思考?
盐桥
盐桥的作用?
(1)形成闭合回路,代替两溶液直接接触。
(2)平衡电荷,保持溶液呈电中性
第三单元 化学能与电能的转化
化学能转化为电能
第2课 时
知识回顾:1、原电池-----把化学能转变为电能的装置
工作原理
电极
正
极
负
极
定义:
电子流出(失电子)的一极
电极材料:
较活泼金属
定义:
电极材料:
电子流入(得电子)的一极
较不活泼金属或碳棒
电极
反应
负极:
正极:
电解质溶液中的阳离子得电子,发生还原反应
电极本身失电子,发生氧化反应
电池反应:
两电极反应式相加
电子流动方向:
负极 导线 正极
溶液中离子
移动方向:
阳离子移向正极
阴离子移向负极
负极
正极
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
电子不下水,
离子不上岸。
2、构成原电池的条件
能自发发生氧化还原反应,同时满足以下三个条件:
①有两种活泼性不同的金属(或一个导电的非金属单质)作电极
②电极材料均插入电解质溶液中
③两极相连形成闭合电路
⑶、电极反应式 :
负极: .
正极: .
负极 ,正极 。
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。
⑴、电极材料:
可溶性铜盐
Fe片
活动性比Fe差的金属或碳棒
Fe -2e-= Fe2+
Cu2+ + 2e-= Cu
CuCl2溶液
Fe
Cu
二、原电池的应用:
(1)设计原电池
⑵、电解质溶液: 。
1、(1)现有如下两个反应:①NaOH+HCl===NaCl+H2O;②Fe+H2SO4===FeSO4+H2↑。两反应中为放热反应的是________,能设计成原电池的是________。(填序号)
(2)根据下图填空。
①电子从________片流出,溶液中H+向________片移动。
②正极的现象是____________________,发生________反应(填“氧化”或“还原”)。
③负极的电极反应式为____________________________。
④若反应过程中有0.01 mol电子发生转移,则生成的氢气在标准状况下的体积为________L。
①②
②
锌
铜
有气泡产生
还原
Zn-2e-===Zn2+
0.112
练习
(2)判断金属活泼性
金属活泼性:
负极>正极
在原电池:
金属
性强
负极
发生氧化反应
电子流出
溶解的一极
金属
性弱
正极
发生还原反应
电子流入
有气泡产生的一极
质量增加的一极
2、把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此4种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
②
A>B
C>D
A>C
D>B
练习
3、A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别放入等浓度盐酸中,D比A反应剧烈。将Cu浸入B的盐溶液中无明显变化,如果把Cu浸入C的盐溶液中,有金属C析出。其活动顺序为:( )
A、DCAB B、DABC
C、DBAC D、BADC
B
练习
(3)加快反应速率
粗 Zn
纯 Zn
+H2SO4
快
慢
比如:在锌与稀硫酸反应时,
滴2滴硫酸铜溶液,生成氢气的
速率变快,为什么?
4、等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
练习
A B C D
D
5、在等体积等物质的量浓度适量的稀硫酸a、b,分别加入两支相同的试管中,然后加入过量的两份锌粉,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
练习
A B C D
A
Zn
Cu
ZnSO4
CuSO4
⑴、电极反应式 :
负极: .
正极: .
(2)、总反应:
Zn - 2e-= Zn2+
Cu2+ + 2e- = Cu
Zn + Cu2+=Zn2++Cu
e-
—
+
?
Cl- K+
思考?
盐桥
盐桥的作用?
(1)形成闭合回路,代替两溶液直接接触。
(2)平衡电荷,保持溶液呈电中性
