沪科版化学高二年级第二学期11.1碳氢化合物的宝库——石油(共115张PPT)
文档属性
| 名称 | 沪科版化学高二年级第二学期11.1碳氢化合物的宝库——石油(共115张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-17 22:05:18 | ||
图片预览










文档简介
(共115张PPT)
1
认识碳氢化合物的多样性
第 11 章
2
什么叫有机物?
1、定义:
2、组成元素:
含碳元素的化合物为有机化合物,简称有机物。
碳、氢、氧、氮、硫、磷、卤素等。
但碳的氧化物、碳酸、碳酸盐、碳的金属化合物等看作无机物。
主要元素
其他元素
熟悉的有机物有哪些?
3
3、有机物的特点
●种类繁多;
●一般难溶于水、易溶于有机溶剂;
●多数是非电解质,不易导电;熔沸点较低;
●容易燃烧,受热易分解;
●有机反应复杂、副反应多、反应速度慢,常需催化剂;
★ 有机物的结构一般是碳原子之间或与其它原子间以共价键结合成分子,分子聚集成分子晶体。
4
有机物都是从有机体中分离出来的物质吗?
★不是,1824年,德国化学家维勒将无机物氰酸铵转化为有机物尿素(人工合成的第一种有机物) ,打破了只能从有机体中取得有机物的观念。
人们不但能合成自然界里已经存在的许多有机化合物,而且还能合成许多自然界里并不存在的、性能优良的有机化合物,如在1965年,我国科学家在世界上第一次合成了具有生命活力的蛋白质——结晶牛胰岛素,有机化合物与无机化合物的界限也随之消失。
1828年,德国人维勒(Wohler)通过加热氰酸铵首次用人工的方法制得了尿素:
NH4CNO CO(NH2)2
△
氰酸铵 尿素
(无机物) (有机物)
(1800~1882)
有机物性质特点(对比无机物)
有机物 无机物
大多数有机物都能燃烧
(如:酒精、汽油、液化气、苯等;少数不能燃烧也有) 而无机物一般不易燃烧
很多有机物受热易分解
(如:蔗糖、淀粉受热会炭化等) 热稳定性相对较高
1、易燃烧、受热易分解
有机物性质特点(对比无机物)
有机物 无机物
大多为非电解质
(如:酒精、蔗糖等;也有例外,如醋酸是弱电解质) 而无机物中酸、碱、盐等都是电解质
有机物熔沸点一般较低
(很多是气体、液体或低熔点的固体) 很多物质熔沸点较高
2、大多为非电解质、熔沸点较低
思考:为什么有机物有这一特点?
有机物性质特点(对比无机物)
有机物 无机物
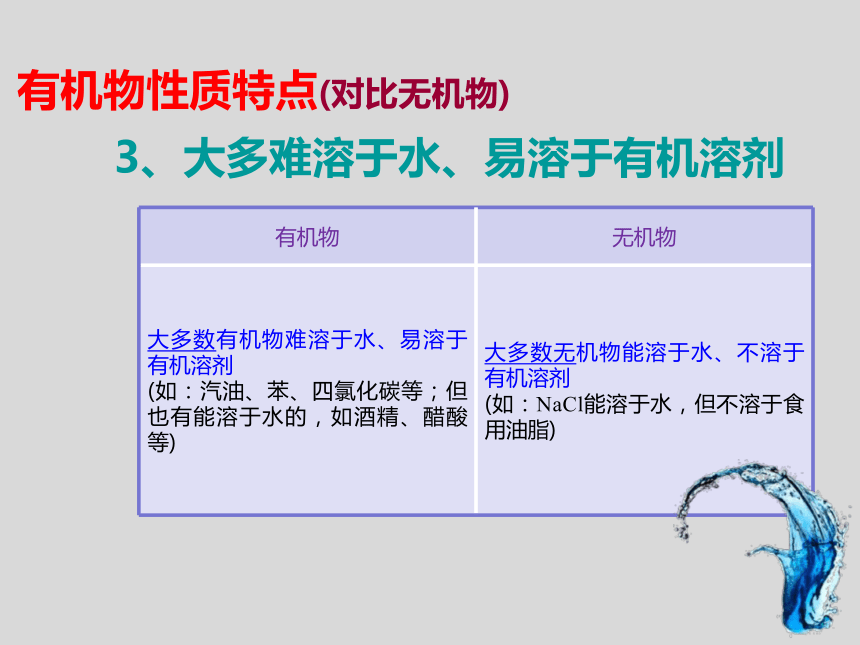
大多数有机物难溶于水、易溶于有机溶剂
(如:汽油、苯、四氯化碳等;但也有能溶于水的,如酒精、醋酸等) 大多数无机物能溶于水、不溶于有机溶剂
(如:NaCl能溶于水,但不溶于食用油脂)
3、大多难溶于水、易溶于有机溶剂
有机物性质特点(对比无机物)
有机物 无机物
大多数有机反应速率慢
(如:酿酒、细胞老化等;也有如燃烧、爆炸反应很快) 无机反应一般反应速率较快
(如:离子反应瞬间完成)
大多数有机反应伴随副反应,因此副产物也多,产率较低
(有机反应产物的产率能达到60~70%就已经很高了) 无机反应一般无副反应
(无机反应 产率一般可达 90~100%)
4、反应速率慢,副反应多、
副产物多、产率低
有机物种类繁多、数目庞大、结构复杂
构成有机物的元素主要为C、H,此外还有O、N、P、S、X等元素。但有机物的数量却非常庞大并且增加很快。
据统计,在1880年,有机物数目不过1.2万种;1910年约15万种;1940年约50万种;1961年约175万种;1978年约400万种;1984年约700万种;现在当在1000万种以上。这一数目仍在增长。
而几乎所有的元素都可形成无机物(是组成有机物元素的几十倍),但无机物的数目仅几十万种左右。
有机物结构特点
电子式 结构式
C
H
H
H
H
C
.
.
.
.
有机物的种类为什么如此繁多?
奥秘就在碳原子的成键方式上
有机物结构特点
H
.
H
.
H
.
H
.
碳原子有4个价电子,可以跟其它原子形成4根共价键;
有机物结构的两条重要规则:
有机物结构特点
碳原子之间能以共价键结合成键
碳碳之间可以形成单键、双键、叁键
碳原子相互连接可形成碳链或碳环
有机物结构特点
思考:有机物中碳是四根键,那氢、
氧、氯分别又是几根键呢?
举例:四个碳以单键结合形成的有
机物的可能碳链结构
有机物种类繁多的其它原因
有机物分子中含碳数可以很多
例: 维生素B12的分子式为C63H90N14O14PCo
蛋白质、淀粉等高分子有机物的分子一般由数万至上亿个原子组成
而无机物的分子一般只有几个原子,至多几十个原子
有机物结构特点
有机物种类繁多的其它原因
同分异构现象普遍
相同的分子式可以形成不同的结构
C4H10有2种结构,C5H12有3种结构,
C6H14有5种结构,C10H22有75种结构,
C20H42有_______种结构
有机物性质不仅由其组成元素决定,更主要的是由其分子的构造决定,即结构决定性质
有机物结构特点
366319
动植物体:天然有机物
煤干熘:煤焦油(含芳香族化合物)
石油化工:石油主要是烷烃和少量烯烃、环烷烃
天然气:主要成份是甲烷
有机物的来源
按组成元素分
有一类有机物仅由碳、氢两种元素组成,这类有机物称为碳氢化合物,又称烃。
有机物的分类
H
C
t
īng
q
àn
烃字的由来:
最简单的有机物—烃
t
īng
最简单的有机物—烃
烃:只由碳、氢两种元素组成
的有机物称为烃,也称为
碳氢化合物。
根据结构的不同,烃可分为烷
烃、烯烃、炔烃、芳香烃等
最简单的烃是甲烷
甲烷
沼气—池沼底部
坑气—煤坑或坑道(瓦斯)
天然气—某些地方地下深处
俗名
最简单的烃—甲烷
甲烷是种温室气体
联合国报告称:牛排放的废气是导致全球变暖的最大元凶。其屁里含有大量甲烷,甲烷的温室效应是二氧化碳的20倍。
阿根廷人为环保收集牛屁做实验。废物利用,做燃气灶的燃料
甲烷的物理性质
甲烷的物理性质有哪些?
无色、无味气体,密度比空气小(分子量16),极难溶于水
燃烧现象:明亮的淡蓝色火焰(无烟),
放出大量的热。
注意:甲烷在点燃之前要检验纯
度,否则可能发生爆炸。
甲烷的化学性质
1、氧化反应(可燃性)
CH4 + 2O2 CO2 + 2H2O
点燃
CH4 C + 2H2
高温
2、化学性质较稳定
与强酸、强碱或强氧化剂一般不反应
甲烷不能使酸性的高锰酸钾溶液褪色
甲烷不能使溴水褪色
3、高温分解
隔绝空气加热到1000℃以上
甲烷的化学性质
4、取代反应
实验录像
实验现象:
黄绿色逐渐消褪,
试管内液面上升,
试管内壁有油状物生成。
甲烷的化学性质
CH4 + Cl2 CH3Cl + HCl
光照
CH3Cl + Cl2 CH2Cl2 + HCl
光照
CH2Cl2 + Cl2 CHCl3 + HCl
光照
CHCl3 + Cl2 CCl4 + HCl
光照
一氯甲烷(g)
二氯甲烷(l)
三氯甲烷(氯仿)(l)
四氯甲烷(四氯化碳)(l)
如何看待有机反应的过程?
4、取代反应
实验录像
甲烷的化学性质
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
——取代反应
有机反应
有机反应可以看作由断键和成键两个过程组成
取代反应也是甲烷这类烷烃的特征反应
有机反应
取代反应和置换反应有什么区别呢?
取代反应 置换反应
生成物中一般没有单质 产物一定是单质与化合物
反应一般比较复杂,可逆,逐步取代 反应一步完成
产物复杂 产物简单
注意点:
逐步取代(第一步为主)
产物一定是混合物
暗处不发生反应,光照下才能反应,若日光直射,会发生爆炸
卤素水溶液(如氯水、溴水)不取代
产物中HCl含量最多
甲烷的化学性质
4、取代反应
实验录像
猜想1
平面正方形
猜想2
空间正四面体
○ ○
× ○
○ ○
× ○
○ ○
○ ○
甲烷的分子结构
已知事实:
1、所有C-H键键长相等
2、所有C-H键之间键角相等
3、一氯甲烷只有一种
4、二氯甲烷只有一种
5、三氯甲烷只有一种
6、四氯化碳只有一种
甲烷的分子结构
C
Cl
H
Cl
H
C
Cl
Cl
H
H
二氯甲烷到底有几种结构?
以碳原子为中心, 四个氢原子为顶点的
正四面体
键角:109°28′
甲烷的分子结构
烷烃
名称 分子式 结构式 结构简式
甲烷 CH4 CH4
乙烷 C2H6 CH3-CH3
或
CH3CH3
丙烷 C3H8 写写看
丁烷 C4H10 写写看
这些名称中有“烷”的烃,结构有何相似之处?
烷烃
C4H10
C2H6
C3H8
CH4
结构特点:
碳原子之间都以单键呈链状相连
碳原子的剩余价键都和氢结合达饱和
符合这类结构特点的烃称为
饱和链烃或烷烃
烷烃
思考:烷烃这一系列物质,我们如何
用一个通式来表示呢?
CnH____
2n+2
练习:写出十八烷的分子式
烷烃
C4H10
C2H6
C3H8
CH4
思考:下列烃中哪些属于烷烃?
烷烃
名称 分子式 结构式 结构简式
甲烷 CH4 CH4
乙烷 C2H6 CH3-CH3
或
CH3CH3
丙烷 C3H8 CH3―CH2―CH3
或CH3CH2CH3
丁烷 C4H10 CH3―CH2―CH2―CH3或CH3CH2CH2CH3或CH3(CH2)2CH3
烷烃
从碳氢原子构成上看,烷烃分子之间的差异有何规律?
锯齿形
结构相似,分子组成上相差一个或若干个CH2原子团的化合物,互称为同系物。
同系物也可理解为同一类别的物质,或者说所有的烷烃都是同系物。
同系物
C4H10
CH4
C2H6
C3H8
烷烃的性质
烷烃物理性质递变规律
℃
沸点
熔点
甲 乙 丙 丁 戊 己 庚 辛 壬 癸
密度
g/cm3
丙 丁 戊 己 庚 辛 壬 癸
随碳原子数增加,烷烃总体上:
熔沸点依次升高 (C4以下烷烃为气态)
密度依次增大 (均小于1)
烷烃均不溶于水
烷烃的性质
烷烃化学性质相似
1、氧化(可燃)
2、较稳定
不能使酸性高锰酸钾褪色
不能使溴水褪色
3、受热分解
4、光照取代
CnH2n+2 + ______O2 →____CO2 +______H2O
点燃
R-H + Cl2 → R-Cl + HCl
光照
有机物的命名
有机物种类繁多,超过千万
存在很多“同分异构”现象
如:C4H10在实际测定中发现有两种沸点不同的丁烷
见表
正丁烷、异丁烷是两种不同的物质
因此必须对有机物进行有效命名
性质 丁烷1 丁烷2
熔点/℃ -138.4 -159.6
沸点/℃ -0.5 -11.7
密度/g·cm-3 0.5788 0.557
取代基
CH4分子失去一个H原子,
形成甲基 -CH3
CH3CH3分子失去一个H原子,
形成乙基 -CH2 CH3
烷烃分子(CnH2n+2)失去一个H原子,
形成烷基 -CnH2n+1
烃分子(R-H)失去一个H原子,
形成烃基 -R
这些基团是电中性的原子团,不是离子
有机物的命名
烷烃的命名
直链烷烃的命名
×烷
甲 乙 丙 丁 戊 己 庚 辛 壬 癸
十一、十二
习惯命名法
冠以字头“正”“异”“新”
“正”是指不含支链的直链烷烃
有机物的命名
烷烃的命名
思考:随碳原子数增加,同分异构现象
更多,习惯命名法还合适吗?
系统命名法
直链烷烃:同前,但不加“正”
a.选碳原子最多的碳链作为主链(最长碳链),
将支链作为取代基
有机物的命名
系统命名法
具有支链的烷烃:
b.若最长碳链不止一条,则选择取代基较小
的一条作主链
步骤一:确定主链
步骤一:确定主链
步骤二:主链碳原子编号,取代基定位
a.编号原则:使取代基位置最小(一个或多个)
有机物的命名
系统命名法
具有支链的烷烃:
b.若有多个取代基且位置相同,则从较小的
取代基一端开始编号
步骤一:确定主链
步骤二:主链碳原子编号,取代基定位
步骤三:以取代基位置和主链碳原子数
目命名该有机物
a.注意书写形式(短线)
有机物的命名
系统命名法
具有支链的烷烃:
b.相同取代基合并(位置、个数、逗号)
不同取代基,小前大后(分隔符号)
有机物的命名
练习:用系统命名法命名
正丁烷、异丁烷
正戊烷、异戊烷、新戊烷
系统命名法
与习惯命名法的差异:
直链一般不加“正”
……×烷,只包含主链碳原子
CH2 CH2 CH CH2 CH2
CH3
CH3
CH2
CH3
CH3
CH3
CH3 CH C CH3
CH3
有机物的命名
练习:用系统命名法命名下列烷烃
CH3—CH—CH2—CH—CH3
| |
CH2 CH2
| |
CH3 CH3
有机物的命名
练习:根据命名写出烷烃的结构简式
2,3-二甲基丁烷
2,3-二甲基-4-乙基己烷
练习:下列烷烃命名是否正确?
若不正确,请正确命名。
① 2,5-二甲基庚烷
② 1,3-二甲基戊烷
③ 2,2-二乙基丁烷
④ 2,3,3-三甲基丁烷
有机物的命名
两种常见命名错误:主链找错
取代基位置没有最小
同分异构体
分子式相同,结构不同的现象,
称为同分异构现象
具有同分异构现象的化合物,
互称为同分异构体
写出C4H10 、C5H12的同分异构体
下列概念能之前区分吗?
同分异构体、同系物
同素异形体、同位素
同分异构体
思考:下列烷烃中哪些是同分异构体?
哪些是同一物质?
可通过命名来加以确认
同分异构体
练习:写出C6H14 的同分异构体
并命名
*写出C7H16 的同分异构体(9种)
碳链异构
类别异构
位置异构
同分异构体
练习:写出一氯丁烷(C4H9Cl)的同分
异构体
找“等效”碳原子
*练习:写出二氯丁烷(C4H8Cl2)的同分
异构体
58
11.1 碳氢化合物的宝库—石油
一、工业的血液和炼油
1、石油是重要的能源和宝贵的资源
想一想:
为什么把石油称为“工业的血液”?
【查资料】
石油的形成及物理性质P5
(1)物理性质: 石油呈黑色或深棕色,有特殊气味,不
溶于水,密度比水稍小,没有固定的熔点和沸点。P5
(2)元素组成:C、H、 N、 O、S等
(3)成分:烷烃、环烷烃和芳香烃组成的混合物
(4)炼制:分馏、裂化、重整和精制
59
想一想:
互溶的液体如何分离? 根据什么?
例如: 酒精和水的分离。
(蒸馏)
(根据沸点不同)
蒸 馏 烧 瓶
冷 凝 管
尾接管
锥 形 瓶
温度计
酒 精 灯
铁架台
冷凝水出口
冷凝水进口
铁圈、石棉网
大量生物死亡后沉积到海底
石油和天然气形成
石油和天然气向上移动
形成
油层和气层
形成
断层
石油的形成
石油
石油
石油主要含碳、氢元素(少量O、S、N等)
石油的主要成分是烷烃、环烷烃和芳香烃
石油是黑色或深棕色可燃性粘稠液体,有特殊气味,不溶于水,密度比水小,没有固定熔沸点
石油
石油中各种烃的性质差别很大,只有通过分离才有利用的价值
中石油化工厂
石油
石油的炼制
原油成分复杂,还含水和一些盐类等,含水多炼制时浪费燃料,含盐多易腐蚀设备。
所以原油一般先经脱水,脱盐等处理后才能进行炼制。
石油的炼制有分馏、裂化、裂解。
石油
石油的炼制—分馏
蒸馏烧瓶
温度计
冷凝管
接液管
锥形瓶
分馏是蒸馏原理的应用
蒸馏是利用沸点不同,分离
(互溶)液体的操作
分馏是物理变化
石油
石油的炼制—分馏
分馏通过加热气化、冷凝后,分离出沸点范围不同的混合物(馏分)
蒸馏通过加热气化、冷凝,把液态混和物中沸点较低的成分先分离出来
(控制温度点、产物较纯)
石油
石油的炼制—分馏
分馏塔内各部位温度如何分布?
由于烷烃的沸点随碳原子数增加而升高,所以产物在分馏塔内分布有何规律?
常压分馏
防止温度过高炭化结焦
减压分馏
碳原子数:少———→多
教材P6课堂实验
石油
石油的炼制
目的:提高轻质油(汽油)产量
重油(原料) → 轻质油
碳多 → 碳少
大分子 → 小分子
长链 → 短链
裂化是化学变化
原理:
热裂化
催化裂化
—裂化
C16H34→C8H18+C8H16
十六烷 辛烷 辛烯
△
石油
(深度裂化)
得到碳链更短的小分子烃(C2~C3)
裂解气(含乙烯等不饱和烃)
乙烯的产量是衡量石油工业发展程度的标志
石油的炼制
—裂解
石油
石油的炼制—重整
通过使用催化剂等方法使碳链结构发生改变,例如直链变支链,直链变苯环等,以提高产品质量
烃分子式的确定
例:某气态烃含碳80%,相同条
件下对氢气的相对密度为15,
求该烃的分子式。
质量=物质的量×摩尔质量
质量比=物质的量比×摩尔质量比
碳氢原子最简比——最简式
其它条件(分子量、相对密度、密度等)
烃分子式的确定
例:标准状况下,2.24L某气态烃(密度
为1.34 g/L)充分燃烧后,先通过无
水氯化钙,质量减少5.4g,再通过
NaOH溶液,质量又减少了8.8g,
求该烃分子式。
(若将 “某烃”改为“某烷烃”或
“某有机物” ,又该如何解?)
设烃的分子式为CXHY
写出燃烧方程式
烃分子式的确定
质量比=物质的量比×摩尔质量比
分子量、相对密度、密度等其它条件
方法一
方法二:设通式,根据燃烧方程式
烃分子式的确定
*例:20℃时20mL某气态烃与过量O2完全燃烧后,将产物通过浓硫酸,再恢复到原来温度,气体体积减少了50mL,剩余气体再通过NaOH溶液,又减少40mL,求该烃分子式。
提示:可考虑用“差量法”
74
问:
如何分离由多种液体混合而成的石油呢?
分馏出来的各种成分,每一种馏分仍然是
多种碳氢化合物的混合物。
(2)分馏:
(3)馏分:
(1)原料:
经过脱水、脱盐的石油。
(4)设备:
分馏塔
利用蒸馏原理得到不同沸点范围的蒸馏产物。
2. 石油的分馏
(物理变化)
75
分馏原理:石油在加热时,分子中碳原子数少的低沸点烃受热先汽化,经过冷凝先分离出来。随着温度的升高,分子中碳原子数多的高沸点烃受热再汽化,再经过冷凝,也分离出来。经过多次加热和冷凝,就可在不同的温度的范围把石油分成不同的蒸馏产物。
看实验
76
想一想:
石油分馏塔的哪个出口的馏分沸点最低?
石油产品及用途 P7
思考:
需求很大的汽油和太多的重油之间如何转化?
分馏产品中哪一馏分用量最大?
汽油
77
3、石油的裂化:
提高汽油产量
提高汽油产量和质量
看实验
提高汽油产量
裂化
热裂化
催化裂化
裂解
就是深度裂化
将重油通过隔绝空气高温加热(或使用催化剂)的方法把相对分子质量大、沸点较高的烃转化成相对分子质量较小、沸点较低的烃作燃料油。
78
烃——仅由碳和氢元素组成的化合物。
(也叫碳氢化合物)分子式为 CxHy
甲烷(CH4)为最简单的烃
判断下列有机物是否是烃?
C2H6O C6H12O6 C4H8
CH3Cl CO(NH2)2 C2H2
79
池沼底部产生的沼气。
煤矿坑道产生的坑气。
地下深处蕴藏的天然气(一般含CH480~97%)。
1、甲烷在自然界里的存在:
二、甲烷
甲烷俗称沼气、坑气,是天然气的主要成分。
这些气体中的甲烷都是在隔绝空气的条件下,
由植物残体经过某些微生物发酵的作用而生成的。
80
天然气是当今世界上最重要的气体化石燃料。我国是最早利用天然气的国家。
81
2、甲烷的物理性质
(1)无色、无味的气体;
(2)密度比空气小,?=0.717g/L(S.T.P)
(密度求算公式:M=22.4 ?)
(3)极难溶于水。
3、甲烷的化学性质
通常情况下,甲烷比较稳定,一般不和强酸、强碱、强氧化剂等起反应。(不能使溴水、酸性高锰酸钾溶液褪色)
82
(1)氧化反应
纯净的甲烷在空气中安静地燃烧(淡蓝色火焰),放出大量的热。
甲烷是一种洁净的气体燃料。(高效、低耗、污染小)
注意
甲烷在点燃之前要验纯,否则可能发生爆炸。
83
(2)受热分解
甲烷在隔绝空气并加热到10000C的条件下分解
CH4 C + 2 H2
高温
此法制取炭黑和氢气
●炭黑是橡胶工业的重要原料,是黑色颜料、油漆、涂料的重要着色剂。
84
甲烷与氯气的反应
(1)反应装置(如图)
(3)实验现象:
(2)反应条件:光照
试管中液面上升
气体黄绿色变浅
试管内壁有油状液滴生成
85
(1)
(2)
(3)
(4)
一氯甲烷(气体)
二氯甲烷(液体)
三氯甲烷(液体)
四氯甲烷(液体)
甲烷与氯气反应:
烃分子中的氢原子被卤素原子取代后所形成的化合物叫做卤代烃。
86
(3)取代反应:
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应
87
1.取代反应条件——光照。
2.反应物状态:纯卤素
(e.g. 与氯气取代,与氯水不取代。)
3、甲烷的取代反应是分步且连锁进行的,所以产物是几种氯代物的混合物。
注意:
88
取代反应与置换反应的区别
取代反应
置换反应
适用于有机反应
适用于无机反应
反应物、生成物中不一定有单质
反应物、生成物中一定有单质
逐步取代 ,很多反应是可逆的
反应一般是单向进行
反应能否进行受催化剂、温度、光照等外界条件影响较大
在水溶液中进行的置换反应遵循金属或非金属的活动顺序
4、甲烷的用途:作燃料、制卤代烃、炭黑
89
5、甲烷的结构
电子式: 结构式:
化学式:
球棍模型
比例模型
以碳原子为中心, 四个氢原子为顶点的正四面体的立体结构。
键角:109 28
。
,
C
·
·
·
·
×
×
×
×
H
H
H
H
C
H
H
H
H
CH4
90
(1)药品:无水醋酸钠和碱石灰
(2)原理:
(3)反应条件:固固加热
(4)发生装置:同制氧气、氨气
(5)干燥:浓硫酸
(6)收集:排水集气法、向下排气法
(7)检验:燃烧产物,火焰为淡蓝色;生成的气体不能使溴水、酸性高锰酸钾溶液褪色。
CaO
△
CH3COONa+NaOH → CH4+Na2CO3
6、甲烷的实验室制取
91
分析它们的结构有什么共同点?
92
1、定义:碳原子之间都以单键结合成链状,剩余
的价键全部跟氢原子相结合,使每个碳
原子的化合价都已充分利用而达到饱和。
这种烃叫“饱和链烃”或称烷烃。 P11
特点:单键、链状、饱和
注意:链状包括直链和含支链的链。
如:C-C-C-C C-C-C-C-C
C
分子构型:锯齿型
三、烷烃
93
2、基本命名法:以C原子数目命名 P14
(1)C原子数1~10用天干来命名:
甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)C原子数>10用中文数字来命名:
十一、十二、十三???
94
名称
结构式
结构简式
分子式
CH4
CH3CH3
CH3CH2CH3
CH4
C2H6
C3H8
C4H10
甲烷
乙烷
丙烷
丁烷
H C
H
H
H
C
H
H C
H
H
H
H
CH3CH2CH2CH3
结构简式-省略短线的结构式的简便写法。
C H
H C
C
H
H
H
H
H
H
C H
H C
C
H
H
H
H
H
H
H
C
H
3、书写
95
分子式
CH4
C2H6
C3H8
C4H10
C5H12
C10H22
C17H36
4、烷烃通式:CnH2n+2 (n≥1)
分析上述式子,可以发现什么?如果把碳原子数定为n,则氢原子数为多少?
结构简式
甲烷 CH4
乙烷 CH3CH3
丙烷 CH3CH2CH3
丁烷 CH3CH2CH2CH3
CH3(CH2)3CH3
CH3(CH2)8CH3
CH3(CH2)15CH3
戊烷
癸烷
十七烷
96
问:如何判断某烃是否属于烷烃?
答:(1)是否符合通式CnH2n+2;
(2)从结构特点分析。
C
C
C
H
H
H
H
H
H
H-C=C-C-H
H H
H H
H
H
H
H H H
H-C-H
H-C-C-C-H
C3H6
C3H6
C4H10
是
否
否
97
练一练
1.写出己烷的分子式,结构简式。
2.已知某烷烃的式量为100,求它的分子式。
3.某烷烃中有20个氢原子,求其式量。
CH3(CH2)4CH3
C6H14
12n + 2n + 2 = 100
n = 7
分子式为C7H16
C9H20
14n + 2 = 14×9 + 2 = 128
98
5、烷烃的性质:
(1)物理性质
名 称 结构简式 常温时的状态 熔点
/℃ 沸点
/ ℃ 密度 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -189.7 -42.1 0.5005 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
庚烷 CH3(CH2)5CH3 液 -90.61 98.42 0.6838 不溶
辛烷 CH3(CH2)6CH3 液 -56.79 125.7 0.7025 不溶
癸烷 CH3(CH2)8CH3 液 -29.7 174.1 0.7300 不溶
十六烷 CH3(CH2)14CH3 液 18.1 286.5 0.7730 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
二十四烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
99
规律:呈递变性(随着碳原子数增多),
状态:气?液?固;熔沸点依次升高;
密度依次增大;均不溶于水。
在常温下
CnH2n+2
气态( 1 ≤ n ≤ 4 )
液态( 5 ≤ n ≤ 16 )
固态( 17 ≤ n )
100
① 氧化反应
性质稳定,均不与强酸,强碱反应、不能使酸性KMnO4溶液、溴水褪色。
②取代反应(在光照条件下进行,产物更复杂)
例如:
(2)化学性质(与甲烷相似)
产生9种产物
CH3CH2Cl + HCl
CH3CH3 + Cl2
光照
CXHY+(X+Y/4)O2 XCO2+Y/2 H2O
点燃
1mol乙烷在光照条件下,最多可以与多少摩尔Cl2发生取代?( )
A、4mol B、8mol C、2mol D、6mol
D
练习 :
101
结构相似、在分子结构式上相差1个或若干个某种原子团的化合物互称同系物。(n≥1)
同:同通式、同类物(可由结构简式确定)
似:结构相似(指碳的连接方式)
差:组成上相差1个或若干个某种原子团
(一般为CH2 )。
判断要领
同系物规律:
1、随着碳原子数的递增,熔沸点逐渐升高。
2、同系物的化学性质一般相似。
6、同系物
例:甲烷、乙烷、丙烷相差n个CH2 ,互为同系物
P12
102
练习:判断是否互为同系物?
CH3 CH CH3 与 CH3 CH3
CH3 CH3
CH3(CH2)2CH3 与 CH3 CH CH3
CH2 = CH2 与 CH3CH3
CH2 - CH2 与 CH2 - CH2
CH2 CH2 - CH2
是
否
是
否
103
C4H10 丁烷
CH3CHCH3
CH3
CH3CH2CH2CH3
异丁烷
正丁烷
104
(1)定义 P13
化合物的分子式相同而结构不同的现象叫同分异构现象。
具有同分异构现象的化合物互称同分异构体。
名 称 熔点/℃ 沸点/℃ 密度
正丁烷 -138.4 -0.5 0.5788
异丁烷 -159.6 -11.7 0.557
同分异构体:
结构中支链越多,熔沸点越低。
7、同分异构现象和同分异构体:
105
(2)同分异构体的书写
例:写出C5H12的同分异构体。
步骤:① 写出碳原子依次相连(最长碳链)的
分子结构简式。
② 逐一缩短碳链(支链数依次增加)
支链位置由里向外变化。
CH3-CH2-CH2-CH2-CH3
即:主链由长到短,支链由简到繁;支链位置由里向外。
思考题:
C3H8、C6H14的同分异构体各几种?分别写出它们的结构简式。
CH3 CH CH2 CH3
CH3
CH3
CH3 C CH3
CH3
106
同分异构体的数目随碳原子数增多而增多。
附表:烷烃的碳原子数与其对应的同分异构体数
碳原子数 1 2 3 4 5 6 8 11 16 20
同分异体数 无同分异构体 2 3 5 18 159 10359 366319
同分异构现象的存在是有机物种类繁多的主要原因
107
同位素、同素异形体、同系物、同分异构体
四种概念的比较
概 念 内 涵 比较对象 实 例
同位素
同素异形体
同系物
同分异构体
质子数相等,中子数不等
原子
氕、氘、氚
同一元素 形成的不同单质
单质
O2、O3
结构相似,组成上差一个或n个CH2
化合物
C2H6、
C4H10
相同分子式,不
同结构的化合物
化合物
CH3(CH2) 3CH3、
C(CH3)4
108
练习 :
3
下列五组物质中___互为同位素,___是同素异形体,
___ 是同分异构体,___是同系物,___是同一物质。
1、 2、白磷、红磷
H H
3、 | | 4、CH3CH3、 CH3CHCH3
H-C-Cl 、Cl-C-Cl |
| |
Cl H
5、CH3CH(CH3)CH2CH3 、C(CH3)4
CH3
12C 与
6
14C
6
1
2
5
4
109
烃基:烃失去一个氢原子后所剩余的原子团。
用“R-”表示。P14
甲烷 甲基
乙烷 乙基
烃基的特点:
呈电中性的原子团,含有未成键的单电子。
-
?
?
?
-
3
4
CH
CH
H
丙基
异丙基
烷基的通式:
— CnH2n+1
110
8、烷烃的命名:系统命名法 P14
步骤:
(1)最长为主链,近支为起点,编碳号。
(2)定支链,写名称。
原则:主链长、定位近、相同并、简单前
注意:表示相同取代基的支链位置的阿拉伯数字要用“,”号隔开。阿拉伯数号码与汉字之间要用“ ”隔开。
111
练习:
1、分别写出下列物质的结构简式。
(1)2,4 – 二甲基戊烷
(2)2,2 – 二甲基 – 3 – 乙基庚烷
2、下列命名是否正确,不正确的请纠正。
(1)2 – 乙基 – 3 – 甲基丁烷
(2)2,3 – 二乙基丁烷
112
CH3-CH-CH2-CH3
CH3
CH3
CH3-C-CH3
CH3
CH3-CH2-CH2-CH2-CH3
思考 :
下列烷烃的一氯代物有几种?
一氯代物——有机物分子中的一个氢原子被氯原子
取代后的产物。
3种
4种
1种
113
四、有机物分子式的确定
例:某碳氢化合物含碳80%,含氢20%,相对分子质量是30,求该化合物的分子式。
方法一:直接求算原子个数
方法二:最简式法
114
有机物分子式的推导方法:
1.标况下的密度
2.标况下的质量和体积
3.相对密度
相对分子质量
1.各元素的质量比
3.燃烧生成的CO2和H2O的V、m、n
2.各元素的质量百分比
分子式
最简式
m
V
(M=22.4× )
(MA= DMB)
(M=22.4ρ0)
(分别除以各原子的M)
(分别除以M)
CxHy+(x + )O2 xCO2+ H2O
点燃
y
4
y
2
通式
燃烧通式:
各元素质量分数
115
1. 某烃含碳92.3%,已知280 ml烃蒸气的质量是
0.975g(换算到标态),求该烃的分子量和分子式。
2. 已知某有机物中含有6.67%的氢和53.33%的氧,
该有机物的蒸气对氢气的相对密度为15,求它的
分子式。
4. 某气态烃 2.2g 在空气中充分燃烧,生成6.6gCO2
和3.6g水 。 在S.T.P下,该烃的密度为1.96g/L,
求该烃的分子式。
3. 某有机物由碳、氢、氧三种元素组成,质量比为
6∶1∶8。该有机物的相对分子质量是180,求它
的分子式
1
认识碳氢化合物的多样性
第 11 章
2
什么叫有机物?
1、定义:
2、组成元素:
含碳元素的化合物为有机化合物,简称有机物。
碳、氢、氧、氮、硫、磷、卤素等。
但碳的氧化物、碳酸、碳酸盐、碳的金属化合物等看作无机物。
主要元素
其他元素
熟悉的有机物有哪些?
3
3、有机物的特点
●种类繁多;
●一般难溶于水、易溶于有机溶剂;
●多数是非电解质,不易导电;熔沸点较低;
●容易燃烧,受热易分解;
●有机反应复杂、副反应多、反应速度慢,常需催化剂;
★ 有机物的结构一般是碳原子之间或与其它原子间以共价键结合成分子,分子聚集成分子晶体。
4
有机物都是从有机体中分离出来的物质吗?
★不是,1824年,德国化学家维勒将无机物氰酸铵转化为有机物尿素(人工合成的第一种有机物) ,打破了只能从有机体中取得有机物的观念。
人们不但能合成自然界里已经存在的许多有机化合物,而且还能合成许多自然界里并不存在的、性能优良的有机化合物,如在1965年,我国科学家在世界上第一次合成了具有生命活力的蛋白质——结晶牛胰岛素,有机化合物与无机化合物的界限也随之消失。
1828年,德国人维勒(Wohler)通过加热氰酸铵首次用人工的方法制得了尿素:
NH4CNO CO(NH2)2
△
氰酸铵 尿素
(无机物) (有机物)
(1800~1882)
有机物性质特点(对比无机物)
有机物 无机物
大多数有机物都能燃烧
(如:酒精、汽油、液化气、苯等;少数不能燃烧也有) 而无机物一般不易燃烧
很多有机物受热易分解
(如:蔗糖、淀粉受热会炭化等) 热稳定性相对较高
1、易燃烧、受热易分解
有机物性质特点(对比无机物)
有机物 无机物
大多为非电解质
(如:酒精、蔗糖等;也有例外,如醋酸是弱电解质) 而无机物中酸、碱、盐等都是电解质
有机物熔沸点一般较低
(很多是气体、液体或低熔点的固体) 很多物质熔沸点较高
2、大多为非电解质、熔沸点较低
思考:为什么有机物有这一特点?
有机物性质特点(对比无机物)
有机物 无机物
大多数有机物难溶于水、易溶于有机溶剂
(如:汽油、苯、四氯化碳等;但也有能溶于水的,如酒精、醋酸等) 大多数无机物能溶于水、不溶于有机溶剂
(如:NaCl能溶于水,但不溶于食用油脂)
3、大多难溶于水、易溶于有机溶剂
有机物性质特点(对比无机物)
有机物 无机物
大多数有机反应速率慢
(如:酿酒、细胞老化等;也有如燃烧、爆炸反应很快) 无机反应一般反应速率较快
(如:离子反应瞬间完成)
大多数有机反应伴随副反应,因此副产物也多,产率较低
(有机反应产物的产率能达到60~70%就已经很高了) 无机反应一般无副反应
(无机反应 产率一般可达 90~100%)
4、反应速率慢,副反应多、
副产物多、产率低
有机物种类繁多、数目庞大、结构复杂
构成有机物的元素主要为C、H,此外还有O、N、P、S、X等元素。但有机物的数量却非常庞大并且增加很快。
据统计,在1880年,有机物数目不过1.2万种;1910年约15万种;1940年约50万种;1961年约175万种;1978年约400万种;1984年约700万种;现在当在1000万种以上。这一数目仍在增长。
而几乎所有的元素都可形成无机物(是组成有机物元素的几十倍),但无机物的数目仅几十万种左右。
有机物结构特点
电子式 结构式
C
H
H
H
H
C
.
.
.
.
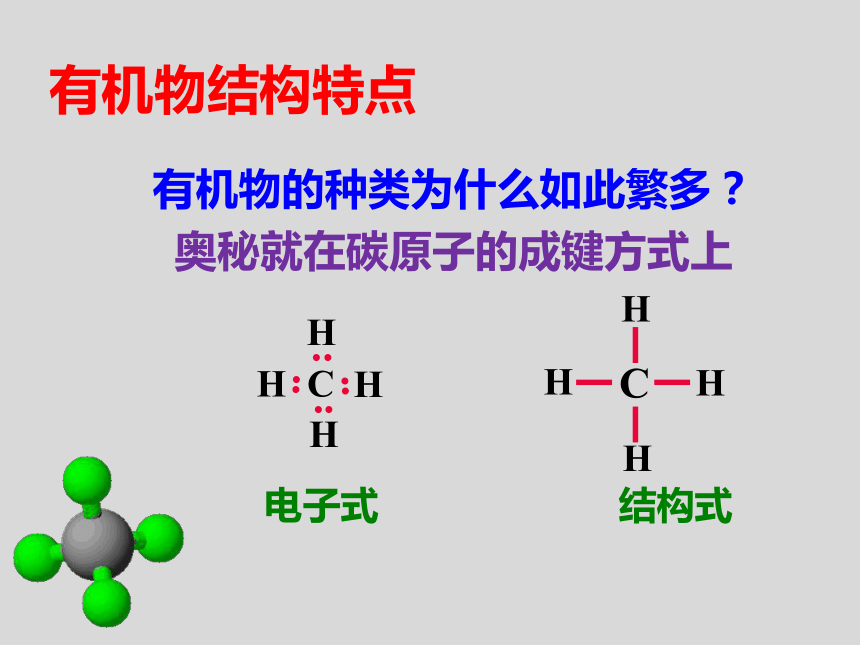
有机物的种类为什么如此繁多?
奥秘就在碳原子的成键方式上
有机物结构特点
H
.
H
.
H
.
H
.
碳原子有4个价电子,可以跟其它原子形成4根共价键;
有机物结构的两条重要规则:
有机物结构特点
碳原子之间能以共价键结合成键
碳碳之间可以形成单键、双键、叁键
碳原子相互连接可形成碳链或碳环
有机物结构特点
思考:有机物中碳是四根键,那氢、
氧、氯分别又是几根键呢?
举例:四个碳以单键结合形成的有
机物的可能碳链结构
有机物种类繁多的其它原因
有机物分子中含碳数可以很多
例: 维生素B12的分子式为C63H90N14O14PCo
蛋白质、淀粉等高分子有机物的分子一般由数万至上亿个原子组成
而无机物的分子一般只有几个原子,至多几十个原子
有机物结构特点
有机物种类繁多的其它原因
同分异构现象普遍
相同的分子式可以形成不同的结构
C4H10有2种结构,C5H12有3种结构,
C6H14有5种结构,C10H22有75种结构,
C20H42有_______种结构
有机物性质不仅由其组成元素决定,更主要的是由其分子的构造决定,即结构决定性质
有机物结构特点
366319
动植物体:天然有机物
煤干熘:煤焦油(含芳香族化合物)
石油化工:石油主要是烷烃和少量烯烃、环烷烃
天然气:主要成份是甲烷
有机物的来源
按组成元素分
有一类有机物仅由碳、氢两种元素组成,这类有机物称为碳氢化合物,又称烃。
有机物的分类
H
C
t
īng
q
àn
烃字的由来:
最简单的有机物—烃
t
īng
最简单的有机物—烃
烃:只由碳、氢两种元素组成
的有机物称为烃,也称为
碳氢化合物。
根据结构的不同,烃可分为烷
烃、烯烃、炔烃、芳香烃等
最简单的烃是甲烷
甲烷
沼气—池沼底部
坑气—煤坑或坑道(瓦斯)
天然气—某些地方地下深处
俗名
最简单的烃—甲烷
甲烷是种温室气体
联合国报告称:牛排放的废气是导致全球变暖的最大元凶。其屁里含有大量甲烷,甲烷的温室效应是二氧化碳的20倍。
阿根廷人为环保收集牛屁做实验。废物利用,做燃气灶的燃料
甲烷的物理性质
甲烷的物理性质有哪些?
无色、无味气体,密度比空气小(分子量16),极难溶于水
燃烧现象:明亮的淡蓝色火焰(无烟),
放出大量的热。
注意:甲烷在点燃之前要检验纯
度,否则可能发生爆炸。
甲烷的化学性质
1、氧化反应(可燃性)
CH4 + 2O2 CO2 + 2H2O
点燃
CH4 C + 2H2
高温
2、化学性质较稳定
与强酸、强碱或强氧化剂一般不反应
甲烷不能使酸性的高锰酸钾溶液褪色
甲烷不能使溴水褪色
3、高温分解
隔绝空气加热到1000℃以上
甲烷的化学性质
4、取代反应
实验录像
实验现象:
黄绿色逐渐消褪,
试管内液面上升,
试管内壁有油状物生成。
甲烷的化学性质
CH4 + Cl2 CH3Cl + HCl
光照
CH3Cl + Cl2 CH2Cl2 + HCl
光照
CH2Cl2 + Cl2 CHCl3 + HCl
光照
CHCl3 + Cl2 CCl4 + HCl
光照
一氯甲烷(g)
二氯甲烷(l)
三氯甲烷(氯仿)(l)
四氯甲烷(四氯化碳)(l)
如何看待有机反应的过程?
4、取代反应
实验录像
甲烷的化学性质
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
——取代反应
有机反应
有机反应可以看作由断键和成键两个过程组成
取代反应也是甲烷这类烷烃的特征反应
有机反应
取代反应和置换反应有什么区别呢?
取代反应 置换反应
生成物中一般没有单质 产物一定是单质与化合物
反应一般比较复杂,可逆,逐步取代 反应一步完成
产物复杂 产物简单
注意点:
逐步取代(第一步为主)
产物一定是混合物
暗处不发生反应,光照下才能反应,若日光直射,会发生爆炸
卤素水溶液(如氯水、溴水)不取代
产物中HCl含量最多
甲烷的化学性质
4、取代反应
实验录像
猜想1
平面正方形
猜想2
空间正四面体
○ ○
× ○
○ ○
× ○
○ ○
○ ○
甲烷的分子结构
已知事实:
1、所有C-H键键长相等
2、所有C-H键之间键角相等
3、一氯甲烷只有一种
4、二氯甲烷只有一种
5、三氯甲烷只有一种
6、四氯化碳只有一种
甲烷的分子结构
C
Cl
H
Cl
H
C
Cl
Cl
H
H
二氯甲烷到底有几种结构?
以碳原子为中心, 四个氢原子为顶点的
正四面体
键角:109°28′
甲烷的分子结构
烷烃
名称 分子式 结构式 结构简式
甲烷 CH4 CH4
乙烷 C2H6 CH3-CH3
或
CH3CH3
丙烷 C3H8 写写看
丁烷 C4H10 写写看
这些名称中有“烷”的烃,结构有何相似之处?
烷烃
C4H10
C2H6
C3H8
CH4
结构特点:
碳原子之间都以单键呈链状相连
碳原子的剩余价键都和氢结合达饱和
符合这类结构特点的烃称为
饱和链烃或烷烃
烷烃
思考:烷烃这一系列物质,我们如何
用一个通式来表示呢?
CnH____
2n+2
练习:写出十八烷的分子式
烷烃
C4H10
C2H6
C3H8
CH4
思考:下列烃中哪些属于烷烃?
烷烃
名称 分子式 结构式 结构简式
甲烷 CH4 CH4
乙烷 C2H6 CH3-CH3
或
CH3CH3
丙烷 C3H8 CH3―CH2―CH3
或CH3CH2CH3
丁烷 C4H10 CH3―CH2―CH2―CH3或CH3CH2CH2CH3或CH3(CH2)2CH3
烷烃
从碳氢原子构成上看,烷烃分子之间的差异有何规律?
锯齿形
结构相似,分子组成上相差一个或若干个CH2原子团的化合物,互称为同系物。
同系物也可理解为同一类别的物质,或者说所有的烷烃都是同系物。
同系物
C4H10
CH4
C2H6
C3H8
烷烃的性质
烷烃物理性质递变规律
℃
沸点
熔点
甲 乙 丙 丁 戊 己 庚 辛 壬 癸
密度
g/cm3
丙 丁 戊 己 庚 辛 壬 癸
随碳原子数增加,烷烃总体上:
熔沸点依次升高 (C4以下烷烃为气态)
密度依次增大 (均小于1)
烷烃均不溶于水
烷烃的性质
烷烃化学性质相似
1、氧化(可燃)
2、较稳定
不能使酸性高锰酸钾褪色
不能使溴水褪色
3、受热分解
4、光照取代
CnH2n+2 + ______O2 →____CO2 +______H2O
点燃
R-H + Cl2 → R-Cl + HCl
光照
有机物的命名
有机物种类繁多,超过千万
存在很多“同分异构”现象
如:C4H10在实际测定中发现有两种沸点不同的丁烷
见表
正丁烷、异丁烷是两种不同的物质
因此必须对有机物进行有效命名
性质 丁烷1 丁烷2
熔点/℃ -138.4 -159.6
沸点/℃ -0.5 -11.7
密度/g·cm-3 0.5788 0.557
取代基
CH4分子失去一个H原子,
形成甲基 -CH3
CH3CH3分子失去一个H原子,
形成乙基 -CH2 CH3
烷烃分子(CnH2n+2)失去一个H原子,
形成烷基 -CnH2n+1
烃分子(R-H)失去一个H原子,
形成烃基 -R
这些基团是电中性的原子团,不是离子
有机物的命名
烷烃的命名
直链烷烃的命名
×烷
甲 乙 丙 丁 戊 己 庚 辛 壬 癸
十一、十二
习惯命名法
冠以字头“正”“异”“新”
“正”是指不含支链的直链烷烃
有机物的命名
烷烃的命名
思考:随碳原子数增加,同分异构现象
更多,习惯命名法还合适吗?
系统命名法
直链烷烃:同前,但不加“正”
a.选碳原子最多的碳链作为主链(最长碳链),
将支链作为取代基
有机物的命名
系统命名法
具有支链的烷烃:
b.若最长碳链不止一条,则选择取代基较小
的一条作主链
步骤一:确定主链
步骤一:确定主链
步骤二:主链碳原子编号,取代基定位
a.编号原则:使取代基位置最小(一个或多个)
有机物的命名
系统命名法
具有支链的烷烃:
b.若有多个取代基且位置相同,则从较小的
取代基一端开始编号
步骤一:确定主链
步骤二:主链碳原子编号,取代基定位
步骤三:以取代基位置和主链碳原子数
目命名该有机物
a.注意书写形式(短线)
有机物的命名
系统命名法
具有支链的烷烃:
b.相同取代基合并(位置、个数、逗号)
不同取代基,小前大后(分隔符号)
有机物的命名
练习:用系统命名法命名
正丁烷、异丁烷
正戊烷、异戊烷、新戊烷
系统命名法
与习惯命名法的差异:
直链一般不加“正”
……×烷,只包含主链碳原子
CH2 CH2 CH CH2 CH2
CH3
CH3
CH2
CH3
CH3
CH3
CH3 CH C CH3
CH3
有机物的命名
练习:用系统命名法命名下列烷烃
CH3—CH—CH2—CH—CH3
| |
CH2 CH2
| |
CH3 CH3
有机物的命名
练习:根据命名写出烷烃的结构简式
2,3-二甲基丁烷
2,3-二甲基-4-乙基己烷
练习:下列烷烃命名是否正确?
若不正确,请正确命名。
① 2,5-二甲基庚烷
② 1,3-二甲基戊烷
③ 2,2-二乙基丁烷
④ 2,3,3-三甲基丁烷
有机物的命名
两种常见命名错误:主链找错
取代基位置没有最小
同分异构体
分子式相同,结构不同的现象,
称为同分异构现象
具有同分异构现象的化合物,
互称为同分异构体
写出C4H10 、C5H12的同分异构体
下列概念能之前区分吗?
同分异构体、同系物
同素异形体、同位素
同分异构体
思考:下列烷烃中哪些是同分异构体?
哪些是同一物质?
可通过命名来加以确认
同分异构体
练习:写出C6H14 的同分异构体
并命名
*写出C7H16 的同分异构体(9种)
碳链异构
类别异构
位置异构
同分异构体
练习:写出一氯丁烷(C4H9Cl)的同分
异构体
找“等效”碳原子
*练习:写出二氯丁烷(C4H8Cl2)的同分
异构体
58
11.1 碳氢化合物的宝库—石油
一、工业的血液和炼油
1、石油是重要的能源和宝贵的资源
想一想:
为什么把石油称为“工业的血液”?
【查资料】
石油的形成及物理性质P5
(1)物理性质: 石油呈黑色或深棕色,有特殊气味,不
溶于水,密度比水稍小,没有固定的熔点和沸点。P5
(2)元素组成:C、H、 N、 O、S等
(3)成分:烷烃、环烷烃和芳香烃组成的混合物
(4)炼制:分馏、裂化、重整和精制
59
想一想:
互溶的液体如何分离? 根据什么?
例如: 酒精和水的分离。
(蒸馏)
(根据沸点不同)
蒸 馏 烧 瓶
冷 凝 管
尾接管
锥 形 瓶
温度计
酒 精 灯
铁架台
冷凝水出口
冷凝水进口
铁圈、石棉网
大量生物死亡后沉积到海底
石油和天然气形成
石油和天然气向上移动
形成
油层和气层
形成
断层
石油的形成
石油
石油
石油主要含碳、氢元素(少量O、S、N等)
石油的主要成分是烷烃、环烷烃和芳香烃
石油是黑色或深棕色可燃性粘稠液体,有特殊气味,不溶于水,密度比水小,没有固定熔沸点
石油
石油中各种烃的性质差别很大,只有通过分离才有利用的价值
中石油化工厂
石油
石油的炼制
原油成分复杂,还含水和一些盐类等,含水多炼制时浪费燃料,含盐多易腐蚀设备。
所以原油一般先经脱水,脱盐等处理后才能进行炼制。
石油的炼制有分馏、裂化、裂解。
石油
石油的炼制—分馏
蒸馏烧瓶
温度计
冷凝管
接液管
锥形瓶
分馏是蒸馏原理的应用
蒸馏是利用沸点不同,分离
(互溶)液体的操作
分馏是物理变化
石油
石油的炼制—分馏
分馏通过加热气化、冷凝后,分离出沸点范围不同的混合物(馏分)
蒸馏通过加热气化、冷凝,把液态混和物中沸点较低的成分先分离出来
(控制温度点、产物较纯)
石油
石油的炼制—分馏
分馏塔内各部位温度如何分布?
由于烷烃的沸点随碳原子数增加而升高,所以产物在分馏塔内分布有何规律?
常压分馏
防止温度过高炭化结焦
减压分馏
碳原子数:少———→多
教材P6课堂实验
石油
石油的炼制
目的:提高轻质油(汽油)产量
重油(原料) → 轻质油
碳多 → 碳少
大分子 → 小分子
长链 → 短链
裂化是化学变化
原理:
热裂化
催化裂化
—裂化
C16H34→C8H18+C8H16
十六烷 辛烷 辛烯
△
石油
(深度裂化)
得到碳链更短的小分子烃(C2~C3)
裂解气(含乙烯等不饱和烃)
乙烯的产量是衡量石油工业发展程度的标志
石油的炼制
—裂解
石油
石油的炼制—重整
通过使用催化剂等方法使碳链结构发生改变,例如直链变支链,直链变苯环等,以提高产品质量
烃分子式的确定
例:某气态烃含碳80%,相同条
件下对氢气的相对密度为15,
求该烃的分子式。
质量=物质的量×摩尔质量
质量比=物质的量比×摩尔质量比
碳氢原子最简比——最简式
其它条件(分子量、相对密度、密度等)
烃分子式的确定
例:标准状况下,2.24L某气态烃(密度
为1.34 g/L)充分燃烧后,先通过无
水氯化钙,质量减少5.4g,再通过
NaOH溶液,质量又减少了8.8g,
求该烃分子式。
(若将 “某烃”改为“某烷烃”或
“某有机物” ,又该如何解?)
设烃的分子式为CXHY
写出燃烧方程式
烃分子式的确定
质量比=物质的量比×摩尔质量比
分子量、相对密度、密度等其它条件
方法一
方法二:设通式,根据燃烧方程式
烃分子式的确定
*例:20℃时20mL某气态烃与过量O2完全燃烧后,将产物通过浓硫酸,再恢复到原来温度,气体体积减少了50mL,剩余气体再通过NaOH溶液,又减少40mL,求该烃分子式。
提示:可考虑用“差量法”
74
问:
如何分离由多种液体混合而成的石油呢?
分馏出来的各种成分,每一种馏分仍然是
多种碳氢化合物的混合物。
(2)分馏:
(3)馏分:
(1)原料:
经过脱水、脱盐的石油。
(4)设备:
分馏塔
利用蒸馏原理得到不同沸点范围的蒸馏产物。
2. 石油的分馏
(物理变化)
75
分馏原理:石油在加热时,分子中碳原子数少的低沸点烃受热先汽化,经过冷凝先分离出来。随着温度的升高,分子中碳原子数多的高沸点烃受热再汽化,再经过冷凝,也分离出来。经过多次加热和冷凝,就可在不同的温度的范围把石油分成不同的蒸馏产物。
看实验
76
想一想:
石油分馏塔的哪个出口的馏分沸点最低?
石油产品及用途 P7
思考:
需求很大的汽油和太多的重油之间如何转化?
分馏产品中哪一馏分用量最大?
汽油
77
3、石油的裂化:
提高汽油产量
提高汽油产量和质量
看实验
提高汽油产量
裂化
热裂化
催化裂化
裂解
就是深度裂化
将重油通过隔绝空气高温加热(或使用催化剂)的方法把相对分子质量大、沸点较高的烃转化成相对分子质量较小、沸点较低的烃作燃料油。
78
烃——仅由碳和氢元素组成的化合物。
(也叫碳氢化合物)分子式为 CxHy
甲烷(CH4)为最简单的烃
判断下列有机物是否是烃?
C2H6O C6H12O6 C4H8
CH3Cl CO(NH2)2 C2H2
79
池沼底部产生的沼气。
煤矿坑道产生的坑气。
地下深处蕴藏的天然气(一般含CH480~97%)。
1、甲烷在自然界里的存在:
二、甲烷
甲烷俗称沼气、坑气,是天然气的主要成分。
这些气体中的甲烷都是在隔绝空气的条件下,
由植物残体经过某些微生物发酵的作用而生成的。
80
天然气是当今世界上最重要的气体化石燃料。我国是最早利用天然气的国家。
81
2、甲烷的物理性质
(1)无色、无味的气体;
(2)密度比空气小,?=0.717g/L(S.T.P)
(密度求算公式:M=22.4 ?)
(3)极难溶于水。
3、甲烷的化学性质
通常情况下,甲烷比较稳定,一般不和强酸、强碱、强氧化剂等起反应。(不能使溴水、酸性高锰酸钾溶液褪色)
82
(1)氧化反应
纯净的甲烷在空气中安静地燃烧(淡蓝色火焰),放出大量的热。
甲烷是一种洁净的气体燃料。(高效、低耗、污染小)
注意
甲烷在点燃之前要验纯,否则可能发生爆炸。
83
(2)受热分解
甲烷在隔绝空气并加热到10000C的条件下分解
CH4 C + 2 H2
高温
此法制取炭黑和氢气
●炭黑是橡胶工业的重要原料,是黑色颜料、油漆、涂料的重要着色剂。
84
甲烷与氯气的反应
(1)反应装置(如图)
(3)实验现象:
(2)反应条件:光照
试管中液面上升
气体黄绿色变浅
试管内壁有油状液滴生成
85
(1)
(2)
(3)
(4)
一氯甲烷(气体)
二氯甲烷(液体)
三氯甲烷(液体)
四氯甲烷(液体)
甲烷与氯气反应:
烃分子中的氢原子被卤素原子取代后所形成的化合物叫做卤代烃。
86
(3)取代反应:
有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应
87
1.取代反应条件——光照。
2.反应物状态:纯卤素
(e.g. 与氯气取代,与氯水不取代。)
3、甲烷的取代反应是分步且连锁进行的,所以产物是几种氯代物的混合物。
注意:
88
取代反应与置换反应的区别
取代反应
置换反应
适用于有机反应
适用于无机反应
反应物、生成物中不一定有单质
反应物、生成物中一定有单质
逐步取代 ,很多反应是可逆的
反应一般是单向进行
反应能否进行受催化剂、温度、光照等外界条件影响较大
在水溶液中进行的置换反应遵循金属或非金属的活动顺序
4、甲烷的用途:作燃料、制卤代烃、炭黑
89
5、甲烷的结构
电子式: 结构式:
化学式:
球棍模型
比例模型
以碳原子为中心, 四个氢原子为顶点的正四面体的立体结构。
键角:109 28
。
,
C
·
·
·
·
×
×
×
×
H
H
H
H
C
H
H
H
H
CH4
90
(1)药品:无水醋酸钠和碱石灰
(2)原理:
(3)反应条件:固固加热
(4)发生装置:同制氧气、氨气
(5)干燥:浓硫酸
(6)收集:排水集气法、向下排气法
(7)检验:燃烧产物,火焰为淡蓝色;生成的气体不能使溴水、酸性高锰酸钾溶液褪色。
CaO
△
CH3COONa+NaOH → CH4+Na2CO3
6、甲烷的实验室制取
91
分析它们的结构有什么共同点?
92
1、定义:碳原子之间都以单键结合成链状,剩余
的价键全部跟氢原子相结合,使每个碳
原子的化合价都已充分利用而达到饱和。
这种烃叫“饱和链烃”或称烷烃。 P11
特点:单键、链状、饱和
注意:链状包括直链和含支链的链。
如:C-C-C-C C-C-C-C-C
C
分子构型:锯齿型
三、烷烃
93
2、基本命名法:以C原子数目命名 P14
(1)C原子数1~10用天干来命名:
甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)C原子数>10用中文数字来命名:
十一、十二、十三???
94
名称
结构式
结构简式
分子式
CH4
CH3CH3
CH3CH2CH3
CH4
C2H6
C3H8
C4H10
甲烷
乙烷
丙烷
丁烷
H C
H
H
H
C
H
H C
H
H
H
H
CH3CH2CH2CH3
结构简式-省略短线的结构式的简便写法。
C H
H C
C
H
H
H
H
H
H
C H
H C
C
H
H
H
H
H
H
H
C
H
3、书写
95
分子式
CH4
C2H6
C3H8
C4H10
C5H12
C10H22
C17H36
4、烷烃通式:CnH2n+2 (n≥1)
分析上述式子,可以发现什么?如果把碳原子数定为n,则氢原子数为多少?
结构简式
甲烷 CH4
乙烷 CH3CH3
丙烷 CH3CH2CH3
丁烷 CH3CH2CH2CH3
CH3(CH2)3CH3
CH3(CH2)8CH3
CH3(CH2)15CH3
戊烷
癸烷
十七烷
96
问:如何判断某烃是否属于烷烃?
答:(1)是否符合通式CnH2n+2;
(2)从结构特点分析。
C
C
C
H
H
H
H
H
H
H-C=C-C-H
H H
H H
H
H
H
H H H
H-C-H
H-C-C-C-H
C3H6
C3H6
C4H10
是
否
否
97
练一练
1.写出己烷的分子式,结构简式。
2.已知某烷烃的式量为100,求它的分子式。
3.某烷烃中有20个氢原子,求其式量。
CH3(CH2)4CH3
C6H14
12n + 2n + 2 = 100
n = 7
分子式为C7H16
C9H20
14n + 2 = 14×9 + 2 = 128
98
5、烷烃的性质:
(1)物理性质
名 称 结构简式 常温时的状态 熔点
/℃ 沸点
/ ℃ 密度 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -189.7 -42.1 0.5005 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
庚烷 CH3(CH2)5CH3 液 -90.61 98.42 0.6838 不溶
辛烷 CH3(CH2)6CH3 液 -56.79 125.7 0.7025 不溶
癸烷 CH3(CH2)8CH3 液 -29.7 174.1 0.7300 不溶
十六烷 CH3(CH2)14CH3 液 18.1 286.5 0.7730 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
二十四烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
99
规律:呈递变性(随着碳原子数增多),
状态:气?液?固;熔沸点依次升高;
密度依次增大;均不溶于水。
在常温下
CnH2n+2
气态( 1 ≤ n ≤ 4 )
液态( 5 ≤ n ≤ 16 )
固态( 17 ≤ n )
100
① 氧化反应
性质稳定,均不与强酸,强碱反应、不能使酸性KMnO4溶液、溴水褪色。
②取代反应(在光照条件下进行,产物更复杂)
例如:
(2)化学性质(与甲烷相似)
产生9种产物
CH3CH2Cl + HCl
CH3CH3 + Cl2
光照
CXHY+(X+Y/4)O2 XCO2+Y/2 H2O
点燃
1mol乙烷在光照条件下,最多可以与多少摩尔Cl2发生取代?( )
A、4mol B、8mol C、2mol D、6mol
D
练习 :
101
结构相似、在分子结构式上相差1个或若干个某种原子团的化合物互称同系物。(n≥1)
同:同通式、同类物(可由结构简式确定)
似:结构相似(指碳的连接方式)
差:组成上相差1个或若干个某种原子团
(一般为CH2 )。
判断要领
同系物规律:
1、随着碳原子数的递增,熔沸点逐渐升高。
2、同系物的化学性质一般相似。
6、同系物
例:甲烷、乙烷、丙烷相差n个CH2 ,互为同系物
P12
102
练习:判断是否互为同系物?
CH3 CH CH3 与 CH3 CH3
CH3 CH3
CH3(CH2)2CH3 与 CH3 CH CH3
CH2 = CH2 与 CH3CH3
CH2 - CH2 与 CH2 - CH2
CH2 CH2 - CH2
是
否
是
否
103
C4H10 丁烷
CH3CHCH3
CH3
CH3CH2CH2CH3
异丁烷
正丁烷
104
(1)定义 P13
化合物的分子式相同而结构不同的现象叫同分异构现象。
具有同分异构现象的化合物互称同分异构体。
名 称 熔点/℃ 沸点/℃ 密度
正丁烷 -138.4 -0.5 0.5788
异丁烷 -159.6 -11.7 0.557
同分异构体:
结构中支链越多,熔沸点越低。
7、同分异构现象和同分异构体:
105
(2)同分异构体的书写
例:写出C5H12的同分异构体。
步骤:① 写出碳原子依次相连(最长碳链)的
分子结构简式。
② 逐一缩短碳链(支链数依次增加)
支链位置由里向外变化。
CH3-CH2-CH2-CH2-CH3
即:主链由长到短,支链由简到繁;支链位置由里向外。
思考题:
C3H8、C6H14的同分异构体各几种?分别写出它们的结构简式。
CH3 CH CH2 CH3
CH3
CH3
CH3 C CH3
CH3
106
同分异构体的数目随碳原子数增多而增多。
附表:烷烃的碳原子数与其对应的同分异构体数
碳原子数 1 2 3 4 5 6 8 11 16 20
同分异体数 无同分异构体 2 3 5 18 159 10359 366319
同分异构现象的存在是有机物种类繁多的主要原因
107
同位素、同素异形体、同系物、同分异构体
四种概念的比较
概 念 内 涵 比较对象 实 例
同位素
同素异形体
同系物
同分异构体
质子数相等,中子数不等
原子
氕、氘、氚
同一元素 形成的不同单质
单质
O2、O3
结构相似,组成上差一个或n个CH2
化合物
C2H6、
C4H10
相同分子式,不
同结构的化合物
化合物
CH3(CH2) 3CH3、
C(CH3)4
108
练习 :
3
下列五组物质中___互为同位素,___是同素异形体,
___ 是同分异构体,___是同系物,___是同一物质。
1、 2、白磷、红磷
H H
3、 | | 4、CH3CH3、 CH3CHCH3
H-C-Cl 、Cl-C-Cl |
| |
Cl H
5、CH3CH(CH3)CH2CH3 、C(CH3)4
CH3
12C 与
6
14C
6
1
2
5
4
109
烃基:烃失去一个氢原子后所剩余的原子团。
用“R-”表示。P14
甲烷 甲基
乙烷 乙基
烃基的特点:
呈电中性的原子团,含有未成键的单电子。
-
?
?
?
-
3
4
CH
CH
H
丙基
异丙基
烷基的通式:
— CnH2n+1
110
8、烷烃的命名:系统命名法 P14
步骤:
(1)最长为主链,近支为起点,编碳号。
(2)定支链,写名称。
原则:主链长、定位近、相同并、简单前
注意:表示相同取代基的支链位置的阿拉伯数字要用“,”号隔开。阿拉伯数号码与汉字之间要用“ ”隔开。
111
练习:
1、分别写出下列物质的结构简式。
(1)2,4 – 二甲基戊烷
(2)2,2 – 二甲基 – 3 – 乙基庚烷
2、下列命名是否正确,不正确的请纠正。
(1)2 – 乙基 – 3 – 甲基丁烷
(2)2,3 – 二乙基丁烷
112
CH3-CH-CH2-CH3
CH3
CH3
CH3-C-CH3
CH3
CH3-CH2-CH2-CH2-CH3
思考 :
下列烷烃的一氯代物有几种?
一氯代物——有机物分子中的一个氢原子被氯原子
取代后的产物。
3种
4种
1种
113
四、有机物分子式的确定
例:某碳氢化合物含碳80%,含氢20%,相对分子质量是30,求该化合物的分子式。
方法一:直接求算原子个数
方法二:最简式法
114
有机物分子式的推导方法:
1.标况下的密度
2.标况下的质量和体积
3.相对密度
相对分子质量
1.各元素的质量比
3.燃烧生成的CO2和H2O的V、m、n
2.各元素的质量百分比
分子式
最简式
m
V
(M=22.4× )
(MA= DMB)
(M=22.4ρ0)
(分别除以各原子的M)
(分别除以M)
CxHy+(x + )O2 xCO2+ H2O
点燃
y
4
y
2
通式
燃烧通式:
各元素质量分数
115
1. 某烃含碳92.3%,已知280 ml烃蒸气的质量是
0.975g(换算到标态),求该烃的分子量和分子式。
2. 已知某有机物中含有6.67%的氢和53.33%的氧,
该有机物的蒸气对氢气的相对密度为15,求它的
分子式。
4. 某气态烃 2.2g 在空气中充分燃烧,生成6.6gCO2
和3.6g水 。 在S.T.P下,该烃的密度为1.96g/L,
求该烃的分子式。
3. 某有机物由碳、氢、氧三种元素组成,质量比为
6∶1∶8。该有机物的相对分子质量是180,求它
的分子式
