沪科版化学高一年级第二学期7.4电解质溶液在通电情况下的变化(共16张PPT)
文档属性
| 名称 | 沪科版化学高一年级第二学期7.4电解质溶液在通电情况下的变化(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-17 22:05:37 | ||
图片预览





文档简介
(共16张PPT)
7.4电解质溶液在通电情况下的变化
回忆电解饱和食盐水的实验现象
——电解
电解饱和食盐水
实验现象
使湿润的淀粉碘化钾试
纸变蓝色,证明是氯气;
阴极的气体:
能燃烧,说明是氢气。
阴极周围的溶液使酚酞变红:
说明阴极区生成
NaOH
两极都有气泡放出。
注意:为什么强调电解饱和食盐水?
是因为氯气在饱和食盐水中
的溶解量较小。
阳极的气体:
Cl- 、OH- →阳极
Na+ 、 H+ →阴极
阳极(C):
电解NaCl溶液原理分析
Cl2
H2
阴极
阳极
-
+
2H+ + 2e→H2↑(还原反应)
2Cl- - 2e →Cl2↑(氧化反应)
通电前:
NaCl → Na+ + Cl-
通电后:
得电子能力:H+ > Na+
失电子能力:Cl- > OH-
电极反应:
阴极(Fe):
1. 定义
2. 装置
3. 形成条件
4. 电极名称
5. 电极反应
6. 电解反应
电解池——把电能转化为化学能的装置。
(1)两电极接直流电源;
(2)电极插入电解质溶液; (3)形成闭合电路。
阴极: 与电源负极相连的电极
阳极: 与电源正极相连的电极
阴极( Fe ): 2H+ + 2e → H2↑ (还原反应)阳极(C) : 2Cl- - 2e → Cl2↑(氧化反应)
一、电解:
电解质溶液的导电过程就是电解质溶液电解的过程
使直流电通过电解质溶液而发生氧化还原反应的过程
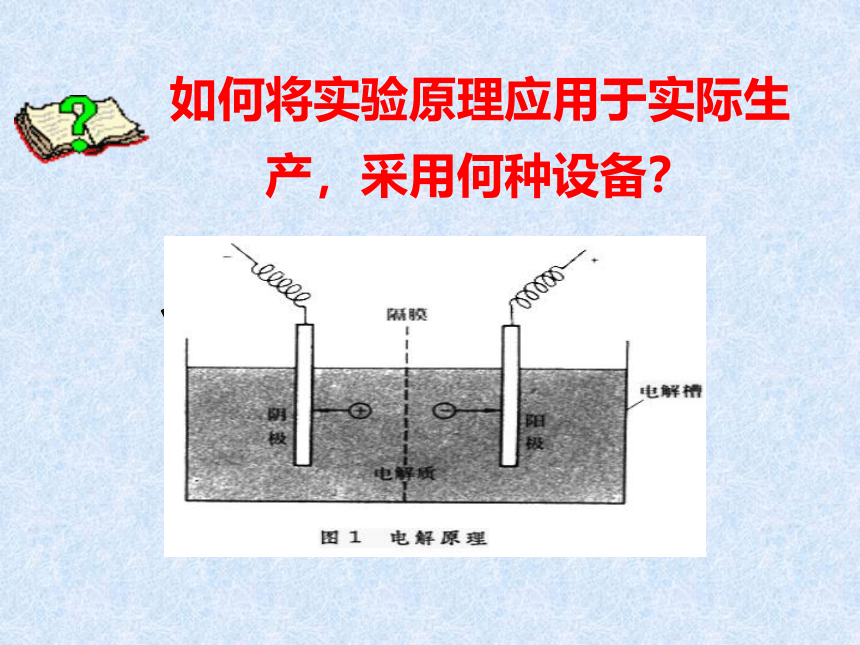
如何将实验原理应用于实际生
产,采用何种设备?
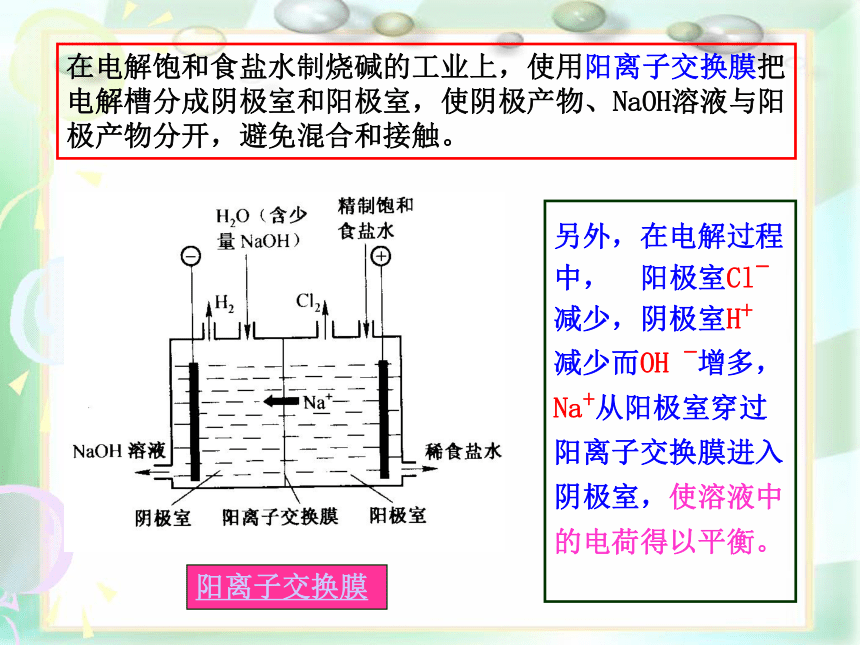
、氯碱工业的主要设备:
在电解饱和食盐水制烧碱的工业上,使用阳离子交换膜把电解槽分成阴极室和阳极室,使阴极产物、NaOH溶液与阳极产物分开,避免混合和接触。
另外,在电解过程中, 阳极室Cl- 减少,阴极室H+
减少而OH -增多,Na+从阳极室穿过阳离子交换膜进入阴极室,使溶液中的电荷得以平衡。
阳离子交换膜
离子膜电解法:
?是利用阳离子交换膜将单元电解槽分隔为阳极室和阴极室,使电解产品分开的方法。
隔膜电解法:
利用多孔渗透性的材料作为电解槽内的隔层,以分隔阳极产物和阴极产物的电解方法。氯碱工业利用隔膜电解槽电解食盐水溶液生产烧碱(氢氧化钠)氯气和氢气。
【演示实验 】电解氯化铜溶液
【实验现象 】
产生使湿润的淀粉碘化钾
试纸变蓝色的气体(Cl2)。
阳极:
阴极:
表面析出红色物质(Cu);
负极→阴极→ Cu2+ 得电子
正极←阳极← Cl- 失电子
-
Cl - 、OH - →阳极
Cu2+ 、 H+ →阴极
电极反应:
阴极
阳极
Cu2++ 2e→ Cu (还原反应)
2Cl- - 2e →Cl2↑(氧化反应)
通电前:
CuCl2→Cu2+ + 2Cl-
通电后:
得电子能力:Cu2+ > H+
失电子能力:Cl- > OH-
电解CuCl2溶液原理分析
+
阴极:
阳极:
电解反应:
电子流向:
电解质溶液的导电过程就是电解质溶液电解的过程(阴阳离子得失电子的过程)
Cl2
Cu
(一)电极名称确定
原电池
相对活泼的电极为负极
相对不活泼的电极为正极
电解池
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
阴极
阳极
电解质溶液
原电池正负极应根据氧化还原反应确定,活泼金属不一定是负极
(二)电解产物的判断 ——常见阴阳离子的放电顺序
1、阳极产物:
①若活性电极( Pt以前的金属),则电极本身
失电子,电极被溶解。
S2- > I- > Br- > Cl- > OH- > 含氧酸根离子
阴离子放电顺序:
阳离子放电顺序:
2、阴极产物:根据阳离子放电顺序判断。
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
电解强碱、含氧酸、活泼金属的含氧酸盐溶液就是电解水
判断AgNO3、NaOH、H2SO4、Na2SO4的电解产物
②若惰性电极(Pt、Au、C),则根据阴离子
的放电顺序判断。
练习:
二、电解原理的应用——电镀
氯碱工业:
电镀
冶炼铝:
镀件
镀层金属
电镀液:
阴极:
阳极:
含镀层金属离子
电解精练铜
M - ne → Mn+
Mn+ + ne →M
Cu - 2e → Cu2+
Cu2+ + 2e →Cu
阳极(粗铜):
阴极(精铜):
浓度不变
溶解
析出
1. 定义
2.装置
3.形成条件
4.电极名称
5.电极反应
6.原电池反应
把化学能转化为电能的装置
负极(Zn):Zn - 2e → Zn2+ (氧化反应)
正极(Cu):2H+ + 2e → H2↑ (还原反应)
(1)活泼性不同的两个电极;
(2)电极插入电解质溶液;(3)形成闭合回路。
Zn + H2SO4 → ZnSO4 + H2↑
负极:较活泼金属(Zn)
正极:较不活泼金属(Cu)或非金属(石墨)
原电池知识复习
原电池
电解池
概念
形成
条件
两极
特点
两极
反应
应用
化学能转化为电能
电能转化为化学能
A.活泼性不同的两个电极
B.电极插入电解质溶液
C.形成闭合回路
A.两个电极接直流电
B.电极插入电解质溶液
C.形成闭合回路
负极:相对活泼的金属
阳极:与电源正极相连
阴极:与电源负极相连
正极:发生还原反应
负极:发生氧化反应
阳极:发生氧化反应
金属的防腐等
电解饱和食盐水、电镀等
比较原电池和电解池
阴极:发生还原反应
正极:相对不活泼的金属
或非金属
知识概括
一个反应:氧化还原反应
两个转化:化学能和电能的相互转化
三个条件:原电池、电解池的形成条件
区分原电池、电解池关键看是否有外接电源
电解池反应原理: 使电流通过电解质溶液在阴阳两极上被迫发生氧化
还原反应,从而把电能转化为化学能。
原电池反应原理: 通过自发的氧化还原反应,把化学能转化为电能。。
原电池
电解池
7.4电解质溶液在通电情况下的变化
回忆电解饱和食盐水的实验现象
——电解
电解饱和食盐水
实验现象
使湿润的淀粉碘化钾试
纸变蓝色,证明是氯气;
阴极的气体:
能燃烧,说明是氢气。
阴极周围的溶液使酚酞变红:
说明阴极区生成
NaOH
两极都有气泡放出。
注意:为什么强调电解饱和食盐水?
是因为氯气在饱和食盐水中
的溶解量较小。
阳极的气体:
Cl- 、OH- →阳极
Na+ 、 H+ →阴极
阳极(C):
电解NaCl溶液原理分析
Cl2
H2
阴极
阳极
-
+
2H+ + 2e→H2↑(还原反应)
2Cl- - 2e →Cl2↑(氧化反应)
通电前:
NaCl → Na+ + Cl-
通电后:
得电子能力:H+ > Na+
失电子能力:Cl- > OH-
电极反应:
阴极(Fe):
1. 定义
2. 装置
3. 形成条件
4. 电极名称
5. 电极反应
6. 电解反应
电解池——把电能转化为化学能的装置。
(1)两电极接直流电源;
(2)电极插入电解质溶液; (3)形成闭合电路。
阴极: 与电源负极相连的电极
阳极: 与电源正极相连的电极
阴极( Fe ): 2H+ + 2e → H2↑ (还原反应)阳极(C) : 2Cl- - 2e → Cl2↑(氧化反应)
一、电解:
电解质溶液的导电过程就是电解质溶液电解的过程
使直流电通过电解质溶液而发生氧化还原反应的过程
如何将实验原理应用于实际生
产,采用何种设备?
、氯碱工业的主要设备:
在电解饱和食盐水制烧碱的工业上,使用阳离子交换膜把电解槽分成阴极室和阳极室,使阴极产物、NaOH溶液与阳极产物分开,避免混合和接触。
另外,在电解过程中, 阳极室Cl- 减少,阴极室H+
减少而OH -增多,Na+从阳极室穿过阳离子交换膜进入阴极室,使溶液中的电荷得以平衡。
阳离子交换膜
离子膜电解法:
?是利用阳离子交换膜将单元电解槽分隔为阳极室和阴极室,使电解产品分开的方法。
隔膜电解法:
利用多孔渗透性的材料作为电解槽内的隔层,以分隔阳极产物和阴极产物的电解方法。氯碱工业利用隔膜电解槽电解食盐水溶液生产烧碱(氢氧化钠)氯气和氢气。
【演示实验 】电解氯化铜溶液
【实验现象 】
产生使湿润的淀粉碘化钾
试纸变蓝色的气体(Cl2)。
阳极:
阴极:
表面析出红色物质(Cu);
负极→阴极→ Cu2+ 得电子
正极←阳极← Cl- 失电子
-
Cl - 、OH - →阳极
Cu2+ 、 H+ →阴极
电极反应:
阴极
阳极
Cu2++ 2e→ Cu (还原反应)
2Cl- - 2e →Cl2↑(氧化反应)
通电前:
CuCl2→Cu2+ + 2Cl-
通电后:
得电子能力:Cu2+ > H+
失电子能力:Cl- > OH-
电解CuCl2溶液原理分析
+
阴极:
阳极:
电解反应:
电子流向:
电解质溶液的导电过程就是电解质溶液电解的过程(阴阳离子得失电子的过程)
Cl2
Cu
(一)电极名称确定
原电池
相对活泼的电极为负极
相对不活泼的电极为正极
电解池
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
阴极
阳极
电解质溶液
原电池正负极应根据氧化还原反应确定,活泼金属不一定是负极
(二)电解产物的判断 ——常见阴阳离子的放电顺序
1、阳极产物:
①若活性电极( Pt以前的金属),则电极本身
失电子,电极被溶解。
S2- > I- > Br- > Cl- > OH- > 含氧酸根离子
阴离子放电顺序:
阳离子放电顺序:
2、阴极产物:根据阳离子放电顺序判断。
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
电解强碱、含氧酸、活泼金属的含氧酸盐溶液就是电解水
判断AgNO3、NaOH、H2SO4、Na2SO4的电解产物
②若惰性电极(Pt、Au、C),则根据阴离子
的放电顺序判断。
练习:
二、电解原理的应用——电镀
氯碱工业:
电镀
冶炼铝:
镀件
镀层金属
电镀液:
阴极:
阳极:
含镀层金属离子
电解精练铜
M - ne → Mn+
Mn+ + ne →M
Cu - 2e → Cu2+
Cu2+ + 2e →Cu
阳极(粗铜):
阴极(精铜):
浓度不变
溶解
析出
1. 定义
2.装置
3.形成条件
4.电极名称
5.电极反应
6.原电池反应
把化学能转化为电能的装置
负极(Zn):Zn - 2e → Zn2+ (氧化反应)
正极(Cu):2H+ + 2e → H2↑ (还原反应)
(1)活泼性不同的两个电极;
(2)电极插入电解质溶液;(3)形成闭合回路。
Zn + H2SO4 → ZnSO4 + H2↑
负极:较活泼金属(Zn)
正极:较不活泼金属(Cu)或非金属(石墨)
原电池知识复习
原电池
电解池
概念
形成
条件
两极
特点
两极
反应
应用
化学能转化为电能
电能转化为化学能
A.活泼性不同的两个电极
B.电极插入电解质溶液
C.形成闭合回路
A.两个电极接直流电
B.电极插入电解质溶液
C.形成闭合回路
负极:相对活泼的金属
阳极:与电源正极相连
阴极:与电源负极相连
正极:发生还原反应
负极:发生氧化反应
阳极:发生氧化反应
金属的防腐等
电解饱和食盐水、电镀等
比较原电池和电解池
阴极:发生还原反应
正极:相对不活泼的金属
或非金属
知识概括
一个反应:氧化还原反应
两个转化:化学能和电能的相互转化
三个条件:原电池、电解池的形成条件
区分原电池、电解池关键看是否有外接电源
电解池反应原理: 使电流通过电解质溶液在阴阳两极上被迫发生氧化
还原反应,从而把电能转化为化学能。
原电池反应原理: 通过自发的氧化还原反应,把化学能转化为电能。。
原电池
电解池
