人教版初中化学 第五单元 化学方程式及质量守恒定律的复习(82张PPT)
文档属性
| 名称 | 人教版初中化学 第五单元 化学方程式及质量守恒定律的复习(82张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-17 00:00:00 | ||
图片预览








文档简介
(共82张PPT)
授课教师:赵春华
指导教师:刘红梅 张蕊
人教版义务教育教科书 化学 九年级上册
学 校:天津市汇森中学
学习任务
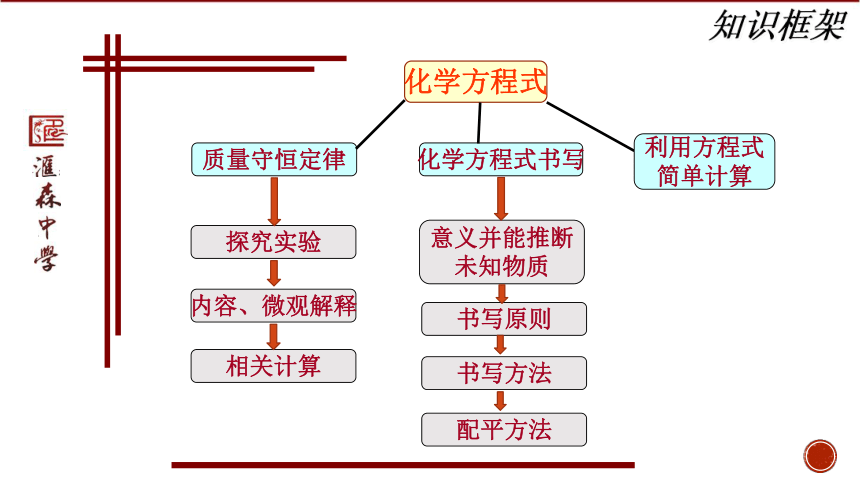
知识框架
化学方程式
质量守恒定律
化学方程式书写
利用方程式
简单计算
探究实验
内容、微观解释
相关计算
意义并能推断
未知物质
书写原则
书写方法
配平方法
一、质量守恒定律
知识框架
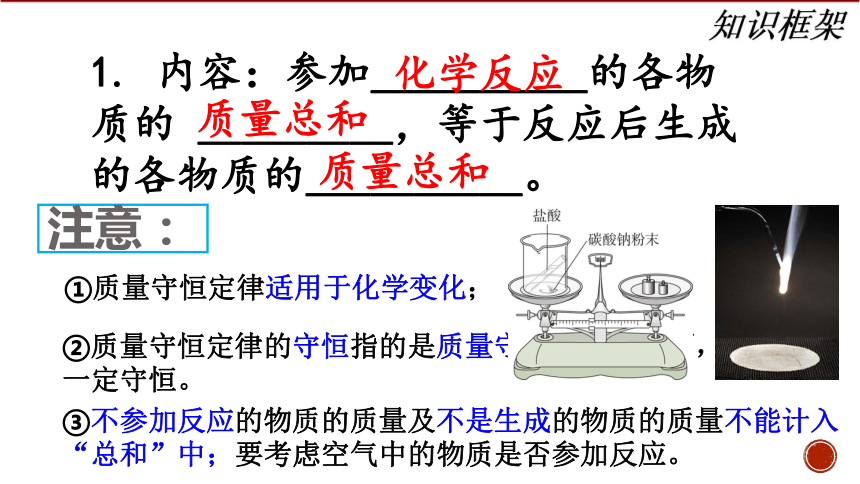
1. 内容:参加__________的各物质的 _________,等于反应后生成的各物质的__________。
知识框架
化学反应
质量总和
质量总和
注意:
①质量守恒定律适用于化学变化;
②质量守恒定律的守恒指的是质量守恒;其他方面,如体积不一定守恒。
③不参加反应的物质的质量及不是生成的物质的质量不能计入“总和”中;要考虑空气中的物质是否参加反应。
典型案例
上册教材98页3 解释现象
参加反应的铜粉质量 生成的氧化铜的质量
+空气中的氧气的质量
=
生成的氧化铜的质量 > 参加反应的铜粉质量
分析:根据质量守恒定律
结论:
典型案例
上册教材98页3 解释现象
分析:根据质量守恒定律
结论:
剩余固体的质量 < 参加反应的高锰酸钾的质量
剩余固体
反应的高锰酸钾质量 = 生成的锰酸钾质量+二氧化锰质量+氧气
典型案例
上册教材98页4 解释现象
分析:
结论:
是化学变化,遵守质量守恒定律。
细铁丝在氧气中燃烧,反应物是铁和氧气,生成物是四氧化三铁
参加反应的铁丝质量+氧气质量 = 生成的四氧化三铁的质量
1.质量守恒定律中的“质量”必须是真正参加化学反应的物质质量,而不是各物质质量的简单加和。
(1)5g氢气在5g氧气中燃烧生成水质量一定是10g。
×
(3)1升氢气和8升氧气反应生成9升水遵守质量守恒定律。
×
2.总和:应当包括各种物质,不能忽略反应物或生成物中的气体。
(2)纸燃烧后,剩下的灰比原来的纸轻,此反应不符合质量守恒定律。
×
3.质量守恒定律指的是“质量守恒”,不是其他物理量的守恒;如体积等。
注意理解质量守恒定律
配套练习
典型案例
上册教材98页2(2) 简单计算
分析:
D
A+B → C+D
10g
8g 4g
2g
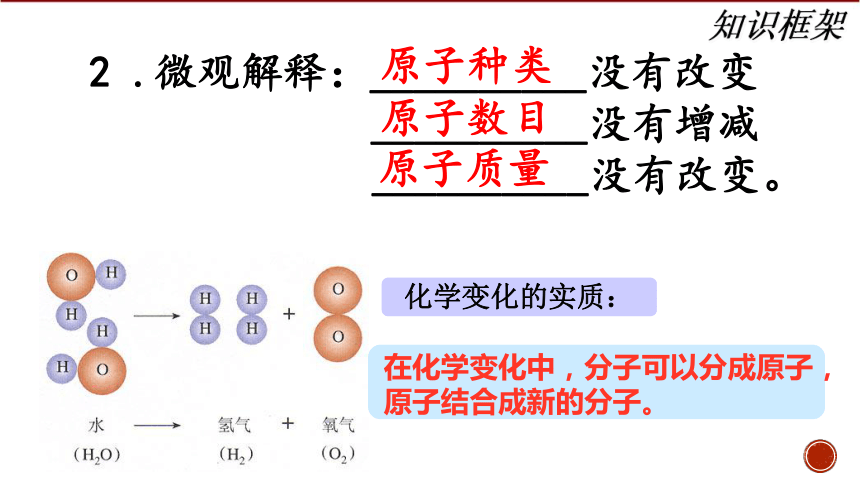
2 .微观解释:__________没有改变
__________没有增减
__________没有改变。
知识框架
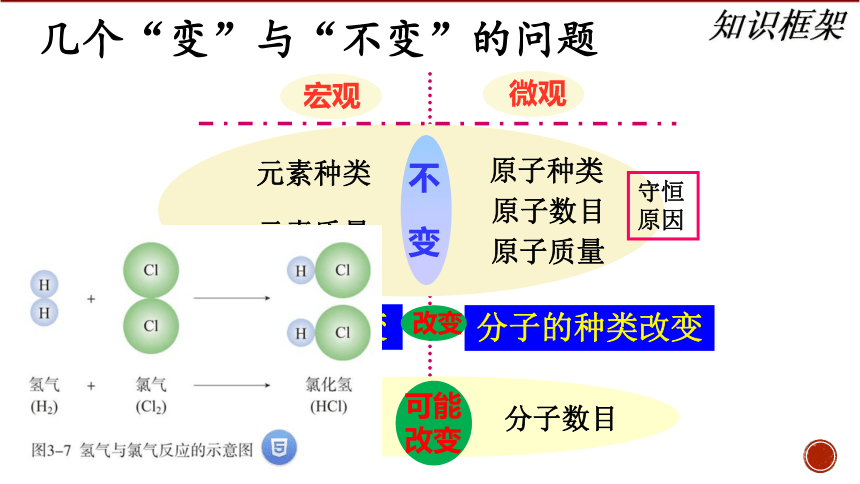
原子种类
原子数目
原子质量
元素质量
元素种类
原子数目
原子质量
原子种类
守恒原因
分子的种类改变?
分子的种类改变
可能
改变
分子数目
知识框架
几个“变”与“不变”的问题
典型案例
上册教材98页2(1)
分析:
√
√
√
√
B
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
配套练习
练习1:
分析:
在化学变化中,下列说法正确的是( )
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变。
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A.①② B.①③ C.③④ D.②④
C
×
×
√
√
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
典型案例
上册教材98页2(4) 推断物质中元素的组成
分析:
C
元素种类不变
C O
H O
O
C H
O?
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
配套练习
练习1:
分析:
NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,
不能生成的物质是( )
A.CO2 B.Cl2 C.O2 D.N2
元素种类不变
A
C
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
确定物质中元素的组成
2.4g有机物在足量氧气中完全燃烧,生成6.6gCO2和5.4gH2O,
下列说法正确的是( )
A.该有机物只含碳、氢两种元素
B.该有机物中一定含有碳、氢元素,可能含有氧元素
C.该有机物中一定含有碳、氢、氧三种元素
D.无法确定
A
典型案例
元素质量不变
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
典型案例
如下图所示,两个甲分子反应生成三个乙分子和一个丙分子,
则从图示获得的信息中,不正确的是( )
粒子模型
A.分子的种类在化学反应中发生了改变
B.乙分子中含有一个A原子,一个B原子
C.反应生成的丙物质属于单质
D.该反应的反应类型为分解反应
甲: 3A B
2甲:6A 2B
丙:2B
3乙:6A
乙:2A
两个改变之一√
×
B2√
√
B
在一定条件下,在一个密闭容器内发生某反应,测得反应过
程中各物质的质量如下表所示,下列说法错误的是( )
A.该反应是化合反应,d可能是催化剂
B.a、b两种物质中元素种类一定与c物质中元素种类相同
C.b物质可能是单质
D.反应后a物质的质量为3 g
+11g
-8g
生成物
反应物
不变
催化剂或杂质
-3g
7g
典型案例
图表题
反应物
a+b→c
3 8 11
√
√
√
×
D
在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物
质的质量如下表。下列说法正确的是( )
A.x等于90
B.b可能是单质
C.c一定是催化剂
D.参加反应的a与d的质量比为7:8
+60g
-32g
生成物
反应物
不变
催化剂或杂质
-28g
100g
配套练习
练习1:
反应物
√
×
D
a+d → b
28 32 60
×
×
物质 a b c d
反应前的质量/g 40 40 10 32
反应后的质量/g 12 x 10 0
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,
下列说法错误的是( )
A.参加反应的甲和乙质量比为2:7
B.丙可能是该反应的催化剂
C.丁一定是化合物 D.x的值是7
练习2:
反应物
14 26 3 5
2 x 3 36
-12g
不变
催化剂或杂质
+31g
生成物
-19g
7g
反应物
×
√
√
√
A
配套练习
物质 甲 乙 丙 丁
反应前的质量/g
反应后的质量/g
(多选) 将3g某物质在氧气中充分燃烧,生成8.8g二氧化碳和5.4g水,据此可判断该物质的组成中( )
A.只含碳、氢两种元素
B.可能含有氧元素
C.一定含有氧元素
D.氢元素的质量分数为20%
该物质中一定只含碳、氢两种元素,一定不含氧元素。
CO2
H2O
C、H、O?
C、H?
8.8g
O2
5.4g
C元素的质量
H元素的质量
3g
该物质中H元素的质量分数
AD
配套练习
拓展延伸:
在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
参加化学反应的各物质的质量总和,等于反应生成的各物质的质量总和。
质量守恒定律
学习任务
解释现象
变与不变
物质的组成
图表题
简单的定量分析
二、化学方程式
—重要的化学用语
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
用______来表示_______的式子。
知识框架
书写原则:
化学式
化学反应
用化学方程式来表示化学反应具有哪些优点呢?
(1)表示出了各反应物和生成物的组成。
(2)表示出了反应进行所需要的条件。
(3)表示出了质量守恒定律,很明显地看到原子的种类和数目没有发生变化。
把“质”和“量”有机地结合在一起!
“质”
“量”
各粒子的相对数量关系
知识框架
12 :(2×16) :(12 +2×16)
12 : 32 : 44
化学方程式表示了哪些意义?
反应物
生成物
“和”
“生成”
“反应条件”
知识框架
化学方程式的意义:
1.表明化学反应中的反应物、生成物和反应条件。
2.表明反应物和生成物间的质量比。
如:碳和氧气在点燃的条件下发生反应生成二氧化碳。
12 : 32 : 44
如:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳。
知识框架
3.从微观上看,还能表示化学反应中各物质之间的微粒个数比。
如:每个碳原子和一个氧分子在点燃时生成一个二氧化碳分子。
[补充]
知识框架
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
用______来表示_______的式子。
知识框架
书写原则:
化学式
化学反应
②表示反应物、生成物各物质之间
的________;
③表示各物质粒子间的相对________。
反应物
生成物
反应条件
宏观
质量比
质量
数量关系
微观
把“宏观”和“微观”有机地结合在一起!
典型案例
上册教材98页2(2)
①宏观上,物质怎样变化;
②微观上,微粒如何变化;
③质量上,物质按照怎样的质量比进行反应。
×
D
典型案例
上册教材98页1
1.表示硫和氧气在点燃的条件下生成二氧化硫。
2.表示每32份质量的硫和32份质量的氧气在点燃的条件下生成64份质量的二氧化硫。
已知 S-32 O-16
32 :32 :64
3.粒子个数比为1:1:1。
[思考]对于 这个反应,反应物与生成物间的质量比如何表示?
31×4 ∶ 16×2×5 ∶ (31×2+16×5)×2
124 ∶ 160 ∶ 284
31 ∶ 40 ∶ 71
相对分子质量×各物质前面的化学计量数
化简后仍遵守质量守恒定律
124+160=284,31+40=71
知识框架
已知 P-31 O-16
化学方程式的读法:
化学方程式能直观地反映出化学反应中“质”和“量”的变化及关系,其读法有异于数学中的方程式。
“+”读成“和”;
“═══”读成“生成”,不能读成“等于”。
下面以磷的燃烧反应为例:
知识框架
(1)宏观:
磷和氧气在点燃的条件下生成了五氧化二磷。
(2)微观:
每4个磷原子在点燃条件下能与5个氧分子完全反应,生成2个五氧化二磷分子。
(3)质量:
每124份质量的磷在点燃的情况下,能与160份质量的氧气完全反应,生成284份质量的五氧化二磷。
知识框架
H2+O2=H2O
点燃
违背了质量守恒定律:因为反应前后氧原子的个数不相等。
H2+O2=H2O
点燃
改为:
对吗?
违背了客观事实:生成的产物应为水H2O
注意:任何情况下,都不能改动化学式右下角的角标。
2
知识框架
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
知识框架
书写原则:
以客观事实为基础
遵守质量守恒定律
(1)写:
在短线两边规范并准确写出反应物与生成物的化学式。
(2)配:
将短线两边的原子数目配平。
化学方程式的书写步骤:
知识框架
如何配?
原则:原子种类不变 原子个数相等
最小公倍数法
4
配平方法1:
知识框架
—
练习:
2
典型案例
观察反应法
2
得氧
失氧
配平方法2:
知识框架
练习:
CO + Fe3O4
高温
CO2 + Fe
3
典型案例
奇数配偶法
偶
偶
奇
2
偶
2
3
配平方法3:
知识框架
练习:
FeS2?+????O2?——???Fe2O3?+???SO2?
高温
2
4
8
2×3=6
8×2=16
6+16=22
11
典型案例
指定系数法
?C2H2?+????O2——???CO2+????H2O
点燃
1
2
1
2×2+1=5
2
5
4
2
知识框架
配平方法4:
练习:
FeS2?+????O2?——???Fe2O3?+???SO2?
高温
2
1
4
1×3+4×2=11
4
11
2
8
典型案例
方程式配平方法:
1、最小公倍数法 2、观察反应法
3、奇数配偶法 4、指定系数法
知识框架
(1)写:
在短线两边准确写出反应物与生成物的化学式。
(2)配:
将短线两边的原子数目配平。
(4)等:
(3)注:
注明反应发生条件以及生成物状态“↑”或“↓”。
何时注?怎样注?
化学方程式的书写步骤:
知识框架
②化学式前计量数必须化成最简整数比
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
知识框架
书写原则:
以客观事实为基础
遵守质量守恒定律
1.写
2.配
3.注
(条件△…… 气体↑、沉淀↓)
注意:
①不能改动化学式
方法:
典型案例
上册教材101页4
×
(1)不正确。未配平,没有注明反应条件“△”。
(2)不正确。“↑”符号使用不当。
(3)不正确。没有注明反应条件催化剂“MnO2”,O2未添加“↑”,短线未改成等号。
×
×
3. Fe+CuSO4 Cu + FeSO4
1. Mg + O2 MgO2
通电
点燃
2. H2O H2↑ + O2↑
生成物的化学式书写错误。
没有配平。
不应该标生成物的状态。
配套练习
指出错误并说明原因。
练习1:
4. 2KMnO4 K2MnO4+ MnO2+ O2
Δ
未标明气体的状态。
5. Mg+ O2 Mg2O
不应该在化学式中间配平。
6. 4H2O2 4H2O+2O2
化学计量数要化成最简整数比。
MnO2
点燃
指出错误并说明原因。
配套练习
下列化学方程式中,正确的有( )
A.①②③ B.④⑤⑥ C.①③⑤ D.都不正确
O2
2
2
点燃
去掉
2
3
2
D
配套练习
练习2:
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
知识框架
书写原则:
以客观事实为基础
遵守质量守恒定律
1.写
2.配
3.注
1.“写”化学方程式
2.“数”化学式
典型案例
为减少二氧化碳等温室气体的排放,科学家采取“组
合转化”技术,将二氧化碳和氢气在催化剂和加热条
件下转化为一种重要的化工原料乙烯(C2H4)和水,
该反应的化学方程式为:
__________________________________
根据信息写出化学方程式
典型案例
将二氧化碳和氢气在催化剂和加热条件下转化为乙烯(C2H4)和水
2
4
6
催化剂
配套练习
冰晶石在工业制取金属铝的过程中起着重要的作用。
硫酸铝和氟化钠(NaF)在共融条件下反应生成
冰晶石(Na3AlF6),同时得到硫酸钠,写出此反应
的化学方程式:
__________________________________
拓展延伸:
硫酸铝和氟化钠(NaF)在共融条件下反应生成冰晶石(Na3AlF6)和硫酸钠
2
3
12
共融
配套练习
典型案例
上册教材101页5 数化学式
分析:
C
H
O
1
4
4
C
H
O
1
4
4
X的化学式:
CH4
练习1:
某纯净物X在空气中完全燃烧,反应的化学
方程式为 2X+ 3O2 2CO2+ 4H2O,请推测
X的化学式。
分析:
C
H
O
2
8
8
C
H
O
2
8
8
-6=2
C2H8O2
×
CH4O
配套练习
练习2:
某纯净物X在空气中完全燃烧,反应的化学
方程式为 X+ 3O2 2CO2+ 2H2O,请推测
X的化学式。
分析:
C
H
O
2
4
6
C
H
O
2
4
6
CH2
×
C2H4
配套练习
三、拓展提升
1.深刻理解并掌握质量守恒定律的相关内容。
2.熟练准确书写化学方程式,理解其意义。
3.解决简单的综合计算题。
学习任务
题型
应用元素质量守恒法计算。
字母类计算。
知识框架
典型案例
由氢氧化镁和氧化镁组成的混合物,测得其中镁元素
的质量分数为48%,取该混合物10g,与稀硫酸恰好
完全反应,所得溶液中溶质的质量为( )
A.12g B.24g C.36g D.48g
元素质量守恒法
分析:
MgO + H2SO4 = MgSO4 + H2O
Mg(OH)2+H2SO4 = MgSO4 + 2H2O
镁元素质量:
10g×48%=4.8g
4.8g
4.8g
MgSO4 ~ Mg
镁元素质量:
10g×48%=4.8g
x 4.8g
解:设硫酸镁的质量为x
典型案例
120 24
x = 24g
典型案例
由氢氧化镁和氧化镁组成的混合物,测得其中镁元素
的质量分数为48%,取该混合物10g,与稀硫酸恰好
完全反应,所得溶液中溶质的质量为( )
A.12g B.24g C.36g D.48g
元素质量守恒法
分析:
MgO + H2SO4 = MgSO4 + H2O
Mg(OH)2+H2SO4 = MgSO4 + 2H2O
镁元素质量:
10g×48%=4.8g
4.8g
4.8g
B
由氧化铜和氢氧化铜组成的混合物9g,与100g9.8%
稀硫酸恰好完全反应,所得溶液中溶质的质量为( )
A.12g B.16g C.32g D.36g
练习1:
分析:
CuO + H2SO4 = CuSO4 + H2O
Cu(OH)2+H2SO4 = CuSO4 + 2H2O
9.6g
9.6g
配套练习
CuSO4 ~ SO4
x 9.6g
解:设硫酸铜的质量为x
160 96
x = 16g
配套练习
由氧化铜和氢氧化铜组成的混合物9g,与100g9.8%
稀硫酸恰好完全反应,所得溶液中溶质的质量为( )
A.12g B.16g C.32g D.36g
练习1:
分析:
CuO + H2SO4 = CuSO4 + H2O
Cu(OH)2+H2SO4 = CuSO4 + 2H2O
9.6g
9.6g
配套练习
B
典型案例
已知反应A+B=C+D,且A与B参加反应的总质量
为20g,若反应后生成的C和D的质量比为2:3,则反应
中生成C的质量为( )
A.8g B.l0g C.12g D.16g
字母类计算
分析:
A + B = C + D
20g
20g
C+D=20g
C/D=2/3
A
在反应A+B=C+D中,C、D的相对分子质量之比
为9∶32。若0.2gA与8gB恰好完全反应,则生成D的
质量为( )
A.0.9g B.1.8g C.3.2g D.6.4g
练习1:
分析:
A + B = C + D
8.2g
8.2g
C+D=8.2g
C/D=9/32
D
配套练习
己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全
反应生成4.4gC.又知D的相对分子质量为18,则A的
相对分子质量为( )
A.23 B.46 C.92 D.96
练习2:
分析:
A+3B=2C+3D
2.3g 4.8g 4.4g
+ - =
2.7g
18
54
x
x = 46
B
配套练习
在化学反应A + 2B = C + 2D中,已知16 g A与64 g B恰好
完全反应,生成C和D的质量比为11︰9,又知B的相对
分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
练习3:
分析:
A + 2B = C + 2D
配套练习
80g
80g
C+D=80g
C/D=11/9
C=44g
D=36g
在化学反应A + 2B = C + 2D中,已知16 g A与64 g B
恰好完全反应,生成C和D的质量比为11︰9,又知
B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
分析:
A + 2B = C + 2D
配套练习
C=44g
D=36g
64g 36g
64 2x
C
练习3:
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下
用足量CO还原,得到金属混合物2.41g,将生成的CO2气
体用足量的澄清石灰水吸收后,产生5.00g白色沉淀,则
a的数值为( )
A.7.41 B.3.59 C.3.21 D.2.46
拓展延伸:
配套练习
x 5g
解:二氧化碳的质量为x
44 100
x = 2.2g
配套练习
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下
用足量CO还原,得到金属混合物2.41g,生成CO2气
体2.2g,则a的数值为( )
A.7.41 B.3.59 C.3.21 D.2.46
拓展延伸:
配套练习
配套练习
CO+O→CO2
2.2g
x
16 44
x = 0.8g
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下
用足量CO还原,得到金属混合物2.41g,生成CO2气
体2.2g,则a的数值为( )
A.7.41 B.3.59 C.3.21 D.2.46
拓展延伸:
配套练习
2.41g+0.8g=3.21g
C
夯实基础
细心审题
规范作答
再 见
授课教师:赵春华
指导教师:刘红梅 张蕊
人教版义务教育教科书 化学 九年级上册
学 校:天津市汇森中学
学习任务
知识框架
化学方程式
质量守恒定律
化学方程式书写
利用方程式
简单计算
探究实验
内容、微观解释
相关计算
意义并能推断
未知物质
书写原则
书写方法
配平方法
一、质量守恒定律
知识框架
1. 内容:参加__________的各物质的 _________,等于反应后生成的各物质的__________。
知识框架
化学反应
质量总和
质量总和
注意:
①质量守恒定律适用于化学变化;
②质量守恒定律的守恒指的是质量守恒;其他方面,如体积不一定守恒。
③不参加反应的物质的质量及不是生成的物质的质量不能计入“总和”中;要考虑空气中的物质是否参加反应。
典型案例
上册教材98页3 解释现象
参加反应的铜粉质量 生成的氧化铜的质量
+空气中的氧气的质量
=
生成的氧化铜的质量 > 参加反应的铜粉质量
分析:根据质量守恒定律
结论:
典型案例
上册教材98页3 解释现象
分析:根据质量守恒定律
结论:
剩余固体的质量 < 参加反应的高锰酸钾的质量
剩余固体
反应的高锰酸钾质量 = 生成的锰酸钾质量+二氧化锰质量+氧气
典型案例
上册教材98页4 解释现象
分析:
结论:
是化学变化,遵守质量守恒定律。
细铁丝在氧气中燃烧,反应物是铁和氧气,生成物是四氧化三铁
参加反应的铁丝质量+氧气质量 = 生成的四氧化三铁的质量
1.质量守恒定律中的“质量”必须是真正参加化学反应的物质质量,而不是各物质质量的简单加和。
(1)5g氢气在5g氧气中燃烧生成水质量一定是10g。
×
(3)1升氢气和8升氧气反应生成9升水遵守质量守恒定律。
×
2.总和:应当包括各种物质,不能忽略反应物或生成物中的气体。
(2)纸燃烧后,剩下的灰比原来的纸轻,此反应不符合质量守恒定律。
×
3.质量守恒定律指的是“质量守恒”,不是其他物理量的守恒;如体积等。
注意理解质量守恒定律
配套练习
典型案例
上册教材98页2(2) 简单计算
分析:
D
A+B → C+D
10g
8g 4g
2g
2 .微观解释:__________没有改变
__________没有增减
__________没有改变。
知识框架
原子种类
原子数目
原子质量
元素质量
元素种类
原子数目
原子质量
原子种类
守恒原因
分子的种类改变?
分子的种类改变
可能
改变
分子数目
知识框架
几个“变”与“不变”的问题
典型案例
上册教材98页2(1)
分析:
√
√
√
√
B
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
配套练习
练习1:
分析:
在化学变化中,下列说法正确的是( )
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变。
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A.①② B.①③ C.③④ D.②④
C
×
×
√
√
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
典型案例
上册教材98页2(4) 推断物质中元素的组成
分析:
C
元素种类不变
C O
H O
O
C H
O?
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
配套练习
练习1:
分析:
NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,
不能生成的物质是( )
A.CO2 B.Cl2 C.O2 D.N2
元素种类不变
A
C
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
确定物质中元素的组成
2.4g有机物在足量氧气中完全燃烧,生成6.6gCO2和5.4gH2O,
下列说法正确的是( )
A.该有机物只含碳、氢两种元素
B.该有机物中一定含有碳、氢元素,可能含有氧元素
C.该有机物中一定含有碳、氢、氧三种元素
D.无法确定
A
典型案例
元素质量不变
微观 原子种类不变 分子种类改变 分子数目可能改变
原子数目不变
原子质量不变
宏观 元素种类不变 物质种类改变
元素质量不变
典型案例
如下图所示,两个甲分子反应生成三个乙分子和一个丙分子,
则从图示获得的信息中,不正确的是( )
粒子模型
A.分子的种类在化学反应中发生了改变
B.乙分子中含有一个A原子,一个B原子
C.反应生成的丙物质属于单质
D.该反应的反应类型为分解反应
甲: 3A B
2甲:6A 2B
丙:2B
3乙:6A
乙:2A
两个改变之一√
×
B2√
√
B
在一定条件下,在一个密闭容器内发生某反应,测得反应过
程中各物质的质量如下表所示,下列说法错误的是( )
A.该反应是化合反应,d可能是催化剂
B.a、b两种物质中元素种类一定与c物质中元素种类相同
C.b物质可能是单质
D.反应后a物质的质量为3 g
+11g
-8g
生成物
反应物
不变
催化剂或杂质
-3g
7g
典型案例
图表题
反应物
a+b→c
3 8 11
√
√
√
×
D
在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物
质的质量如下表。下列说法正确的是( )
A.x等于90
B.b可能是单质
C.c一定是催化剂
D.参加反应的a与d的质量比为7:8
+60g
-32g
生成物
反应物
不变
催化剂或杂质
-28g
100g
配套练习
练习1:
反应物
√
×
D
a+d → b
28 32 60
×
×
物质 a b c d
反应前的质量/g 40 40 10 32
反应后的质量/g 12 x 10 0
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,
下列说法错误的是( )
A.参加反应的甲和乙质量比为2:7
B.丙可能是该反应的催化剂
C.丁一定是化合物 D.x的值是7
练习2:
反应物
14 26 3 5
2 x 3 36
-12g
不变
催化剂或杂质
+31g
生成物
-19g
7g
反应物
×
√
√
√
A
配套练习
物质 甲 乙 丙 丁
反应前的质量/g
反应后的质量/g
(多选) 将3g某物质在氧气中充分燃烧,生成8.8g二氧化碳和5.4g水,据此可判断该物质的组成中( )
A.只含碳、氢两种元素
B.可能含有氧元素
C.一定含有氧元素
D.氢元素的质量分数为20%
该物质中一定只含碳、氢两种元素,一定不含氧元素。
CO2
H2O
C、H、O?
C、H?
8.8g
O2
5.4g
C元素的质量
H元素的质量
3g
该物质中H元素的质量分数
AD
配套练习
拓展延伸:
在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
参加化学反应的各物质的质量总和,等于反应生成的各物质的质量总和。
质量守恒定律
学习任务
解释现象
变与不变
物质的组成
图表题
简单的定量分析
二、化学方程式
—重要的化学用语
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
用______来表示_______的式子。
知识框架
书写原则:
化学式
化学反应
用化学方程式来表示化学反应具有哪些优点呢?
(1)表示出了各反应物和生成物的组成。
(2)表示出了反应进行所需要的条件。
(3)表示出了质量守恒定律,很明显地看到原子的种类和数目没有发生变化。
把“质”和“量”有机地结合在一起!
“质”
“量”
各粒子的相对数量关系
知识框架
12 :(2×16) :(12 +2×16)
12 : 32 : 44
化学方程式表示了哪些意义?
反应物
生成物
“和”
“生成”
“反应条件”
知识框架
化学方程式的意义:
1.表明化学反应中的反应物、生成物和反应条件。
2.表明反应物和生成物间的质量比。
如:碳和氧气在点燃的条件下发生反应生成二氧化碳。
12 : 32 : 44
如:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳。
知识框架
3.从微观上看,还能表示化学反应中各物质之间的微粒个数比。
如:每个碳原子和一个氧分子在点燃时生成一个二氧化碳分子。
[补充]
知识框架
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
用______来表示_______的式子。
知识框架
书写原则:
化学式
化学反应
②表示反应物、生成物各物质之间
的________;
③表示各物质粒子间的相对________。
反应物
生成物
反应条件
宏观
质量比
质量
数量关系
微观
把“宏观”和“微观”有机地结合在一起!
典型案例
上册教材98页2(2)
①宏观上,物质怎样变化;
②微观上,微粒如何变化;
③质量上,物质按照怎样的质量比进行反应。
×
D
典型案例
上册教材98页1
1.表示硫和氧气在点燃的条件下生成二氧化硫。
2.表示每32份质量的硫和32份质量的氧气在点燃的条件下生成64份质量的二氧化硫。
已知 S-32 O-16
32 :32 :64
3.粒子个数比为1:1:1。
[思考]对于 这个反应,反应物与生成物间的质量比如何表示?
31×4 ∶ 16×2×5 ∶ (31×2+16×5)×2
124 ∶ 160 ∶ 284
31 ∶ 40 ∶ 71
相对分子质量×各物质前面的化学计量数
化简后仍遵守质量守恒定律
124+160=284,31+40=71
知识框架
已知 P-31 O-16
化学方程式的读法:
化学方程式能直观地反映出化学反应中“质”和“量”的变化及关系,其读法有异于数学中的方程式。
“+”读成“和”;
“═══”读成“生成”,不能读成“等于”。
下面以磷的燃烧反应为例:
知识框架
(1)宏观:
磷和氧气在点燃的条件下生成了五氧化二磷。
(2)微观:
每4个磷原子在点燃条件下能与5个氧分子完全反应,生成2个五氧化二磷分子。
(3)质量:
每124份质量的磷在点燃的情况下,能与160份质量的氧气完全反应,生成284份质量的五氧化二磷。
知识框架
H2+O2=H2O
点燃
违背了质量守恒定律:因为反应前后氧原子的个数不相等。
H2+O2=H2O
点燃
改为:
对吗?
违背了客观事实:生成的产物应为水H2O
注意:任何情况下,都不能改动化学式右下角的角标。
2
知识框架
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
知识框架
书写原则:
以客观事实为基础
遵守质量守恒定律
(1)写:
在短线两边规范并准确写出反应物与生成物的化学式。
(2)配:
将短线两边的原子数目配平。
化学方程式的书写步骤:
知识框架
如何配?
原则:原子种类不变 原子个数相等
最小公倍数法
4
配平方法1:
知识框架
—
练习:
2
典型案例
观察反应法
2
得氧
失氧
配平方法2:
知识框架
练习:
CO + Fe3O4
高温
CO2 + Fe
3
典型案例
奇数配偶法
偶
偶
奇
2
偶
2
3
配平方法3:
知识框架
练习:
FeS2?+????O2?——???Fe2O3?+???SO2?
高温
2
4
8
2×3=6
8×2=16
6+16=22
11
典型案例
指定系数法
?C2H2?+????O2——???CO2+????H2O
点燃
1
2
1
2×2+1=5
2
5
4
2
知识框架
配平方法4:
练习:
FeS2?+????O2?——???Fe2O3?+???SO2?
高温
2
1
4
1×3+4×2=11
4
11
2
8
典型案例
方程式配平方法:
1、最小公倍数法 2、观察反应法
3、奇数配偶法 4、指定系数法
知识框架
(1)写:
在短线两边准确写出反应物与生成物的化学式。
(2)配:
将短线两边的原子数目配平。
(4)等:
(3)注:
注明反应发生条件以及生成物状态“↑”或“↓”。
何时注?怎样注?
化学方程式的书写步骤:
知识框架
②化学式前计量数必须化成最简整数比
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
知识框架
书写原则:
以客观事实为基础
遵守质量守恒定律
1.写
2.配
3.注
(条件△…… 气体↑、沉淀↓)
注意:
①不能改动化学式
方法:
典型案例
上册教材101页4
×
(1)不正确。未配平,没有注明反应条件“△”。
(2)不正确。“↑”符号使用不当。
(3)不正确。没有注明反应条件催化剂“MnO2”,O2未添加“↑”,短线未改成等号。
×
×
3. Fe+CuSO4 Cu + FeSO4
1. Mg + O2 MgO2
通电
点燃
2. H2O H2↑ + O2↑
生成物的化学式书写错误。
没有配平。
不应该标生成物的状态。
配套练习
指出错误并说明原因。
练习1:
4. 2KMnO4 K2MnO4+ MnO2+ O2
Δ
未标明气体的状态。
5. Mg+ O2 Mg2O
不应该在化学式中间配平。
6. 4H2O2 4H2O+2O2
化学计量数要化成最简整数比。
MnO2
点燃
指出错误并说明原因。
配套练习
下列化学方程式中,正确的有( )
A.①②③ B.④⑤⑥ C.①③⑤ D.都不正确
O2
2
2
点燃
去掉
2
3
2
D
配套练习
练习2:
化 学 方 程 式
概念:
意义:
书写步骤:
应用:
知识框架
书写原则:
以客观事实为基础
遵守质量守恒定律
1.写
2.配
3.注
1.“写”化学方程式
2.“数”化学式
典型案例
为减少二氧化碳等温室气体的排放,科学家采取“组
合转化”技术,将二氧化碳和氢气在催化剂和加热条
件下转化为一种重要的化工原料乙烯(C2H4)和水,
该反应的化学方程式为:
__________________________________
根据信息写出化学方程式
典型案例
将二氧化碳和氢气在催化剂和加热条件下转化为乙烯(C2H4)和水
2
4
6
催化剂
配套练习
冰晶石在工业制取金属铝的过程中起着重要的作用。
硫酸铝和氟化钠(NaF)在共融条件下反应生成
冰晶石(Na3AlF6),同时得到硫酸钠,写出此反应
的化学方程式:
__________________________________
拓展延伸:
硫酸铝和氟化钠(NaF)在共融条件下反应生成冰晶石(Na3AlF6)和硫酸钠
2
3
12
共融
配套练习
典型案例
上册教材101页5 数化学式
分析:
C
H
O
1
4
4
C
H
O
1
4
4
X的化学式:
CH4
练习1:
某纯净物X在空气中完全燃烧,反应的化学
方程式为 2X+ 3O2 2CO2+ 4H2O,请推测
X的化学式。
分析:
C
H
O
2
8
8
C
H
O
2
8
8
-6=2
C2H8O2
×
CH4O
配套练习
练习2:
某纯净物X在空气中完全燃烧,反应的化学
方程式为 X+ 3O2 2CO2+ 2H2O,请推测
X的化学式。
分析:
C
H
O
2
4
6
C
H
O
2
4
6
CH2
×
C2H4
配套练习
三、拓展提升
1.深刻理解并掌握质量守恒定律的相关内容。
2.熟练准确书写化学方程式,理解其意义。
3.解决简单的综合计算题。
学习任务
题型
应用元素质量守恒法计算。
字母类计算。
知识框架
典型案例
由氢氧化镁和氧化镁组成的混合物,测得其中镁元素
的质量分数为48%,取该混合物10g,与稀硫酸恰好
完全反应,所得溶液中溶质的质量为( )
A.12g B.24g C.36g D.48g
元素质量守恒法
分析:
MgO + H2SO4 = MgSO4 + H2O
Mg(OH)2+H2SO4 = MgSO4 + 2H2O
镁元素质量:
10g×48%=4.8g
4.8g
4.8g
MgSO4 ~ Mg
镁元素质量:
10g×48%=4.8g
x 4.8g
解:设硫酸镁的质量为x
典型案例
120 24
x = 24g
典型案例
由氢氧化镁和氧化镁组成的混合物,测得其中镁元素
的质量分数为48%,取该混合物10g,与稀硫酸恰好
完全反应,所得溶液中溶质的质量为( )
A.12g B.24g C.36g D.48g
元素质量守恒法
分析:
MgO + H2SO4 = MgSO4 + H2O
Mg(OH)2+H2SO4 = MgSO4 + 2H2O
镁元素质量:
10g×48%=4.8g
4.8g
4.8g
B
由氧化铜和氢氧化铜组成的混合物9g,与100g9.8%
稀硫酸恰好完全反应,所得溶液中溶质的质量为( )
A.12g B.16g C.32g D.36g
练习1:
分析:
CuO + H2SO4 = CuSO4 + H2O
Cu(OH)2+H2SO4 = CuSO4 + 2H2O
9.6g
9.6g
配套练习
CuSO4 ~ SO4
x 9.6g
解:设硫酸铜的质量为x
160 96
x = 16g
配套练习
由氧化铜和氢氧化铜组成的混合物9g,与100g9.8%
稀硫酸恰好完全反应,所得溶液中溶质的质量为( )
A.12g B.16g C.32g D.36g
练习1:
分析:
CuO + H2SO4 = CuSO4 + H2O
Cu(OH)2+H2SO4 = CuSO4 + 2H2O
9.6g
9.6g
配套练习
B
典型案例
已知反应A+B=C+D,且A与B参加反应的总质量
为20g,若反应后生成的C和D的质量比为2:3,则反应
中生成C的质量为( )
A.8g B.l0g C.12g D.16g
字母类计算
分析:
A + B = C + D
20g
20g
C+D=20g
C/D=2/3
A
在反应A+B=C+D中,C、D的相对分子质量之比
为9∶32。若0.2gA与8gB恰好完全反应,则生成D的
质量为( )
A.0.9g B.1.8g C.3.2g D.6.4g
练习1:
分析:
A + B = C + D
8.2g
8.2g
C+D=8.2g
C/D=9/32
D
配套练习
己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全
反应生成4.4gC.又知D的相对分子质量为18,则A的
相对分子质量为( )
A.23 B.46 C.92 D.96
练习2:
分析:
A+3B=2C+3D
2.3g 4.8g 4.4g
+ - =
2.7g
18
54
x
x = 46
B
配套练习
在化学反应A + 2B = C + 2D中,已知16 g A与64 g B恰好
完全反应,生成C和D的质量比为11︰9,又知B的相对
分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
练习3:
分析:
A + 2B = C + 2D
配套练习
80g
80g
C+D=80g
C/D=11/9
C=44g
D=36g
在化学反应A + 2B = C + 2D中,已知16 g A与64 g B
恰好完全反应,生成C和D的质量比为11︰9,又知
B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
分析:
A + 2B = C + 2D
配套练习
C=44g
D=36g
64g 36g
64 2x
C
练习3:
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下
用足量CO还原,得到金属混合物2.41g,将生成的CO2气
体用足量的澄清石灰水吸收后,产生5.00g白色沉淀,则
a的数值为( )
A.7.41 B.3.59 C.3.21 D.2.46
拓展延伸:
配套练习
x 5g
解:二氧化碳的质量为x
44 100
x = 2.2g
配套练习
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下
用足量CO还原,得到金属混合物2.41g,生成CO2气
体2.2g,则a的数值为( )
A.7.41 B.3.59 C.3.21 D.2.46
拓展延伸:
配套练习
配套练习
CO+O→CO2
2.2g
x
16 44
x = 0.8g
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下
用足量CO还原,得到金属混合物2.41g,生成CO2气
体2.2g,则a的数值为( )
A.7.41 B.3.59 C.3.21 D.2.46
拓展延伸:
配套练习
2.41g+0.8g=3.21g
C
夯实基础
细心审题
规范作答
再 见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
