化学鲁科版(2019)第一章微项目海带提碘与海水提溴——体验元素性质递变规律的实际应用学案(含答案)
文档属性
| 名称 | 化学鲁科版(2019)第一章微项目海带提碘与海水提溴——体验元素性质递变规律的实际应用学案(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 361.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-20 00:00:00 | ||
图片预览


文档简介
微项目海带提碘与海水提溴
——体验元素性质递变规律的实际应用
【核心素养发展目标】
1.以海带提碘和海水提溴为例,体会元素周期律、元素周期表在 分 析、解决实际问题中的价值。
2.以海带提碘和海水提溴为例,形成物质分离、富集、提取的基 本 思路,体会绿色化学观念在生产实际中的应用。
【知识梳理】
一、海带提碘
1.海带中碘元素的检验
(1)检验原理
①2I-+Cl2===I2+2Cl-或2I-+H2O2+2H+===I2+2H2O(填离子方程式)。
②碘单质遇淀粉变蓝。
(2)实验流程步骤
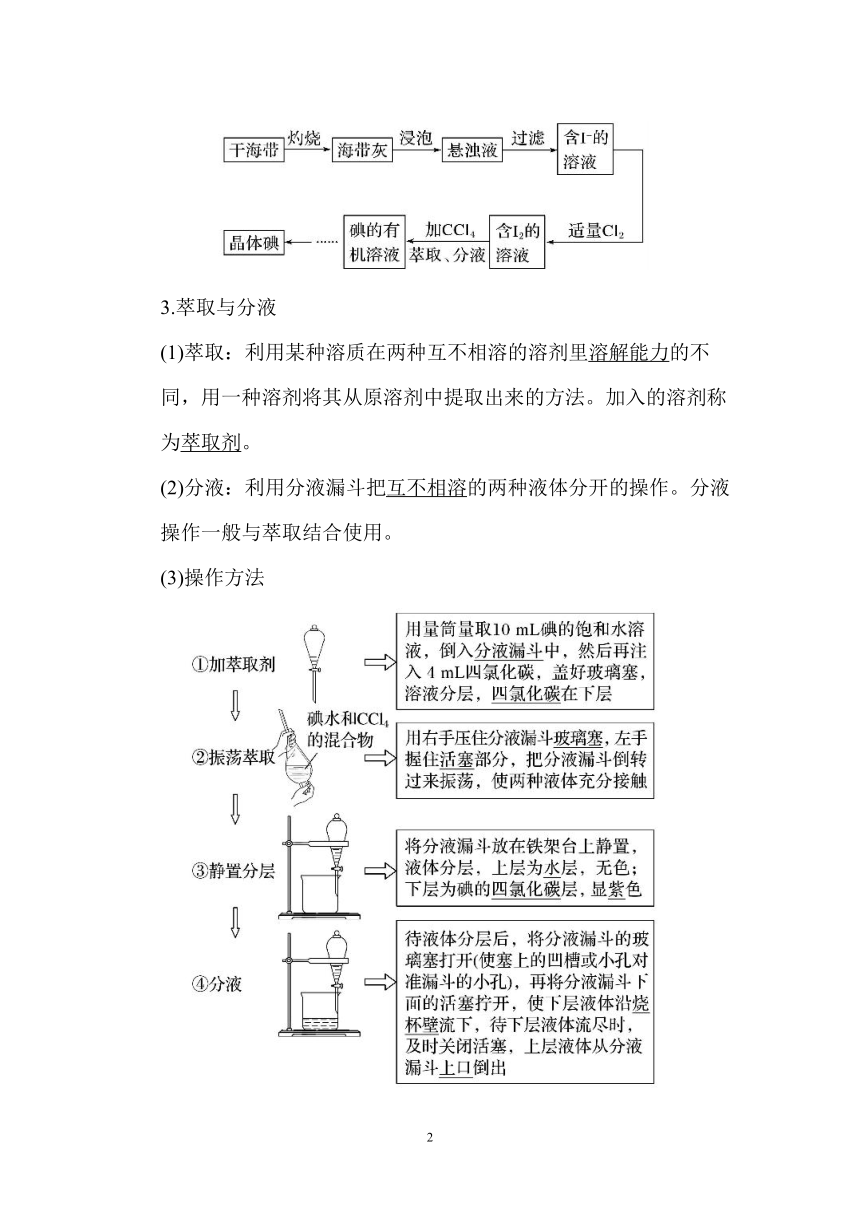
2.从海带中提取碘的原理及实验流程
(1)原理
①选取氧化剂氯水)将I- 氧化为碘单质,离子方程式:
2I- +Cl2===I2+2C1—。
②溶液中的碘单质用苯或CCl4萃取、分液提取。
(2)实验流程
3.萃取与分液
(1)萃取:利用某种溶质在两种互不相溶的溶剂里溶解能力的不 同,用一种溶剂将其从原溶剂中提取出来的方法。加入的溶剂称 为萃取剂。
(2)分液:利用分液漏斗把互不相溶的两种液体分开的操作。分液 操作一般与萃取结合使用。
(3)操作方法
(4)注意事项
①振荡时,要不时的旋开活塞放气,以防止分液漏业内压强过大 引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下, 防止液体飞溅。
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层 液体流出。
④上层液体要从上口倒出,保证上层液体尽量少地沽附下层液体。
二、海水提溴
1.从苦卤中提取溴单质
(1)写出①中反应的离子方程式:2Br—+Cl2===Br2+2Cl—。
(2)③中常用的吸收剂是二氧化硫,反应的化学方程式: SO2+Br2+2H2O===2HBr + H2SO4。
(3)写出④中反应的化学方程式:2HB+Cl2===2HCl+Br2。.
2.卤素单质的提取反应原理比较
海带提碘 ①流程:海带→浸泡→过滤→氧化→提纯→碘单质;②主要反应:2I-+Cl2===2Cl-+I2
海水提溴 ①方法:浓缩海水→氧化→吹出→吸收→氧化→溴单质;②主要反应:2Br-+Cl2==2Cl—+Br2
提取氯气 ①常利用电解饱和食盐水提取氯气;②2NaCl+2H2O2NaOH+H2↑+Cl2↑
(1)相同点:都是将卤素离子(Cl—、Br—、I—)氧化为卤素单质。
(2)不同点:工业上提取氯气常用电解法,提取碘单质和溴单质常 用氧化剂氧化法。
【拓展探究】
从碘的四氯化碳溶液中提取碘
(1)碘单质与浓氢氧化钠反应的离子方程式为
3I2+6OH—===5I—+IO3+3H2O。
(2)反萃取法:像这种将富集在四氯化碳中的碘单质利用化学转化 法重新富集在水中的方法。
思考:结合元素周期律解释采用不同方法提取氯、溴、碘单质的 原因。
【跟踪练习】
1.下列关于四氯化碳用于萃取碘水中碘的理由不正确的是( )。
A.四氯化碳的密度比水大
B.四氯化碳与水和碘均不反应
C.四氯化碳与原溶剂水互不想溶
D.碘在四氯化碳中的溶解度比在水中大得多
【答案】A
【解析】萃取剂应与原溶剂互不相溶,与原溶剂、溶质不发生反 应,且溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度。
目前从海水中提取的溴约占世界溴年产量的三分之一,从海水 中提取溴的主要步骤可表示为( )。
A.氧化→吸收→吹出
B.氧化→吹出→吸收
C.吹出→氧化→吸收
D.吹出→吸收→氧化
【答案】B
【解析】从海水中提取溴,先用氧化剂将溴离子氧化为溴单质, 再用热空气吹出后用碱液吸收。
3.目前从海水中提取溴常用的方法之一是用氧化剂把溴离子氧化 成单质,再通入热空气将溴蒸气吹出,这一反应中常用的氧化剂 是( )。
A.氯气 B.单质溴 C.水 D.双氧水
【答案】A
【解析】常用方法是通入氯气把浓缩溶液中的溴化物氧化,然后 用空气把生成的溴吹出。
4.海带、紫菜中均含有丰富的碘元素,从海带中提取碘单质的流 程如下,思考解答下列问题:
(1 )碘在海带中的存在形式是 。
(2)实验操作③的名称是 。
(3)根据元素周期表中元素性质的递变规律,实验操作④可选用的 氧化剂是 ,反应的离子方程式是 。
(4)实验操作⑤中可选用的有机试剂为 (填字母),说明未 选取的理由 。
A.四氯化碳 B.酒精 C.苯
(5)为使海带灰中碘离子转化为碘的有机溶液,实验室里有烧杯、 玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的 夹持仪器、物品,尚缺少的玻璃仪器是 。
【答案】(1)碘化物 (2)过滤
(3)氯水(或溴水) 2I—+Cl2===I2+2Cl—(或2I—+Br2===I2+2Br—)
(4)AC 酒精与水互溶 (5)漏斗、分液漏斗
——体验元素性质递变规律的实际应用
【核心素养发展目标】
1.以海带提碘和海水提溴为例,体会元素周期律、元素周期表在 分 析、解决实际问题中的价值。
2.以海带提碘和海水提溴为例,形成物质分离、富集、提取的基 本 思路,体会绿色化学观念在生产实际中的应用。
【知识梳理】
一、海带提碘
1.海带中碘元素的检验
(1)检验原理
①2I-+Cl2===I2+2Cl-或2I-+H2O2+2H+===I2+2H2O(填离子方程式)。
②碘单质遇淀粉变蓝。
(2)实验流程步骤
2.从海带中提取碘的原理及实验流程
(1)原理
①选取氧化剂氯水)将I- 氧化为碘单质,离子方程式:
2I- +Cl2===I2+2C1—。
②溶液中的碘单质用苯或CCl4萃取、分液提取。
(2)实验流程
3.萃取与分液
(1)萃取:利用某种溶质在两种互不相溶的溶剂里溶解能力的不 同,用一种溶剂将其从原溶剂中提取出来的方法。加入的溶剂称 为萃取剂。
(2)分液:利用分液漏斗把互不相溶的两种液体分开的操作。分液 操作一般与萃取结合使用。
(3)操作方法
(4)注意事项
①振荡时,要不时的旋开活塞放气,以防止分液漏业内压强过大 引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下, 防止液体飞溅。
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层 液体流出。
④上层液体要从上口倒出,保证上层液体尽量少地沽附下层液体。
二、海水提溴
1.从苦卤中提取溴单质
(1)写出①中反应的离子方程式:2Br—+Cl2===Br2+2Cl—。
(2)③中常用的吸收剂是二氧化硫,反应的化学方程式: SO2+Br2+2H2O===2HBr + H2SO4。
(3)写出④中反应的化学方程式:2HB+Cl2===2HCl+Br2。.
2.卤素单质的提取反应原理比较
海带提碘 ①流程:海带→浸泡→过滤→氧化→提纯→碘单质;②主要反应:2I-+Cl2===2Cl-+I2
海水提溴 ①方法:浓缩海水→氧化→吹出→吸收→氧化→溴单质;②主要反应:2Br-+Cl2==2Cl—+Br2
提取氯气 ①常利用电解饱和食盐水提取氯气;②2NaCl+2H2O2NaOH+H2↑+Cl2↑
(1)相同点:都是将卤素离子(Cl—、Br—、I—)氧化为卤素单质。
(2)不同点:工业上提取氯气常用电解法,提取碘单质和溴单质常 用氧化剂氧化法。
【拓展探究】
从碘的四氯化碳溶液中提取碘
(1)碘单质与浓氢氧化钠反应的离子方程式为
3I2+6OH—===5I—+IO3+3H2O。
(2)反萃取法:像这种将富集在四氯化碳中的碘单质利用化学转化 法重新富集在水中的方法。
思考:结合元素周期律解释采用不同方法提取氯、溴、碘单质的 原因。
【跟踪练习】
1.下列关于四氯化碳用于萃取碘水中碘的理由不正确的是( )。
A.四氯化碳的密度比水大
B.四氯化碳与水和碘均不反应
C.四氯化碳与原溶剂水互不想溶
D.碘在四氯化碳中的溶解度比在水中大得多
【答案】A
【解析】萃取剂应与原溶剂互不相溶,与原溶剂、溶质不发生反 应,且溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度。
目前从海水中提取的溴约占世界溴年产量的三分之一,从海水 中提取溴的主要步骤可表示为( )。
A.氧化→吸收→吹出
B.氧化→吹出→吸收
C.吹出→氧化→吸收
D.吹出→吸收→氧化
【答案】B
【解析】从海水中提取溴,先用氧化剂将溴离子氧化为溴单质, 再用热空气吹出后用碱液吸收。
3.目前从海水中提取溴常用的方法之一是用氧化剂把溴离子氧化 成单质,再通入热空气将溴蒸气吹出,这一反应中常用的氧化剂 是( )。
A.氯气 B.单质溴 C.水 D.双氧水
【答案】A
【解析】常用方法是通入氯气把浓缩溶液中的溴化物氧化,然后 用空气把生成的溴吹出。
4.海带、紫菜中均含有丰富的碘元素,从海带中提取碘单质的流 程如下,思考解答下列问题:
(1 )碘在海带中的存在形式是 。
(2)实验操作③的名称是 。
(3)根据元素周期表中元素性质的递变规律,实验操作④可选用的 氧化剂是 ,反应的离子方程式是 。
(4)实验操作⑤中可选用的有机试剂为 (填字母),说明未 选取的理由 。
A.四氯化碳 B.酒精 C.苯
(5)为使海带灰中碘离子转化为碘的有机溶液,实验室里有烧杯、 玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的 夹持仪器、物品,尚缺少的玻璃仪器是 。
【答案】(1)碘化物 (2)过滤
(3)氯水(或溴水) 2I—+Cl2===I2+2Cl—(或2I—+Br2===I2+2Br—)
(4)AC 酒精与水互溶 (5)漏斗、分液漏斗
