人教版高二化学选修4第三章第二节 水的电离和溶液的酸碱性
文档属性
| 名称 | 人教版高二化学选修4第三章第二节 水的电离和溶液的酸碱性 |

|
|
| 格式 | zip | ||
| 文件大小 | 691.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-20 00:00:00 | ||
图片预览











文档简介
(共63张PPT)
第二节 水的电离和溶液的酸碱性
第三章
水溶液中的离子平衡
一、水的电离
H2O + H2O H3O+ + OH-
H2O H+ + OH-
简写:
[思考] 水的电离常数表达式如何写?
水是一种极弱的电解质,能微弱的电离。
资料卡片:
室温(25℃)下 1L(55.6mol)水中电离的只有10-7mol ,因此水的浓度可以看做常数,因此 K 电离× c(H2O)是一个新的常数——Kw
平衡常数:K 电离=
c(H+)×c(OH-)
c(H2O)
K 电离× =
c(H+)×c(OH-)
c(H2O)
= Kw
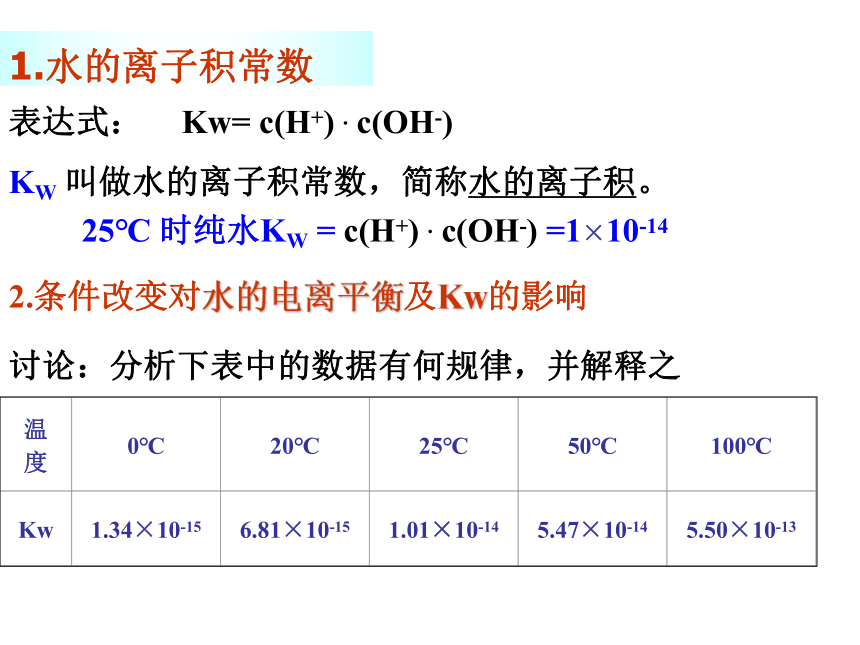
1.水的离子积常数
表达式:
Kw= c(H+) . c(OH-)
KW 叫做水的离子积常数,简称水的离子积。
25℃ 时纯水KW = c(H+) . c(OH-) =1×10-14
2.条件改变对水的电离平衡及Kw的影响
讨论:分析下表中的数据有何规律,并解释之
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.34×10-15
6.81×10-15
1.01×10-14
5.47×10-14
5.50×10-13
讨论:
?
酸碱性
水的电离平衡移动方向
c(H+)
c(OH-)
c(H+) 与c(OH-)
大小关系
Kw变化
加 热
?
?
?
?
?
?
加HCl
?
?
?
?
?
?
加NaOH
?
?
?
?
?
?
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
(2) 温度不变,向纯水中加入酸或碱,能抑制水的电离,使水的电离程度减小,但Kw不变
(1)KW只与温度有关,温度升高, (电离吸热)促进水的电离,KW值增大。
H2O H+ + OH-
【练习】
下列关于水的离子积的叙述中,正确的是( )
A KW随H+和OH-的浓度的变化而变化
B KW与水的电离常数K是同一个物理量
C 水的离子积仅仅是温度的函数,随温度的变化而变化
D KW与水的电离常数K是两个没有任何关系的物理量
C
[思考]含有H+的溶液一定是酸,含OH-的溶液一定是碱吗?任何酸中只含H+吗?任何碱中只含OH-吗?
[结论] 在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
任何水溶液中都存在Kw=c(H+) · c(OH-)
(Kw 25℃ =10-14 )
※ 2)任何溶液(中性、酸碱性溶液)水电离出的 c(H+)水=c(OH-)水
注意:1)在溶液中,Kw中的c(OH-) 、 c(H+)指溶液中各离子总浓度.
(题目不指明温度时,通常认为是25℃ )
判断正误:
1、任何水溶液中都存在水的电离平衡。
2、任何水溶液中(不论酸、碱或中性) 都存在Kw=1×10-14 。
3、某温度下,某液体c(H+)= 10-7mol/L,则该溶液一定是纯水。
4、某水溶液中c(H+) =10-7 mol/L一定是中性溶液。
5、向纯水中加入溶质,水的电离平衡将向逆向移动
√
×
×
×
×
【课 堂 练 习】
①0.01mol/L盐酸溶液中。 c(H+)、 c(OH-)分别为多少?
2.利用Kw的定量计算
c(H+) = 0.01mol/L c(OH-) = KW / c(H+) = 10-12 mol/L
c(OH-) = 0.01mol/L c(H+) = KW / c(OH-) = 10-12 mol/L
② 0.01mol/L NaOH溶液中. c(H+) 、 c(OH-)分别为多少?
1).求溶液中的c(H+)aq或c(OH-) aq
Kw = c(H+) . c(OH-) = 1×10-14
Kw = {c(H+)酸+c(H+)水} . c(OH-)水 = 1×10-14
Kw = c(H+)水 . {c(OH-)碱+c(OH-)水} = 1×10-14
由于c(H+)酸= 1×10-2》 c(H+)水,相差100倍以上,计算时忽
略水电离的H+
由于c(OH-)碱= 1×10-2》 c(OH-)水,相差100倍以上,计算时
忽略水电离的OH-
思考讨论
①0.01mol/L盐酸溶液中。由水电离出的c(H+)水、 c(OH-)水分别是多少?
②0.001mol/L NaOH溶液中。由水电离出的c(H+)水、 c(OH-)水分别是多少?
2).求由水电离出的c(H+)水 或c(OH-)水
任何水溶液中由水电离出来的c(H+)水与 c(OH-)水相等
c(H+)水 = c(OH-)水 = 10-12 mol/L
Kw = {c(H+)酸+c(H+)水} . c(OH-)水 = 1×10-14
Kw = c(H+)水 . {c(OH-)碱+c(OH-)水} = 1×10-14
c(H+)水 = c(OH-)水 = 10-11 mol/L
H2O H+ + OH-
回顾——利用Kw的定量计算的解题思路
1).求溶液中的c(H+)aq 或c(OH-)aq
2).求由水电离出的c(H+)水 或c(OH-)水
酸溶液中H+来自酸和水的电离(当两者相差100倍可以忽略小的),而溶液中OH-来自水的电离{酸溶液中c(OH-)aq =c(OH-)水}。先计算溶液中的c(H+)aq ,然后利用Kw计算c(OH-)aq ,最终根据c(H+)水 =c(OH-)水= c(OH-)aq求解。
回顾——利用Kw的定量计算的解题思路
2).求由水电离出的c(H+)水 或c(OH-)水
碱溶液中OH-来自碱和水的电离(当两者相差100倍可以忽略小的),而溶液中H+来自水的电离{碱溶液中c(H+)aq =c(H+)水},先计算溶液中的c(OH-)aq ,然后利用Kw计算c(H+)aq ,最终根据c(H+)水 =c(OH-)水= c(H+)aq 求解。
(抓主要矛盾:先求浓度大的微粒的浓度)
任何溶液中由水的电离c(H+)水 =c(OH-)水
1、某溶液中由水电离产生的c(H+) = 10-12 mol/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?
2、浓度均为0.1mol/L的下列溶液中由水电离出的c(H+) 水大小关系为:
①盐酸 ②醋酸溶液 ③硫酸溶液 ④氢氧化钠溶液
解:由水电离产生的c(H+)水= c(OH-)水= 10-12 mol/L<10-7
若溶液显碱性
c(H+) aq= c(H+) 水= 10-12 mol/L c(OH-) aq= 10-2 mol/L
若溶液显酸性
c(OH-) aq= c(OH-) 水= 10-12 mol/L c(H+) aq= 10-2 mol/L
② > ① =④ > ③
【课 堂 练 习】
10-14/0.1
10-14/0.1
10-14/0.2
10-14/0.1
>
3、 25℃,A、B、C 三种溶液,
其中A中c(H+) = 10-3mol/L ,
B中c(OH-) = 5×10-7mol/L,
C中c(H+) / c(OH-) = 106,则三种溶液的酸性强弱顺序如何?
4、 25℃,浓度均为0.1mol/L的下列溶液中c(H+)由大到小的排列顺序:
①氨水 ②NaOH ③盐酸 ④醋酸
A > C > B
B中c(H+) = KW / c(OH-) =2 × 10-8mol/L
C中c(H+) = 10-4mol/L
③ > ④ > ① > ②
讨论:25℃、100 ℃溶液的酸碱性跟溶液中H+ 和OH-浓度有什么关系?
c(H+)
mol/L c(OH-)
mol/L c(H+) 与c(OH-)
相对大小 溶液
酸碱性
蒸
馏
水
—
加酸
加碱
加热至100℃
10-7
10-7
c(H+) =c(OH-)
中性
>10-7
<10-7
c(H+) >c(OH-)
酸性
<10-7
>10-7
c(H+) <c(OH-)
碱性
10-6
10-6
c(H+) =c(OH-)
中性
中性溶液
c(H+) = c(OH-)
c(H+) = 1×10—7mol/L
c(OH-) = 1×10—7mol/L
酸性溶液
c(H+) > c(OH-)
c(H+) >1×10—7mol/L
c(OH-) <1×10—7mol/L
碱性溶液
c(H+) < c(OH-)
c(H+) < 1×10—7mol/L
c(OH-) > 1×10—7mol/L
思考:在100 ℃ 时(KW(100℃)=1×10-12) ,纯水中c(H+)为多少?c(H+) >1×10-7mol/L是否说明100 ℃ 时纯水溶液呈酸性?100℃ 时, c(H+) = 1×10-7mol/L溶液呈酸性还是碱性?
注意:溶液酸碱性是由c(H+)与c(OH-) 相对大小决定!
(常温可用 c(H+)与 1×10-7mol/L相对大小来判断)
任何温度
常温
二、溶液的酸碱性与pH
c(H+) = 1×10—6mol/L
不能
碱性
练习:
1)10-5mol/L、0.1mol/L、 0.5mol/L、 1mol/L盐酸溶液的pH分别为多少?
2) 10-5mol/L、0.1mol/L 、1mol/LNaOH溶液的pH为多少?
1、意义:
pH的大小能反映出溶液中c(H+)的高低,
即表示稀溶液酸、碱性的强弱。
2、表示:
用H+物质的量浓度的负对数来表示。
pH=-lgc(H+)
(一)pH概念
∵表示较小的c(H+)=10-12mol/L时,很麻烦但应用广
∴所以引入了一种方便方案:
c(H+) →
10-12mol/L →
12
- lg c(H+)
lgc(H+) →
-12 →
负对数—— p
H+ ——H
识记:lg2=0.3 lg5=0.7
计算碱溶液pH应先算c(OH-) ,再利用KW计算出c(H+)
二、溶液的酸碱性与pH
(5、1、0.3、0)
(9、13、14)
酸性溶液
c(H+) > c(OH-)
c(H+) >1×10—7mol/L
碱性溶液
c(H+) < c(OH-)
c(H+) <1×10—7mol/L
pH =7
pH<7
pH>7
讨论:pH变化与酸碱性变化的关系怎样?
pH越大碱性越强,pH越小酸性越强
中性溶液
c(H+) = c(OH-)
c(H+) = 1×10—7mol/L
常温下
思考:
KW(100℃)=10-12,试求在100 ℃时纯水的pH。
pH=6是否说明100 ℃时纯水成弱酸性?
任意温度下
(二)、溶液的pH与酸碱性强弱的关系
pH有关的正误判断
1、一定条件下 pH越大,溶液的酸性越强。
2、强酸溶液的pH一定小。
3、pH等于6的溶液,一定是一个弱酸体系。
4、pH相同的强酸和弱酸中c(H+)相同。
5、在常温下,pH=0的溶液酸性最强,pH=14的溶液碱性最强。
6、pH有可能等于负值。
7、常温下,由水电离出的c(H+) = 10-12mol/L,则溶液pH定为12。
8、相同体积和pH的盐酸、醋酸、硫酸,溶液中H+的物质的量相等。
×
×
×
√
×
√
×
√
精密pH试纸—0.1 pH计—0.01
酸碱指示剂-粗略测定pH大致范围
pH试纸-粗略测定pH
定性测定
定量测定
(三)pH测定方法
酸碱指示剂法(阅读教材P49)
酸碱指示剂一般是弱的有机酸或弱的有机碱。
以HIn代表石蕊分子
3.1—4.4
5.0—8.0
8.2—10.0
指示剂的变色范围
HIn(红色) H+ +In- (蓝色)
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14
甲基橙 红色 橙色 黄色
石蕊 红色 紫色 蓝色
酚酞 无色 浅红色 红色
(三)pH测定方法
1.定性测定:
讨论: pH试纸的使用
能否直接把pH试纸伸到待测液中?
是否要先湿润pH试纸?一定会产生影响?
能否用pH试纸测出pH=7.1来?
pH试纸测定溶液pH的正确操作:将干燥的pH试纸放在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在pH试纸中部,待试纸上显出颜色后马上跟标准比色卡相对比。
标准比色卡中的数据都是整数,使用pH试纸测试溶液酸碱性时读数是整数。
pH越小,颜色越红,pH越大,颜色越蓝,直至发黑;当pH为7时,呈黄绿色.
否
否,不一定
否
pH试纸法(教材P47) 、pH计法等
2.定量测定:
1. pH=6,滴入三种指示剂,各显示什么颜色?
甲基橙:黄, 石:紫, 酚:无。
4.4 — 5
2. 某溶液使甲基橙显黄色,使石蕊显红色,酚酞无色。求该溶液的 pH值范围。
[练习]
3. 如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
√
1、pH试纸使用操作中正确的是
A.将pH试纸的一端浸入溶液,观察颜色的变化
B.将pH试纸浸入溶液一会儿,再取出跟标准比色卡相比较
C.用洁净的玻璃棒蘸取被测溶液,点在pH试纸上,颜色变化后与比色卡对照
D.先将pH试纸用蒸馏水润湿,再用洁净的玻璃棒蘸取被测溶液,点在pH试纸上,颜色变化后与比色卡对照
C
【课 堂 练 习】
2、某溶液取少量滴在pH试纸上,试纸呈深蓝色,此溶液中不可能大量共存的离子是:
A.PO43- B.HCO3- C.Al3+ D.K+
B C
【课 堂 练 习】
变:某溶液由水电离出来的c(H+)=10-11mol/L,上述离子一定能大量共存的是:
D
(抓主要矛盾——先求浓度大的微粒的浓度)
(四)有关pH 的计算
练:1)、求0.05mol/L的H2SO4溶液的pH。
2)、求0.05mol/L的Ba(OH)2溶液的H+浓度及pH。
c(H+)=0.05×2mol/L
c(OH-)= 0.05×2mol/L
1)、单一溶液pH的计算
(1)酸溶液:pH=-lgc(H+)
(2)碱溶液:c(H+)= pH=-lgc(H+)
或25℃ pH+pOH=14 先求pOH=-lgc(OH-)
pH=-lgc(H+)= -lg0.1= 1
c(H+)= KW/c(OH-) =10-13mol/L
pH=-lgc(H+)= -lg10-13=13
3)、甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A、100 B、1/100 C、3 D、1/3
4)、下列溶液在常温下酸性最强的是( )
A、pH=4的溶液
B、22.4mL(标况)HCl溶于水配成1L溶液
C、c(OH-) =10-12mol/L的溶液
D、c(H+) =10-3mol/L的溶液
pH相差a,c(H+)相差10-a
B
C
5)、pH=0的溶液,下列叙述正确的是 ( )
A、是酸性最强的溶液
B、与0.5mol/LH2SO4溶液中c(H+)相同
C、 c(H+) =0的溶液
D、与1mol/L CH3COOH溶液中c(H+)相同
B
6、0.1mol/L盐酸、硫酸、醋酸pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
pH=1 的盐酸、硫酸、醋酸中c(H+)、物质的量浓度关系如何?
现有pH、体积相等的H2SO4、HCl、醋酸三种酸溶液,投入足量的相同形状、大小的锌粒,开始瞬间反应速率大小关系是_______,充分反应后生成H2体积大小(相同状况)关系是____________________。
相等
醋酸>硫酸=盐酸
pH相等→c(H+)相等;c(弱)>c(一元强)>c(多元强)
即c(HAc) >c(HCl)>c(H2SO4)
1)酸的稀释:
思考: 在25℃时,pH=5的盐酸稀释到原来的10倍,pH等于多少?如果稀释到1000倍后, pH又等于多少呢?
pH=-lgc(H+)
= -lg10-5/10
=-lg10-6
=6
2.溶液的稀释
“无限稀释7为限”
≈7
关键:
1、抓住氢离子进行计算!
2、当酸提供的c(H+)很小时(pH≥6),不能忽略水电离出的c(H+)水
“无限稀释7为限”
1)酸的稀释:
当相加、减的两个量相差100倍以上时,小的可忽略。
思考:将pH=5的醋酸溶液稀释。
① 稀释10倍,求pH(范围)
② 要使醋酸的pH由5 变到 6,加水稀释____10倍(填< 、> 、=)
练:pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示。下列说法正确的是:
A、B两酸溶液的c一定相等
稀释后,A溶液的酸性比B溶液强
a=5时,A是强酸,B是弱酸
若A、B都是弱酸,则5>a>2
a
7
2
1
pH
V/mL
1000
A
B
C、D
pH、V相同的不同酸, 稀释相同的倍数pH弱因为稀释10倍,pH小于6,所以如pH=6,要大于10倍
(5~6)
>
2) 碱的稀释
在25℃时,pH=9的NaOH溶液稀释到10倍,pH等于多少?
c(OH-)=10-5/10
=10-6
pH=-lgc(H+)
=-lgKW/c(OH-)
=-lg10-8
=8
在25℃时,pH=9的NaOH溶液稀释到1000倍后, pH为多少?
≈7
“无限稀释7为限”
关键:
1、抓住氢氧根离子进行计算!(先求OH-,再转换成H+ )
2、当碱提供的c(OH-)很小时(pH≤8),不能忽略水电离出的c(OH-)水。
pH=11的氨水稀释到pH=10,则NH3·H2O的电离平衡向_______方向移动,所得氨水的物质的量浓度 (填大于、小于或等于)原溶液浓度的1/10。
电离
小于
稀释倍数 10倍
大于
2)碱的稀释:
1)、强酸与强酸混合
在25℃时,pH=1的盐酸溶液与pH=4的盐酸溶液等体积混合,混合后溶液的pH等于多少?
关键:1、抓住氢离子进行计算!2、当相加、减的两个量相差100倍以上时,小的可忽略
pH= -lgc(H+)混 = 2-lg5 =1.3
3.溶液的混合
c
(H
+
)
混
=
c
(
H
+
)
1
V
1
+
c
(
H
+
)
2
V
2
V
1
+
V
2
c(H+)混 =
(V×10-1+V×10-4)
(V+V)
=5×10-2
10-1
2
=
pH=14- pOH
=9.7
=10 - lg2
= 9.7
=-lg(2×10-10 )
pH=-lgKW/c(OH-)
法一:
=5-lg5
=4.3
pOH=-lgc(OH-)
=-lg(5×10-5)
法二:
关键:抓住OH- 进行计算!再转化为H+
2)、强碱与强碱混合
在25℃时,将pH=8的氢氧化钠溶液与pH=10的氢氧化钠溶液等体积混合后溶液的pH等于多少?
c
(OH
-
)
混
=
c
(
OH
-
)
1
V
1
+
V
1
+
V
2
c
(
OH
-
)
2
V
2
c(OH-)混=
( V×10-6 +V×10-4)
(V+V)
= 5×10-5 mol/L
3)、强酸与强碱混合—— 一般中和
在25℃时,pH=2的盐酸与pH=13的NaOH溶液按体积比9:1混合后,溶液的pH等于多少?
在25℃时,0.6mol/L的盐酸与0.4mol/L的NaOH溶液等体积混合后,溶液的pH等于多少?
酸过量
c(H+)混=
0.6V-0.4V
V+V
=0.1(mol/L)
pH=1
碱过量
pH=11
c
(
H
+
)
混
=
c
(
H
+
)
酸
V
酸
-
c
(
OH
-
)
碱
V
碱
V
酸
+
V
碱
c
(
OH
-
)
混
=
c
(
H
+
)
酸
V
酸
-
c
(
OH
-
)
碱
V
碱
V
酸
+
V
碱
1.把pH=2的HCl溶液V1 和 pH=12 的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _________;
2.把pH=2的HCl溶液V1 和 pH=11的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _________;
3.把pH=2的HCl溶液V1 和 pH=13 的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _________;
强酸(pHa)与强碱(pHb)混合呈中性 , 体积比与pH之和(X)关系
pHa+pHb=14 ,两溶液中c(H+)=c(OH-),Va: Vb=1;
pHa+pHb<14 ,两溶液中 c(H+)> c(OH-), Va: Vb=1: 10 14-X < 1;
pHa+pHb>14,两溶液中c(H+) <c(OH-) , Va: Vb=10X-14: 1>1。
1:1
1:10
10:1
强酸与强碱恰好完全反应溶液呈中性,pH=7
c
(
H
+
)
酸
V
酸
=
c
(
OH
-
)
碱
V
碱
1、将pH=2的H2SO4溶液和pH=10的NaOH溶液相混合,混和后溶液pH=7,H2SO4溶液和NaOH溶液的体积比为
A.1∶10 B.1∶20 C.1∶9 D.1∶100
2、25℃时,将某强酸和某强碱溶液按10∶1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是
A.12 B.13 C.14 D.15
【课 堂 练 习】
√
√
2、中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 :
A、V1>V2>V3 B、V1C、V14)、有“弱”的参加的中和反应
(注意弱电解质的电离平衡)
1、pH=1 的醋酸与pH=13 的NaOH等体积混合能否恰好反应?
D
醋酸过量,使得溶液呈酸性
溶液的pH c(H+)
0 100
1 10—1
2 10—2
3 10—3
4 10—4
5 10—5
6 10—6
7 10—7
8 10—8
9 10—9
10 10—10
11 10—11
12 10—12
13 10—13
14 10—14
酸性增强
碱性增强
pH>7 pH越大碱性越强。
当c(H+) >1mol/L或小于10-14 { c(OH-) >1mol/L}时,使用pH更不方便。所以用物质的量浓度表示更好。
pH一般表示1mol/L以下c(H+)的浓度。
pH<7 pH越小酸性越强,
教材P47土壤pH和土壤有效养分含量的关系(色带宽窄表示有效养分的含量)
三、pH的应用
P48教材
1.概念和原理。
概念:利用中和反应,用已知浓度的酸(或碱)测定未知浓度的碱(或酸)的实验方法叫做酸碱中和滴定。
实质: n(H+) = n(OH-)
原理:
c(H+) · V酸=c(OH-) · V碱
(适用于强酸与强碱中和反应)
四、酸碱中和滴定
注意多元酸或碱的处理!(根据化学方程式计算。)
P43滴定管的使用
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
错
错
错
排气泡
酸碱中和滴定指示剂的选择要求:
(常用酚酞或甲基橙):
1、酸碱恰好反应时溶液的pH落在指示剂变色的pH范围之内。
(变色点即滴定终点:指示剂恰好变色的溶液的pH)
2、指示剂颜色变化要明显。
指示剂的选择和滴定终点的判断
强酸滴定强碱
甲基橙 黄→橙
酚酞 红→无色
强碱滴定强酸
甲基橙 红→橙
酚酞 无色→粉红
强酸滴定弱碱 甲基橙 黄→橙
强碱滴定弱酸 酚酞 无色→粉红
25℃在20.00mL 0.1000mol/L的盐酸中,逐滴滴入0.1000mol/L NaOH溶液20.00mL。
⑴判断下列情况下溶液的pH。
①滴加NaOH溶液到完全反应相差一滴(一滴溶液的体积是0.04mL),这时溶液的pH;
②完全反应后再多加一滴NaOH溶液时的pH;
(pH=4)
(pH=10)
酸碱中和滴定选用酚酞或甲基橙作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?
(2)跟完全反应所需 NaOH(20.00mL)溶液少加一滴,计算盐酸的物质的量浓度是多少?
c(HCl)=
=
= 0.0998mol/L
跟实际浓度0.1000mol/L相比,误差很小。
VNaOH mL 0.00
10.00
15.00
18.00
19.00 19.96 20.00
20.04
21.00 22.00
30.00
pH
练习:用 0.1000mol/L NaOH 溶液滴定 20.00mL 0.1000mol/L HCl溶液过程中的pH变化,并在以下坐标系中画出变化曲线
V(NaOH)/mL
pH
2
4
6
8
10
12
0
10 20 30 40
1 1.48 1.85 2.29 2.59 4 7
10 11.39 11.68 12.30
滴定曲线
0.100mol/L NaOH 滴定20.00mL 0.100mol/LHCl过程中的pH变化
0.100mol/LHCl滴定20.00mL 0.100mol/LNaOH过程中的pH变化
几种指示剂的变色范围均在pH突变范围之内
[结论]
⑴在滴定终点前后,溶液的pH发生突跃。
⑵酚酞的变色点落在溶液pH的突跃范围内。
⑶按pH突跃范围内的体积计算,结果是可
以达到足够的准确度。
酸碱中和滴定是一个精确的定量实验。
2.滴定过程
(以标准盐酸滴定NaOH溶液的待测浓度为例)
注意:装液或放液后,需等1-2分钟才能观察液面高度并记录,读数必须准确到0.1mL,并估计到0.01mL 。
1)滴定前准备
a 、检查滴定管:酸式滴定管的活塞是否漏水?碱式滴定管管内有无气泡?(管中装满水2分钟不漏,转动活塞180度再试不漏即可。)
→赶气泡→调液面→记录初始读数。
检漏
b、 水洗滴定管2-3次。
→水洗
c 、用标准液或待测液润洗滴定管2-3次。
→润洗
d 、在滴定管中注入标准液或待测液于0刻度以上2-3cm处。
→注液
e 调节活塞或玻璃球,使滴定管内液面处在0刻度或0刻度以下的某位置。
水洗→装液→滴加指示剂。
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
滴定管:
锥形瓶:
2)滴定
a、从碱式滴定管中放出20.00mLNaOH溶液于锥形瓶中,滴入2滴酚酞。
注意:不宜过多、否则色差不明显导致误差;酚酞也消耗NaOH;锥形瓶中的液体也可用移液管移入;不能用待测液洗涤锥形瓶。
b、将锥形瓶置于酸式滴定管下,小心滴入盐酸溶液、边滴边振荡。左手操作玻璃活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化。(在锥形瓶的下方可衬一张白纸帮助观察)。
3)滴定终点判断
4)数据处理
为保证测定的准确性,重复以上操作2-3次。计算出盐酸的平均浓度。
当滴加到最后一滴盐酸,溶液的颜色由红色突然转为无色,并保持30秒钟不变色时,记下滴定管刻度。读数精确到小数点后两位。
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
=
0.10×22.71
20.00
=0.11(mol/L)
如“创新课堂”P35例2
一次滴定 二次滴定 三次滴定
起点读数 终点读数 用量差
V标HCl
V待NaOH
c待1
c待平均
中和滴定( HCl → NaOH )数据处理表格
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
酸碱中和滴定操作过程(指出错误操作)
为了测定某未知Ba(OH)2溶液中的浓度,用0.1000 mol /L的 HCl 进行中和滴定,首先取 25mL碱式滴定管用水洗涤后,将Ba(OH)2倒入滴定管,读数VB1=10mL,将管内溶液全部放至锥形瓶(即取得15mL溶液)。
换25mL酸式滴定管取0.1000mol/L的 HCl 垂直固定在铁架台上,读数VA1=0.30mL,右手转动活塞,左手振荡锥形瓶先快后慢滴定,眼睛时而注视锥形瓶内溶液颜色变化,溶液颜色变化时,马上停止滴定,读出VA2=18.3,通过c未知V未知= c标准V标准计算出Ba(OH)2溶液中的浓度。
酸碱中和滴定操作过程(指出错误操作)
再用该未知的Ba(OH)2溶液润洗2~3次
将尖嘴内的气泡排出,并将液面调整到0刻度以下
10.00mL
为了测定某未知Ba(OH)2溶液中的浓度,用0.1000mol/L
的HCl去中和滴定,首先取25ml碱式滴定管用水洗涤后,
将Ba(OH)2倒入滴定管,读数VB1=10mL,将管内溶液全部放至锥形瓶(即取得15ml溶液)
>15.00mL
指示剂
酸碱中和滴定操作过程(指出错误操作)
先水洗2~3次,再润洗2~3次
左手
右手
时刻
半分钟后读数
旋转
换25mL酸式滴定管取0.1000mol/L的HCl垂直固定在铁架台上,读数VA1=0.30mL,右手转动活塞,左手振荡锥形瓶先快后慢滴定,眼睛时而注视锥形瓶内溶液颜色变化,溶液颜色变化时,马上停止滴定,读出VA2=18.3,通过
c未知V未知=c标准V标准,计算出Ba(OH)2溶液中的浓度
18.30mL
注意Ba(OH)2是二元碱
重复滴定2~3次
3、误差分析
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
“创新大课堂”P45
俯视图
仰视图
滴定管读数正误对比
正确视线
仰视视线
正确读数
仰视读数
仰视读数偏大
正确视线
俯视视线
正确读数
俯视读数
俯视读数偏小
0
0
先偏大
后偏小
先仰后俯
V=V(后)-V(前),偏小
实际读数
正确读数
先俯后仰
先偏小
后偏大
V=V(后)-V(前),偏大
实际读数
正确读数
读数误差
滴定管有气泡
第二节 水的电离和溶液的酸碱性
第三章
水溶液中的离子平衡
一、水的电离
H2O + H2O H3O+ + OH-
H2O H+ + OH-
简写:
[思考] 水的电离常数表达式如何写?
水是一种极弱的电解质,能微弱的电离。
资料卡片:
室温(25℃)下 1L(55.6mol)水中电离的只有10-7mol ,因此水的浓度可以看做常数,因此 K 电离× c(H2O)是一个新的常数——Kw
平衡常数:K 电离=
c(H+)×c(OH-)
c(H2O)
K 电离× =
c(H+)×c(OH-)
c(H2O)
= Kw
1.水的离子积常数
表达式:
Kw= c(H+) . c(OH-)
KW 叫做水的离子积常数,简称水的离子积。
25℃ 时纯水KW = c(H+) . c(OH-) =1×10-14
2.条件改变对水的电离平衡及Kw的影响
讨论:分析下表中的数据有何规律,并解释之
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.34×10-15
6.81×10-15
1.01×10-14
5.47×10-14
5.50×10-13
讨论:
?
酸碱性
水的电离平衡移动方向
c(H+)
c(OH-)
c(H+) 与c(OH-)
大小关系
Kw变化
加 热
?
?
?
?
?
?
加HCl
?
?
?
?
?
?
加NaOH
?
?
?
?
?
?
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
(2) 温度不变,向纯水中加入酸或碱,能抑制水的电离,使水的电离程度减小,但Kw不变
(1)KW只与温度有关,温度升高, (电离吸热)促进水的电离,KW值增大。
H2O H+ + OH-
【练习】
下列关于水的离子积的叙述中,正确的是( )
A KW随H+和OH-的浓度的变化而变化
B KW与水的电离常数K是同一个物理量
C 水的离子积仅仅是温度的函数,随温度的变化而变化
D KW与水的电离常数K是两个没有任何关系的物理量
C
[思考]含有H+的溶液一定是酸,含OH-的溶液一定是碱吗?任何酸中只含H+吗?任何碱中只含OH-吗?
[结论] 在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
任何水溶液中都存在Kw=c(H+) · c(OH-)
(Kw 25℃ =10-14 )
※ 2)任何溶液(中性、酸碱性溶液)水电离出的 c(H+)水=c(OH-)水
注意:1)在溶液中,Kw中的c(OH-) 、 c(H+)指溶液中各离子总浓度.
(题目不指明温度时,通常认为是25℃ )
判断正误:
1、任何水溶液中都存在水的电离平衡。
2、任何水溶液中(不论酸、碱或中性) 都存在Kw=1×10-14 。
3、某温度下,某液体c(H+)= 10-7mol/L,则该溶液一定是纯水。
4、某水溶液中c(H+) =10-7 mol/L一定是中性溶液。
5、向纯水中加入溶质,水的电离平衡将向逆向移动
√
×
×
×
×
【课 堂 练 习】
①0.01mol/L盐酸溶液中。 c(H+)、 c(OH-)分别为多少?
2.利用Kw的定量计算
c(H+) = 0.01mol/L c(OH-) = KW / c(H+) = 10-12 mol/L
c(OH-) = 0.01mol/L c(H+) = KW / c(OH-) = 10-12 mol/L
② 0.01mol/L NaOH溶液中. c(H+) 、 c(OH-)分别为多少?
1).求溶液中的c(H+)aq或c(OH-) aq
Kw = c(H+) . c(OH-) = 1×10-14
Kw = {c(H+)酸+c(H+)水} . c(OH-)水 = 1×10-14
Kw = c(H+)水 . {c(OH-)碱+c(OH-)水} = 1×10-14
由于c(H+)酸= 1×10-2》 c(H+)水,相差100倍以上,计算时忽
略水电离的H+
由于c(OH-)碱= 1×10-2》 c(OH-)水,相差100倍以上,计算时
忽略水电离的OH-
思考讨论
①0.01mol/L盐酸溶液中。由水电离出的c(H+)水、 c(OH-)水分别是多少?
②0.001mol/L NaOH溶液中。由水电离出的c(H+)水、 c(OH-)水分别是多少?
2).求由水电离出的c(H+)水 或c(OH-)水
任何水溶液中由水电离出来的c(H+)水与 c(OH-)水相等
c(H+)水 = c(OH-)水 = 10-12 mol/L
Kw = {c(H+)酸+c(H+)水} . c(OH-)水 = 1×10-14
Kw = c(H+)水 . {c(OH-)碱+c(OH-)水} = 1×10-14
c(H+)水 = c(OH-)水 = 10-11 mol/L
H2O H+ + OH-
回顾——利用Kw的定量计算的解题思路
1).求溶液中的c(H+)aq 或c(OH-)aq
2).求由水电离出的c(H+)水 或c(OH-)水
酸溶液中H+来自酸和水的电离(当两者相差100倍可以忽略小的),而溶液中OH-来自水的电离{酸溶液中c(OH-)aq =c(OH-)水}。先计算溶液中的c(H+)aq ,然后利用Kw计算c(OH-)aq ,最终根据c(H+)水 =c(OH-)水= c(OH-)aq求解。
回顾——利用Kw的定量计算的解题思路
2).求由水电离出的c(H+)水 或c(OH-)水
碱溶液中OH-来自碱和水的电离(当两者相差100倍可以忽略小的),而溶液中H+来自水的电离{碱溶液中c(H+)aq =c(H+)水},先计算溶液中的c(OH-)aq ,然后利用Kw计算c(H+)aq ,最终根据c(H+)水 =c(OH-)水= c(H+)aq 求解。
(抓主要矛盾:先求浓度大的微粒的浓度)
任何溶液中由水的电离c(H+)水 =c(OH-)水
1、某溶液中由水电离产生的c(H+) = 10-12 mol/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?
2、浓度均为0.1mol/L的下列溶液中由水电离出的c(H+) 水大小关系为:
①盐酸 ②醋酸溶液 ③硫酸溶液 ④氢氧化钠溶液
解:由水电离产生的c(H+)水= c(OH-)水= 10-12 mol/L<10-7
若溶液显碱性
c(H+) aq= c(H+) 水= 10-12 mol/L c(OH-) aq= 10-2 mol/L
若溶液显酸性
c(OH-) aq= c(OH-) 水= 10-12 mol/L c(H+) aq= 10-2 mol/L
② > ① =④ > ③
【课 堂 练 习】
10-14/0.1
10-14/0.1
10-14/0.2
10-14/0.1
>
3、 25℃,A、B、C 三种溶液,
其中A中c(H+) = 10-3mol/L ,
B中c(OH-) = 5×10-7mol/L,
C中c(H+) / c(OH-) = 106,则三种溶液的酸性强弱顺序如何?
4、 25℃,浓度均为0.1mol/L的下列溶液中c(H+)由大到小的排列顺序:
①氨水 ②NaOH ③盐酸 ④醋酸
A > C > B
B中c(H+) = KW / c(OH-) =2 × 10-8mol/L
C中c(H+) = 10-4mol/L
③ > ④ > ① > ②
讨论:25℃、100 ℃溶液的酸碱性跟溶液中H+ 和OH-浓度有什么关系?
c(H+)
mol/L c(OH-)
mol/L c(H+) 与c(OH-)
相对大小 溶液
酸碱性
蒸
馏
水
—
加酸
加碱
加热至100℃
10-7
10-7
c(H+) =c(OH-)
中性
>10-7
<10-7
c(H+) >c(OH-)
酸性
<10-7
>10-7
c(H+) <c(OH-)
碱性
10-6
10-6
c(H+) =c(OH-)
中性
中性溶液
c(H+) = c(OH-)
c(H+) = 1×10—7mol/L
c(OH-) = 1×10—7mol/L
酸性溶液
c(H+) > c(OH-)
c(H+) >1×10—7mol/L
c(OH-) <1×10—7mol/L
碱性溶液
c(H+) < c(OH-)
c(H+) < 1×10—7mol/L
c(OH-) > 1×10—7mol/L
思考:在100 ℃ 时(KW(100℃)=1×10-12) ,纯水中c(H+)为多少?c(H+) >1×10-7mol/L是否说明100 ℃ 时纯水溶液呈酸性?100℃ 时, c(H+) = 1×10-7mol/L溶液呈酸性还是碱性?
注意:溶液酸碱性是由c(H+)与c(OH-) 相对大小决定!
(常温可用 c(H+)与 1×10-7mol/L相对大小来判断)
任何温度
常温
二、溶液的酸碱性与pH
c(H+) = 1×10—6mol/L
不能
碱性
练习:
1)10-5mol/L、0.1mol/L、 0.5mol/L、 1mol/L盐酸溶液的pH分别为多少?
2) 10-5mol/L、0.1mol/L 、1mol/LNaOH溶液的pH为多少?
1、意义:
pH的大小能反映出溶液中c(H+)的高低,
即表示稀溶液酸、碱性的强弱。
2、表示:
用H+物质的量浓度的负对数来表示。
pH=-lgc(H+)
(一)pH概念
∵表示较小的c(H+)=10-12mol/L时,很麻烦但应用广
∴所以引入了一种方便方案:
c(H+) →
10-12mol/L →
12
- lg c(H+)
lgc(H+) →
-12 →
负对数—— p
H+ ——H
识记:lg2=0.3 lg5=0.7
计算碱溶液pH应先算c(OH-) ,再利用KW计算出c(H+)
二、溶液的酸碱性与pH
(5、1、0.3、0)
(9、13、14)
酸性溶液
c(H+) > c(OH-)
c(H+) >1×10—7mol/L
碱性溶液
c(H+) < c(OH-)
c(H+) <1×10—7mol/L
pH =7
pH<7
pH>7
讨论:pH变化与酸碱性变化的关系怎样?
pH越大碱性越强,pH越小酸性越强
中性溶液
c(H+) = c(OH-)
c(H+) = 1×10—7mol/L
常温下
思考:
KW(100℃)=10-12,试求在100 ℃时纯水的pH。
pH=6是否说明100 ℃时纯水成弱酸性?
任意温度下
(二)、溶液的pH与酸碱性强弱的关系
pH有关的正误判断
1、一定条件下 pH越大,溶液的酸性越强。
2、强酸溶液的pH一定小。
3、pH等于6的溶液,一定是一个弱酸体系。
4、pH相同的强酸和弱酸中c(H+)相同。
5、在常温下,pH=0的溶液酸性最强,pH=14的溶液碱性最强。
6、pH有可能等于负值。
7、常温下,由水电离出的c(H+) = 10-12mol/L,则溶液pH定为12。
8、相同体积和pH的盐酸、醋酸、硫酸,溶液中H+的物质的量相等。
×
×
×
√
×
√
×
√
精密pH试纸—0.1 pH计—0.01
酸碱指示剂-粗略测定pH大致范围
pH试纸-粗略测定pH
定性测定
定量测定
(三)pH测定方法
酸碱指示剂法(阅读教材P49)
酸碱指示剂一般是弱的有机酸或弱的有机碱。
以HIn代表石蕊分子
3.1—4.4
5.0—8.0
8.2—10.0
指示剂的变色范围
HIn(红色) H+ +In- (蓝色)
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14
甲基橙 红色 橙色 黄色
石蕊 红色 紫色 蓝色
酚酞 无色 浅红色 红色
(三)pH测定方法
1.定性测定:
讨论: pH试纸的使用
能否直接把pH试纸伸到待测液中?
是否要先湿润pH试纸?一定会产生影响?
能否用pH试纸测出pH=7.1来?
pH试纸测定溶液pH的正确操作:将干燥的pH试纸放在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在pH试纸中部,待试纸上显出颜色后马上跟标准比色卡相对比。
标准比色卡中的数据都是整数,使用pH试纸测试溶液酸碱性时读数是整数。
pH越小,颜色越红,pH越大,颜色越蓝,直至发黑;当pH为7时,呈黄绿色.
否
否,不一定
否
pH试纸法(教材P47) 、pH计法等
2.定量测定:
1. pH=6,滴入三种指示剂,各显示什么颜色?
甲基橙:黄, 石:紫, 酚:无。
4.4 — 5
2. 某溶液使甲基橙显黄色,使石蕊显红色,酚酞无色。求该溶液的 pH值范围。
[练习]
3. 如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
√
1、pH试纸使用操作中正确的是
A.将pH试纸的一端浸入溶液,观察颜色的变化
B.将pH试纸浸入溶液一会儿,再取出跟标准比色卡相比较
C.用洁净的玻璃棒蘸取被测溶液,点在pH试纸上,颜色变化后与比色卡对照
D.先将pH试纸用蒸馏水润湿,再用洁净的玻璃棒蘸取被测溶液,点在pH试纸上,颜色变化后与比色卡对照
C
【课 堂 练 习】
2、某溶液取少量滴在pH试纸上,试纸呈深蓝色,此溶液中不可能大量共存的离子是:
A.PO43- B.HCO3- C.Al3+ D.K+
B C
【课 堂 练 习】
变:某溶液由水电离出来的c(H+)=10-11mol/L,上述离子一定能大量共存的是:
D
(抓主要矛盾——先求浓度大的微粒的浓度)
(四)有关pH 的计算
练:1)、求0.05mol/L的H2SO4溶液的pH。
2)、求0.05mol/L的Ba(OH)2溶液的H+浓度及pH。
c(H+)=0.05×2mol/L
c(OH-)= 0.05×2mol/L
1)、单一溶液pH的计算
(1)酸溶液:pH=-lgc(H+)
(2)碱溶液:c(H+)= pH=-lgc(H+)
或25℃ pH+pOH=14 先求pOH=-lgc(OH-)
pH=-lgc(H+)= -lg0.1= 1
c(H+)= KW/c(OH-) =10-13mol/L
pH=-lgc(H+)= -lg10-13=13
3)、甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A、100 B、1/100 C、3 D、1/3
4)、下列溶液在常温下酸性最强的是( )
A、pH=4的溶液
B、22.4mL(标况)HCl溶于水配成1L溶液
C、c(OH-) =10-12mol/L的溶液
D、c(H+) =10-3mol/L的溶液
pH相差a,c(H+)相差10-a
B
C
5)、pH=0的溶液,下列叙述正确的是 ( )
A、是酸性最强的溶液
B、与0.5mol/LH2SO4溶液中c(H+)相同
C、 c(H+) =0的溶液
D、与1mol/L CH3COOH溶液中c(H+)相同
B
6、0.1mol/L盐酸、硫酸、醋酸pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
pH=1 的盐酸、硫酸、醋酸中c(H+)、物质的量浓度关系如何?
现有pH、体积相等的H2SO4、HCl、醋酸三种酸溶液,投入足量的相同形状、大小的锌粒,开始瞬间反应速率大小关系是_______,充分反应后生成H2体积大小(相同状况)关系是____________________。
相等
醋酸>硫酸=盐酸
pH相等→c(H+)相等;c(弱)>c(一元强)>c(多元强)
即c(HAc) >c(HCl)>c(H2SO4)
1)酸的稀释:
思考: 在25℃时,pH=5的盐酸稀释到原来的10倍,pH等于多少?如果稀释到1000倍后, pH又等于多少呢?
pH=-lgc(H+)
= -lg10-5/10
=-lg10-6
=6
2.溶液的稀释
“无限稀释7为限”
≈7
关键:
1、抓住氢离子进行计算!
2、当酸提供的c(H+)很小时(pH≥6),不能忽略水电离出的c(H+)水
“无限稀释7为限”
1)酸的稀释:
当相加、减的两个量相差100倍以上时,小的可忽略。
思考:将pH=5的醋酸溶液稀释。
① 稀释10倍,求pH(范围)
② 要使醋酸的pH由5 变到 6,加水稀释____10倍(填< 、> 、=)
练:pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示。下列说法正确的是:
A、B两酸溶液的c一定相等
稀释后,A溶液的酸性比B溶液强
a=5时,A是强酸,B是弱酸
若A、B都是弱酸,则5>a>2
a
7
2
1
pH
V/mL
1000
A
B
C、D
pH、V相同的不同酸, 稀释相同的倍数pH弱
(5~6)
>
2) 碱的稀释
在25℃时,pH=9的NaOH溶液稀释到10倍,pH等于多少?
c(OH-)=10-5/10
=10-6
pH=-lgc(H+)
=-lgKW/c(OH-)
=-lg10-8
=8
在25℃时,pH=9的NaOH溶液稀释到1000倍后, pH为多少?
≈7
“无限稀释7为限”
关键:
1、抓住氢氧根离子进行计算!(先求OH-,再转换成H+ )
2、当碱提供的c(OH-)很小时(pH≤8),不能忽略水电离出的c(OH-)水。
pH=11的氨水稀释到pH=10,则NH3·H2O的电离平衡向_______方向移动,所得氨水的物质的量浓度 (填大于、小于或等于)原溶液浓度的1/10。
电离
小于
稀释倍数 10倍
大于
2)碱的稀释:
1)、强酸与强酸混合
在25℃时,pH=1的盐酸溶液与pH=4的盐酸溶液等体积混合,混合后溶液的pH等于多少?
关键:1、抓住氢离子进行计算!2、当相加、减的两个量相差100倍以上时,小的可忽略
pH= -lgc(H+)混 = 2-lg5 =1.3
3.溶液的混合
c
(H
+
)
混
=
c
(
H
+
)
1
V
1
+
c
(
H
+
)
2
V
2
V
1
+
V
2
c(H+)混 =
(V×10-1+V×10-4)
(V+V)
=5×10-2
10-1
2
=
pH=14- pOH
=9.7
=10 - lg2
= 9.7
=-lg(2×10-10 )
pH=-lgKW/c(OH-)
法一:
=5-lg5
=4.3
pOH=-lgc(OH-)
=-lg(5×10-5)
法二:
关键:抓住OH- 进行计算!再转化为H+
2)、强碱与强碱混合
在25℃时,将pH=8的氢氧化钠溶液与pH=10的氢氧化钠溶液等体积混合后溶液的pH等于多少?
c
(OH
-
)
混
=
c
(
OH
-
)
1
V
1
+
V
1
+
V
2
c
(
OH
-
)
2
V
2
c(OH-)混=
( V×10-6 +V×10-4)
(V+V)
= 5×10-5 mol/L
3)、强酸与强碱混合—— 一般中和
在25℃时,pH=2的盐酸与pH=13的NaOH溶液按体积比9:1混合后,溶液的pH等于多少?
在25℃时,0.6mol/L的盐酸与0.4mol/L的NaOH溶液等体积混合后,溶液的pH等于多少?
酸过量
c(H+)混=
0.6V-0.4V
V+V
=0.1(mol/L)
pH=1
碱过量
pH=11
c
(
H
+
)
混
=
c
(
H
+
)
酸
V
酸
-
c
(
OH
-
)
碱
V
碱
V
酸
+
V
碱
c
(
OH
-
)
混
=
c
(
H
+
)
酸
V
酸
-
c
(
OH
-
)
碱
V
碱
V
酸
+
V
碱
1.把pH=2的HCl溶液V1 和 pH=12 的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _________;
2.把pH=2的HCl溶液V1 和 pH=11的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _________;
3.把pH=2的HCl溶液V1 和 pH=13 的NaOH溶液V2混合后,溶液呈中性。则V1:V2= _________;
强酸(pHa)与强碱(pHb)混合呈中性 , 体积比与pH之和(X)关系
pHa+pHb=14 ,两溶液中c(H+)=c(OH-),Va: Vb=1;
pHa+pHb<14 ,两溶液中 c(H+)> c(OH-), Va: Vb=1: 10 14-X < 1;
pHa+pHb>14,两溶液中c(H+) <c(OH-) , Va: Vb=10X-14: 1>1。
1:1
1:10
10:1
强酸与强碱恰好完全反应溶液呈中性,pH=7
c
(
H
+
)
酸
V
酸
=
c
(
OH
-
)
碱
V
碱
1、将pH=2的H2SO4溶液和pH=10的NaOH溶液相混合,混和后溶液pH=7,H2SO4溶液和NaOH溶液的体积比为
A.1∶10 B.1∶20 C.1∶9 D.1∶100
2、25℃时,将某强酸和某强碱溶液按10∶1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是
A.12 B.13 C.14 D.15
【课 堂 练 习】
√
√
2、中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 :
A、V1>V2>V3 B、V1
(注意弱电解质的电离平衡)
1、pH=1 的醋酸与pH=13 的NaOH等体积混合能否恰好反应?
D
醋酸过量,使得溶液呈酸性
溶液的pH c(H+)
0 100
1 10—1
2 10—2
3 10—3
4 10—4
5 10—5
6 10—6
7 10—7
8 10—8
9 10—9
10 10—10
11 10—11
12 10—12
13 10—13
14 10—14
酸性增强
碱性增强
pH>7 pH越大碱性越强。
当c(H+) >1mol/L或小于10-14 { c(OH-) >1mol/L}时,使用pH更不方便。所以用物质的量浓度表示更好。
pH一般表示1mol/L以下c(H+)的浓度。
pH<7 pH越小酸性越强,
教材P47土壤pH和土壤有效养分含量的关系(色带宽窄表示有效养分的含量)
三、pH的应用
P48教材
1.概念和原理。
概念:利用中和反应,用已知浓度的酸(或碱)测定未知浓度的碱(或酸)的实验方法叫做酸碱中和滴定。
实质: n(H+) = n(OH-)
原理:
c(H+) · V酸=c(OH-) · V碱
(适用于强酸与强碱中和反应)
四、酸碱中和滴定
注意多元酸或碱的处理!(根据化学方程式计算。)
P43滴定管的使用
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
错
错
错
排气泡
酸碱中和滴定指示剂的选择要求:
(常用酚酞或甲基橙):
1、酸碱恰好反应时溶液的pH落在指示剂变色的pH范围之内。
(变色点即滴定终点:指示剂恰好变色的溶液的pH)
2、指示剂颜色变化要明显。
指示剂的选择和滴定终点的判断
强酸滴定强碱
甲基橙 黄→橙
酚酞 红→无色
强碱滴定强酸
甲基橙 红→橙
酚酞 无色→粉红
强酸滴定弱碱 甲基橙 黄→橙
强碱滴定弱酸 酚酞 无色→粉红
25℃在20.00mL 0.1000mol/L的盐酸中,逐滴滴入0.1000mol/L NaOH溶液20.00mL。
⑴判断下列情况下溶液的pH。
①滴加NaOH溶液到完全反应相差一滴(一滴溶液的体积是0.04mL),这时溶液的pH;
②完全反应后再多加一滴NaOH溶液时的pH;
(pH=4)
(pH=10)
酸碱中和滴定选用酚酞或甲基橙作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?
(2)跟完全反应所需 NaOH(20.00mL)溶液少加一滴,计算盐酸的物质的量浓度是多少?
c(HCl)=
=
= 0.0998mol/L
跟实际浓度0.1000mol/L相比,误差很小。
VNaOH mL 0.00
10.00
15.00
18.00
19.00 19.96 20.00
20.04
21.00 22.00
30.00
pH
练习:用 0.1000mol/L NaOH 溶液滴定 20.00mL 0.1000mol/L HCl溶液过程中的pH变化,并在以下坐标系中画出变化曲线
V(NaOH)/mL
pH
2
4
6
8
10
12
0
10 20 30 40
1 1.48 1.85 2.29 2.59 4 7
10 11.39 11.68 12.30
滴定曲线
0.100mol/L NaOH 滴定20.00mL 0.100mol/LHCl过程中的pH变化
0.100mol/LHCl滴定20.00mL 0.100mol/LNaOH过程中的pH变化
几种指示剂的变色范围均在pH突变范围之内
[结论]
⑴在滴定终点前后,溶液的pH发生突跃。
⑵酚酞的变色点落在溶液pH的突跃范围内。
⑶按pH突跃范围内的体积计算,结果是可
以达到足够的准确度。
酸碱中和滴定是一个精确的定量实验。
2.滴定过程
(以标准盐酸滴定NaOH溶液的待测浓度为例)
注意:装液或放液后,需等1-2分钟才能观察液面高度并记录,读数必须准确到0.1mL,并估计到0.01mL 。
1)滴定前准备
a 、检查滴定管:酸式滴定管的活塞是否漏水?碱式滴定管管内有无气泡?(管中装满水2分钟不漏,转动活塞180度再试不漏即可。)
→赶气泡→调液面→记录初始读数。
检漏
b、 水洗滴定管2-3次。
→水洗
c 、用标准液或待测液润洗滴定管2-3次。
→润洗
d 、在滴定管中注入标准液或待测液于0刻度以上2-3cm处。
→注液
e 调节活塞或玻璃球,使滴定管内液面处在0刻度或0刻度以下的某位置。
水洗→装液→滴加指示剂。
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
滴定管:
锥形瓶:
2)滴定
a、从碱式滴定管中放出20.00mLNaOH溶液于锥形瓶中,滴入2滴酚酞。
注意:不宜过多、否则色差不明显导致误差;酚酞也消耗NaOH;锥形瓶中的液体也可用移液管移入;不能用待测液洗涤锥形瓶。
b、将锥形瓶置于酸式滴定管下,小心滴入盐酸溶液、边滴边振荡。左手操作玻璃活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化。(在锥形瓶的下方可衬一张白纸帮助观察)。
3)滴定终点判断
4)数据处理
为保证测定的准确性,重复以上操作2-3次。计算出盐酸的平均浓度。
当滴加到最后一滴盐酸,溶液的颜色由红色突然转为无色,并保持30秒钟不变色时,记下滴定管刻度。读数精确到小数点后两位。
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
=
0.10×22.71
20.00
=0.11(mol/L)
如“创新课堂”P35例2
一次滴定 二次滴定 三次滴定
起点读数 终点读数 用量差
V标HCl
V待NaOH
c待1
c待平均
中和滴定( HCl → NaOH )数据处理表格
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
酸碱中和滴定操作过程(指出错误操作)
为了测定某未知Ba(OH)2溶液中的浓度,用0.1000 mol /L的 HCl 进行中和滴定,首先取 25mL碱式滴定管用水洗涤后,将Ba(OH)2倒入滴定管,读数VB1=10mL,将管内溶液全部放至锥形瓶(即取得15mL溶液)。
换25mL酸式滴定管取0.1000mol/L的 HCl 垂直固定在铁架台上,读数VA1=0.30mL,右手转动活塞,左手振荡锥形瓶先快后慢滴定,眼睛时而注视锥形瓶内溶液颜色变化,溶液颜色变化时,马上停止滴定,读出VA2=18.3,通过c未知V未知= c标准V标准计算出Ba(OH)2溶液中的浓度。
酸碱中和滴定操作过程(指出错误操作)
再用该未知的Ba(OH)2溶液润洗2~3次
将尖嘴内的气泡排出,并将液面调整到0刻度以下
10.00mL
为了测定某未知Ba(OH)2溶液中的浓度,用0.1000mol/L
的HCl去中和滴定,首先取25ml碱式滴定管用水洗涤后,
将Ba(OH)2倒入滴定管,读数VB1=10mL,将管内溶液全部放至锥形瓶(即取得15ml溶液)
>15.00mL
指示剂
酸碱中和滴定操作过程(指出错误操作)
先水洗2~3次,再润洗2~3次
左手
右手
时刻
半分钟后读数
旋转
换25mL酸式滴定管取0.1000mol/L的HCl垂直固定在铁架台上,读数VA1=0.30mL,右手转动活塞,左手振荡锥形瓶先快后慢滴定,眼睛时而注视锥形瓶内溶液颜色变化,溶液颜色变化时,马上停止滴定,读出VA2=18.3,通过
c未知V未知=c标准V标准,计算出Ba(OH)2溶液中的浓度
18.30mL
注意Ba(OH)2是二元碱
重复滴定2~3次
3、误差分析
]
[
]
[
)
(
)
(
c
NaOH(aq)
V
HCl(aq)
V
HCl
c
NaOH
·
=
“创新大课堂”P45
俯视图
仰视图
滴定管读数正误对比
正确视线
仰视视线
正确读数
仰视读数
仰视读数偏大
正确视线
俯视视线
正确读数
俯视读数
俯视读数偏小
0
0
先偏大
后偏小
先仰后俯
V=V(后)-V(前),偏小
实际读数
正确读数
先俯后仰
先偏小
后偏大
V=V(后)-V(前),偏大
实际读数
正确读数
读数误差
滴定管有气泡
