沪科版高中化学高一下册-7.2 研究电解质在溶液中的化学反应-电解质和非电解质 课件(共24张PPT)
文档属性
| 名称 | 沪科版高中化学高一下册-7.2 研究电解质在溶液中的化学反应-电解质和非电解质 课件(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 241.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-21 09:11:53 | ||
图片预览








文档简介
(共24张PPT)
电解质和非电解质
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之,则不能言,不过旬日必死”。不久,蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝哑泉水。果然回营后大难临头——军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。此时,幸巧遇见一老叟,其指点蜀军众将士及时饮用万安溪安乐泉水.终于逐渐转危为安,渡过难关.经当代化学工作者实地分析研究,发现哑泉水中含有较多的硫酸铜,人喝了含有铜盐的水就会中毒,引起话说不清,呕吐腹泻,最后虚脱、痉挛而死。那么喝了万安溪安乐泉水又为何转危为安呢?原来该泉水中含有较多的碱(一般味苦)。
1.了解电解质和非电解质概念。
2.掌握电离方程式书写。
3.了解电解质性质。
酸、碱、盐在水溶液中的电离
1.电解质:在______里或____状态下能够____的______叫电解质。
非电解质:在______里和____状态下不能导电的______叫非电解质。
2.电离:电解质在____状态或______中离解成________的过程叫电离。
答案:1.水溶液 熔融 导电 化合物 水溶液 熔融 化合物
2.熔融 水溶液 自由移动离子
酸、碱、盐在水溶液中能电离,产生了自由移动的离子,所以能导电。
3.酸:在水溶液中电离出来的____离子全部是____的化合物叫酸。
酸的电离可用电离方程式表示,如HCl ____________。
答案:阳 H+ H++Cl-
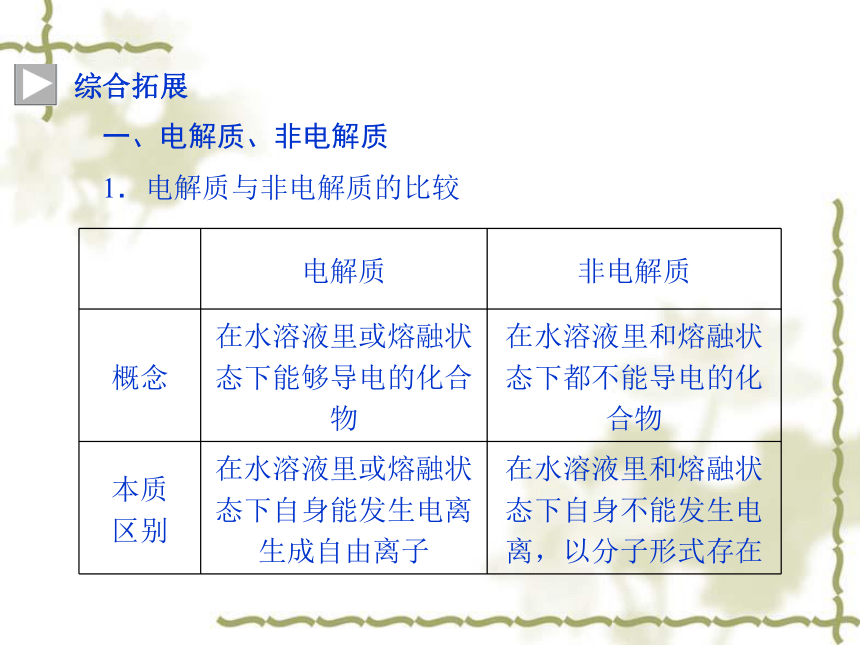
综合拓展
一、电解质、非电解质
1.电解质与非电解质的比较
电解质 非电解质
概念 在水溶液里或熔融状态下能够导电的化合物 在水溶液里和熔融状态下都不能导电的化合物
本质
区别 在水溶液里或熔融状态下自身能发生电离生成自由离子 在水溶液里和熔融状态下自身不能发生电离,以分子形式存在
电解质 非电解质
所含物质类型
酸:HCl、H2SO4、HNO3、
H2CO3、H2SO3、
CH3COOH
碱:NaOH、Ba(OH)2、KOH、
NH3·H2O、Fe(OH)3
盐:NaCl、CaCO3、NaHSO4
金属氧化物:Na2O、CaO、
Al2O3
非金属氧化物:H2O 非金属氧化物:
SO2、SO3、CO2、CO、P2O5
非酸性气态氢化物:NH3
大部分有机物:蔗糖、酒精 、 CH4
2.电解质和非电解质的判断依据
(1)电解质与非电解质的基本前提是化合物。
(2)具备下列两个条件中的至少一个即为电解质:
①在水溶液里能导电;②在熔融状态下能导电。
二、电解质与导电性的关系
1.电解质导电是有条件的,在水溶液里或熔融状态时才能导电。
(1)强碱和盐等离子化合物在固态时,晶体内虽然存在阴阳离子,但不能自由移动,所以不能够导电;在熔融状态或水溶液里能电离出自由移动的离子,故能导电。
(2)酸在固态或液态(熔融状态)时只有分子,没有自由移动的离子,因而也不导电,如液态HCl、H2SO4、H3PO4等不能导电,在水溶液里受水分子的作用,电离产生自由移动的离子,故能够导电。
2.不能导电的物质不一定是非电解质,能导电的物质不一定是电解质。
电解质、非电解质均指化合物,氯单质不能导电,铜、石墨等单质能导电,NaCl溶液能导电,但它们都不是化合物,所以既不是电解质,也不是非电解质。
3.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。
尝试应用
1.下列状态的物质,即能导电又属于电解质的是( )
A.MgCl2晶体 B.NaCl溶液
C.液态氯化氢 D.熔融的KOH
解析:MgCl2晶体是电解质但无自由移动的离子,不导电;NaCl溶液是混合物,称电解质溶液;HCl是共价化合物,液态时不导电。
答案:D
2.写出下列物质在溶液中的电离方程式
(1)HCl:_____________________________________;
(2)H2SO4:___________________________________;
(3)NaOH:___________________________________;
(4)Ba(OH)2:_________________________________;
(5)NaHSO4:_________________________________;
(6)NaHCO3:________________________________。
答案:(1)HCl H++Cl-
(2)H2SO4 2H++
(3)NaOH Na++OH-
(4)Ba(OH)2 Ba2++2OH-
(5)NaHSO4 Na++H++
(6)NaHCO3 Na++ ,( ??H++ )
一、电解质与非电解质的判断
下列物质中,能导电的是________,属于电解质的是________,属于非电解质的是________。
①Cu ②H2SO4 ③NaCl溶液 ④NaOH ⑤BaSO4 ⑥蔗糖 ⑦石墨 ⑧熔融KCl
解析:Cu、石墨单质中由于存在自由移动的电子,固体能导电,本身既不属于电解质,也不属于非电解质;H2SO4、NaOH、BaSO4、熔融KCl为电解质。
答案:①③⑦⑧ ②④⑤⑧ ⑥
名师点睛:电解质、非电解质的判断中常见错误有:
(1)把单质、混合物看作电解质或非电解质。
(2)把部分在水溶液中导电能力弱的物质如BaSO4等看作非电解质或弱电解质。
变式应用
1.(2011年黔西南高二检测)下列物质中:
属于电解质的是(填序号,下同)_____________,
属于非电解质的是________,
既不属于电解质也不属于非电解质的是________。
①醋酸(CH3COOH) ②苛性钠
③氨水 ④铁
⑤蔗糖 ⑥H2SO4
⑦水 ⑧CaCO3
⑨二氧化碳
①②⑥⑦⑧
⑤⑨
③④
二、溶液的导电性
把0.05 mol NaOH固体加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1NaOH溶液
D.0.5 mol·L-1KCl溶液
解析:自来水中离子浓度很小,当加入NaOH固体后,溶液中离子的浓度明显增加,溶液导电能力明显增强;含0.1 L×0.5 mol·L-1=0.05 mol HCl的盐酸中,当加入0.05 mol NaOH固体,反应后生成0.05 mol NaCl和H2O,溶液中的离子浓度基本不变;而在NaOH、KCl溶液中加入NaOH固体后,都会使100 mL溶液中离子的物质的量增加,浓度增大,导电性增强。
答案:B
名师点睛:溶液的导电能力变化最小,意味着溶液中自由移动离子的浓度基本保持不变。电解质溶液的导电能力,取决于在相同条件下单位体积内自由移动的离子的数目及其所带电荷的多少,一个硫酸根离子的导电性相当于两个氯离子的导电性。
变式应用
2.下列物质的水溶液导电性最强的是( )
A.0.50 mol·L-1H2SO4溶液
B.0.50 mol·L-1KNO3溶液
C.0.50 mol·L-1酒精溶液
D.0.50 mol·L-1NaOH溶液
解析:酸、碱、盐等电解质在水溶液中的电离过程可用电离方程式表示:H2SO4 2H++ ,NaOH Na++OH-,KNO3 K++ 。酒精属于非电解质,不导电;硫酸、硝酸钾、氢氧化钠属于电解质,水溶液导电,但是相同物质的量浓度的三种溶液,离子的浓度不同,硫酸溶液中的离子浓度最大,导电性最强。
答案:A
水平测试
1.下列物质的水溶液能够导电,但属于非电解质的是( )
A.NaOH B.SO2
C.蔗糖 D.Al
解析:电解质和非电解质指的都是化合物,因此可以排除D选项。A项中NaOH是电解质;B项中的SO2水溶液可以导电,但导电的不是其本身,是与水生成的H2SO3发生电离而导电,所以SO2是非电解质;C项中蔗糖溶液不导电。
答案:B
能力提升
7.今有一种固体化合物X,X本身不导电,但熔融状态或溶于水时能够电离,下列关于该化合物X的说法中,正确的是( )
A.X一定是电解质
B.X可能为非电解质
C.X只能是盐类
D.X可以是任何化合物
解析:既然在熔融状态或溶于水时能够电离,就一定为电解质。符合题意的物质较多,如NaCl、NaOH等,可能为盐,也可能是碱,应选A。
答案:A
电解质和非电解质
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之,则不能言,不过旬日必死”。不久,蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝哑泉水。果然回营后大难临头——军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。此时,幸巧遇见一老叟,其指点蜀军众将士及时饮用万安溪安乐泉水.终于逐渐转危为安,渡过难关.经当代化学工作者实地分析研究,发现哑泉水中含有较多的硫酸铜,人喝了含有铜盐的水就会中毒,引起话说不清,呕吐腹泻,最后虚脱、痉挛而死。那么喝了万安溪安乐泉水又为何转危为安呢?原来该泉水中含有较多的碱(一般味苦)。
1.了解电解质和非电解质概念。
2.掌握电离方程式书写。
3.了解电解质性质。
酸、碱、盐在水溶液中的电离
1.电解质:在______里或____状态下能够____的______叫电解质。
非电解质:在______里和____状态下不能导电的______叫非电解质。
2.电离:电解质在____状态或______中离解成________的过程叫电离。
答案:1.水溶液 熔融 导电 化合物 水溶液 熔融 化合物
2.熔融 水溶液 自由移动离子
酸、碱、盐在水溶液中能电离,产生了自由移动的离子,所以能导电。
3.酸:在水溶液中电离出来的____离子全部是____的化合物叫酸。
酸的电离可用电离方程式表示,如HCl ____________。
答案:阳 H+ H++Cl-
综合拓展
一、电解质、非电解质
1.电解质与非电解质的比较
电解质 非电解质
概念 在水溶液里或熔融状态下能够导电的化合物 在水溶液里和熔融状态下都不能导电的化合物
本质
区别 在水溶液里或熔融状态下自身能发生电离生成自由离子 在水溶液里和熔融状态下自身不能发生电离,以分子形式存在
电解质 非电解质
所含物质类型
酸:HCl、H2SO4、HNO3、
H2CO3、H2SO3、
CH3COOH
碱:NaOH、Ba(OH)2、KOH、
NH3·H2O、Fe(OH)3
盐:NaCl、CaCO3、NaHSO4
金属氧化物:Na2O、CaO、
Al2O3
非金属氧化物:H2O 非金属氧化物:
SO2、SO3、CO2、CO、P2O5
非酸性气态氢化物:NH3
大部分有机物:蔗糖、酒精 、 CH4
2.电解质和非电解质的判断依据
(1)电解质与非电解质的基本前提是化合物。
(2)具备下列两个条件中的至少一个即为电解质:
①在水溶液里能导电;②在熔融状态下能导电。
二、电解质与导电性的关系
1.电解质导电是有条件的,在水溶液里或熔融状态时才能导电。
(1)强碱和盐等离子化合物在固态时,晶体内虽然存在阴阳离子,但不能自由移动,所以不能够导电;在熔融状态或水溶液里能电离出自由移动的离子,故能导电。
(2)酸在固态或液态(熔融状态)时只有分子,没有自由移动的离子,因而也不导电,如液态HCl、H2SO4、H3PO4等不能导电,在水溶液里受水分子的作用,电离产生自由移动的离子,故能够导电。
2.不能导电的物质不一定是非电解质,能导电的物质不一定是电解质。
电解质、非电解质均指化合物,氯单质不能导电,铜、石墨等单质能导电,NaCl溶液能导电,但它们都不是化合物,所以既不是电解质,也不是非电解质。
3.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。
尝试应用
1.下列状态的物质,即能导电又属于电解质的是( )
A.MgCl2晶体 B.NaCl溶液
C.液态氯化氢 D.熔融的KOH
解析:MgCl2晶体是电解质但无自由移动的离子,不导电;NaCl溶液是混合物,称电解质溶液;HCl是共价化合物,液态时不导电。
答案:D
2.写出下列物质在溶液中的电离方程式
(1)HCl:_____________________________________;
(2)H2SO4:___________________________________;
(3)NaOH:___________________________________;
(4)Ba(OH)2:_________________________________;
(5)NaHSO4:_________________________________;
(6)NaHCO3:________________________________。
答案:(1)HCl H++Cl-
(2)H2SO4 2H++
(3)NaOH Na++OH-
(4)Ba(OH)2 Ba2++2OH-
(5)NaHSO4 Na++H++
(6)NaHCO3 Na++ ,( ??H++ )
一、电解质与非电解质的判断
下列物质中,能导电的是________,属于电解质的是________,属于非电解质的是________。
①Cu ②H2SO4 ③NaCl溶液 ④NaOH ⑤BaSO4 ⑥蔗糖 ⑦石墨 ⑧熔融KCl
解析:Cu、石墨单质中由于存在自由移动的电子,固体能导电,本身既不属于电解质,也不属于非电解质;H2SO4、NaOH、BaSO4、熔融KCl为电解质。
答案:①③⑦⑧ ②④⑤⑧ ⑥
名师点睛:电解质、非电解质的判断中常见错误有:
(1)把单质、混合物看作电解质或非电解质。
(2)把部分在水溶液中导电能力弱的物质如BaSO4等看作非电解质或弱电解质。
变式应用
1.(2011年黔西南高二检测)下列物质中:
属于电解质的是(填序号,下同)_____________,
属于非电解质的是________,
既不属于电解质也不属于非电解质的是________。
①醋酸(CH3COOH) ②苛性钠
③氨水 ④铁
⑤蔗糖 ⑥H2SO4
⑦水 ⑧CaCO3
⑨二氧化碳
①②⑥⑦⑧
⑤⑨
③④
二、溶液的导电性
把0.05 mol NaOH固体加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1NaOH溶液
D.0.5 mol·L-1KCl溶液
解析:自来水中离子浓度很小,当加入NaOH固体后,溶液中离子的浓度明显增加,溶液导电能力明显增强;含0.1 L×0.5 mol·L-1=0.05 mol HCl的盐酸中,当加入0.05 mol NaOH固体,反应后生成0.05 mol NaCl和H2O,溶液中的离子浓度基本不变;而在NaOH、KCl溶液中加入NaOH固体后,都会使100 mL溶液中离子的物质的量增加,浓度增大,导电性增强。
答案:B
名师点睛:溶液的导电能力变化最小,意味着溶液中自由移动离子的浓度基本保持不变。电解质溶液的导电能力,取决于在相同条件下单位体积内自由移动的离子的数目及其所带电荷的多少,一个硫酸根离子的导电性相当于两个氯离子的导电性。
变式应用
2.下列物质的水溶液导电性最强的是( )
A.0.50 mol·L-1H2SO4溶液
B.0.50 mol·L-1KNO3溶液
C.0.50 mol·L-1酒精溶液
D.0.50 mol·L-1NaOH溶液
解析:酸、碱、盐等电解质在水溶液中的电离过程可用电离方程式表示:H2SO4 2H++ ,NaOH Na++OH-,KNO3 K++ 。酒精属于非电解质,不导电;硫酸、硝酸钾、氢氧化钠属于电解质,水溶液导电,但是相同物质的量浓度的三种溶液,离子的浓度不同,硫酸溶液中的离子浓度最大,导电性最强。
答案:A
水平测试
1.下列物质的水溶液能够导电,但属于非电解质的是( )
A.NaOH B.SO2
C.蔗糖 D.Al
解析:电解质和非电解质指的都是化合物,因此可以排除D选项。A项中NaOH是电解质;B项中的SO2水溶液可以导电,但导电的不是其本身,是与水生成的H2SO3发生电离而导电,所以SO2是非电解质;C项中蔗糖溶液不导电。
答案:B
能力提升
7.今有一种固体化合物X,X本身不导电,但熔融状态或溶于水时能够电离,下列关于该化合物X的说法中,正确的是( )
A.X一定是电解质
B.X可能为非电解质
C.X只能是盐类
D.X可以是任何化合物
解析:既然在熔融状态或溶于水时能够电离,就一定为电解质。符合题意的物质较多,如NaCl、NaOH等,可能为盐,也可能是碱,应选A。
答案:A
