京改版(2013)初中化学九年级下册第9章《溶液》检测题(含答案)
文档属性
| 名称 | 京改版(2013)初中化学九年级下册第9章《溶液》检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 100.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-21 21:42:16 | ||
图片预览


文档简介
《溶液》检测题
一、单选题
1.地球深处的水处于超临界状态,称为超临界水。如图为某压强下CaCl2和? NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确是( )
A.在超临界水中,NaCl的溶解度大于 CaCl2?的溶解度
B.在超临界水中,2种物质的溶解度都随温度升高而增大
C.450℃时可得到?CaCl2?的超临界水溶液
D.450℃时,可得到0.04%的?CaCl2的超临界水溶液
2.下列关于溶液的说法不正确的是
A.可以用肥皂水区分硬水和软水 B.饱和溶液一定比不饱和溶液浓
C.氢氧化钠固体溶于水会放出热量 D.溶液一定是混合物
3.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.操作I一定是降温 B.操作I一定是加溶质
C.①与③的溶质质量一定相等 D.②与③的溶质质量分数一定相等
4.甲烷和乙醇的燃烧产物都是二氧化碳和水,以下说法正确的是( )
A.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的化合物
B.洗涤剂除去衣服上的油污是利用了乳化作用,则汽油除去衣服上的油污也是利用了乳化作用
C.碱的溶液能使无色酚酞试液变红,所以能使无色酚酞试液变红的一定是碱的溶液
D.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
5.把少量下列物质分别放在水中,充分搅拌,不能得到溶液的是( )。
A.植物油 B.碳酸钠 C.氢氧化钠 D.蔗糖
6.下列说法正确的是
A.均一稳定的液体是溶液
B.洗涤剂可洗去餐具上的油污是因为洗涤剂可以溶解油污
C.100g10%食盐水和100g10%食盐水混合,可得200g20%食盐水
D.5%的食盐水温度升高(水不蒸发),溶液的溶质质量分数仍为5%
7.温度升高时溶解度反而减小的是( )
A.氯化钠 B.硝酸钾 C.蔗糖 D.二氧化碳
8.下列有关溶液的说法中正确的是( )
A.均一、稳定的液体都是溶液
B.溶液中只能有一种溶质
C.氢氧化钠溶于水时温度会降低
D.餐具上的油污可利用洗涤剂的乳化功能将其洗去
9.把少量物质分别加入到另一物质中,充分搅拌,可以得到溶液的是( )
A.面粉加入水中 B.碘加入汽油中
C.高锰酸钾加入汽油中 D.植物油加入水中
10.将下列物质加入水中会放出热量的是( )
A.氯化钠 B.硝酸钾 C.氢氧化钠 D.硝酸铵
11.要使50°C的接近饱和的硝酸钾溶液变为饱和溶液,下列措施错误的是( )。
A.加入少量硝酸钾晶体 B.恒温蒸发掉部分水
C.降低溶液温度至室温 D.倒出少量的溶液
12.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度( )
A.大于30℃ B.小于30℃ C.等于30℃ D.无法确定
13.下列涉及学科观点的有关说法正确的是
A.微粒观:氯化钠是由钠原子和氯原子构成的
B.转化观:氧气和二氧化碳在一定条件下可以相互转化
C.结构观:氦原子和镁原子最外层电子数相同,所以它们的化学性质相似
D.守恒观:10mL质量分数20%的稀硫酸加10mL水稀释后,溶质的质量分数变为10%
二、实验题
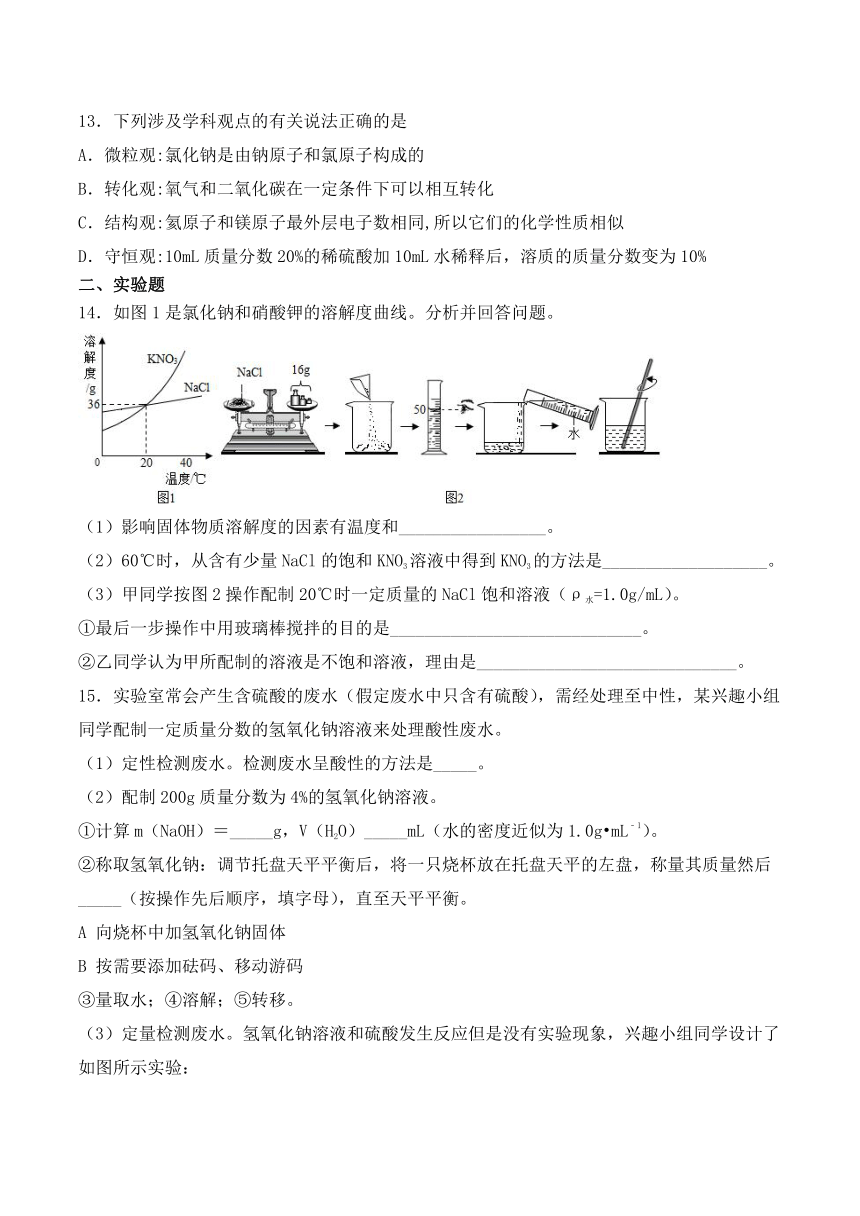
14.如图1是氯化钠和硝酸钾的溶解度曲线。分析并回答问题。
(1)影响固体物质溶解度的因素有温度和_________________。
(2)60℃时,从含有少量NaCl的饱和KNO3溶液中得到KNO3的方法是___________________。
(3)甲同学按图2操作配制20℃时一定质量的NaCl饱和溶液(ρ水=1.0g/mL)。
①最后一步操作中用玻璃棒搅拌的目的是_____________________________。
②乙同学认为甲所配制的溶液是不饱和溶液,理由是______________________________。
15.实验室常会产生含硫酸的废水(假定废水中只含有硫酸),需经处理至中性,某兴趣小组同学配制一定质量分数的氢氧化钠溶液来处理酸性废水。
(1)定性检测废水。检测废水呈酸性的方法是_____。
(2)配制200g质量分数为4%的氢氧化钠溶液。
①计算m(NaOH)=_____g,V(H2O)_____mL(水的密度近似为1.0g?mL﹣1)。
②称取氢氧化钠:调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量然后_____(按操作先后顺序,填字母),直至天平平衡。
A 向烧杯中加氢氧化钠固体
B 按需要添加砝码、移动游码
③量取水;④溶解;⑤转移。
(3)定量检测废水。氢氧化钠溶液和硫酸发生反应但是没有实验现象,兴趣小组同学设计了如图所示实验:
在锥形瓶中加入10g上述(2)中配制的氢氧化钠溶液,滴入几滴酚酞溶液,用滴定管(滴定管为一细长的管状容器,一端具有活栓开关,其上具有刻度指示量度)慢慢滴入废水,并不断振荡,至溶液颜色恰好变为无色为止。请回答:
①酚酞溶液的作用是_____。
②边滴加废水,边不断振荡的目的是_____。
③当滴定管中废水读数为20mL时,锥形瓶溶液中一定存在的阳离子有_____(填离子符号)。
④当b中溶液颜色恰好变为无色时,共用去了废水10mL,则兴趣小组想算出酸性废水中硫酸的质量分数,除了要用到已有数据外,你认为还需要的数据是_____。
(4)兴趣小组同学在滴加废水一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,它的可能原因是_____。请用化学方程式表示其变质的原因_____;若要除去溶液中变质生成的杂质,请简要写出你的实验方案:_____。
三、推断题
16.甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙丙+丁。
(1)若甲、丙为化合物,乙、丁为单质,写出一个符合该反应要求的化学方程式____。
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则甲的化学式为_____,反应发生时能观察到的实验现象是 _________________________。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应 ______(“一定”或“不一定”)是中和反应,理由是______________________。
17.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
四、计算题
18.某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g,放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)样品中Na2CO3的质量分数;
(3)反应后所得溶液中溶质的质量分数。
19.某化学兴趣小组同学们与老师一起探究铝的化学性质时发现, 铝还能与氢氧化钠溶液反应,其反应的化学方程式为:2A1+ 2NaOH+ 2H2O=2NaAlO2 +3H2↑。现取某氢氧化钠溶液样品50g例入烧杯中,再向其中放入足量打磨好的铝片,生成气体质量与加入铝片质量的变化关系如图所示。
试回答下列问题:
(1)反应完成后生成氢气的质量为__________g。
(2)求原氢氧化钠溶液中氢氧化钠的质量分数为_______。(请写出计算过程)
20.现有200g10%的氯化钾溶液,分为两等份。
(1)每分溶液的溶质质量分数______,这体现了溶液的______。
(2)将其中一份溶液溶质的质量分数增大到20%,应向此溶液中加入_____氯化钾(假设所甲氯化钾全部溶解)。
参考答案
1.C 2.B 3.D 4.D 5.A 6.D 7.D 8.D 9.B 10.C 11.D 12.A 13.B
14.溶质与溶剂的性质 降温结晶 加快NaCl的溶解 由溶解度曲线可知,20℃时,50g水中最多溶解NaCl的质量为18g,而甲在50g水中加入了16g NaCl
15.取少量溶液于试管中,滴加石蕊试液,石蕊试液变红色,说明溶液显酸性 8 192 B、A 判断是否恰好完全反应 使反应物充分反应 Na+ 废水密度 氢氧化钠和二氧化碳反应生成了碳酸钠和水 2NaOH+CO2═Na2CO3+H2O 向废水中加入氢氧化钙溶液,直至不产生沉淀时为止,过滤
16.Fe+ 2HCl = FeCl2 + H2↑(合理即可) CuCl2(可溶性铜盐即可) 有蓝色沉淀生成 不一定 某些金属氧化物与酸反应也能生成盐和水(或某些非金属氧化物与碱反应也能生成盐和水)
17.Fe + H2SO4 = Fe SO4 + H2↑ 过滤 CO2 7 : 9 1290
18.(1)2.2 g;
(2)88.3%;
(3)13.1%。
19.0.6 16%
20.10% 均一性 12.5g
一、单选题
1.地球深处的水处于超临界状态,称为超临界水。如图为某压强下CaCl2和? NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确是( )
A.在超临界水中,NaCl的溶解度大于 CaCl2?的溶解度
B.在超临界水中,2种物质的溶解度都随温度升高而增大
C.450℃时可得到?CaCl2?的超临界水溶液
D.450℃时,可得到0.04%的?CaCl2的超临界水溶液
2.下列关于溶液的说法不正确的是
A.可以用肥皂水区分硬水和软水 B.饱和溶液一定比不饱和溶液浓
C.氢氧化钠固体溶于水会放出热量 D.溶液一定是混合物
3.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.操作I一定是降温 B.操作I一定是加溶质
C.①与③的溶质质量一定相等 D.②与③的溶质质量分数一定相等
4.甲烷和乙醇的燃烧产物都是二氧化碳和水,以下说法正确的是( )
A.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的化合物
B.洗涤剂除去衣服上的油污是利用了乳化作用,则汽油除去衣服上的油污也是利用了乳化作用
C.碱的溶液能使无色酚酞试液变红,所以能使无色酚酞试液变红的一定是碱的溶液
D.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
5.把少量下列物质分别放在水中,充分搅拌,不能得到溶液的是( )。
A.植物油 B.碳酸钠 C.氢氧化钠 D.蔗糖
6.下列说法正确的是
A.均一稳定的液体是溶液
B.洗涤剂可洗去餐具上的油污是因为洗涤剂可以溶解油污
C.100g10%食盐水和100g10%食盐水混合,可得200g20%食盐水
D.5%的食盐水温度升高(水不蒸发),溶液的溶质质量分数仍为5%
7.温度升高时溶解度反而减小的是( )
A.氯化钠 B.硝酸钾 C.蔗糖 D.二氧化碳
8.下列有关溶液的说法中正确的是( )
A.均一、稳定的液体都是溶液
B.溶液中只能有一种溶质
C.氢氧化钠溶于水时温度会降低
D.餐具上的油污可利用洗涤剂的乳化功能将其洗去
9.把少量物质分别加入到另一物质中,充分搅拌,可以得到溶液的是( )
A.面粉加入水中 B.碘加入汽油中
C.高锰酸钾加入汽油中 D.植物油加入水中
10.将下列物质加入水中会放出热量的是( )
A.氯化钠 B.硝酸钾 C.氢氧化钠 D.硝酸铵
11.要使50°C的接近饱和的硝酸钾溶液变为饱和溶液,下列措施错误的是( )。
A.加入少量硝酸钾晶体 B.恒温蒸发掉部分水
C.降低溶液温度至室温 D.倒出少量的溶液
12.不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为30℃,则t2对应的温度( )
A.大于30℃ B.小于30℃ C.等于30℃ D.无法确定
13.下列涉及学科观点的有关说法正确的是
A.微粒观:氯化钠是由钠原子和氯原子构成的
B.转化观:氧气和二氧化碳在一定条件下可以相互转化
C.结构观:氦原子和镁原子最外层电子数相同,所以它们的化学性质相似
D.守恒观:10mL质量分数20%的稀硫酸加10mL水稀释后,溶质的质量分数变为10%
二、实验题
14.如图1是氯化钠和硝酸钾的溶解度曲线。分析并回答问题。
(1)影响固体物质溶解度的因素有温度和_________________。
(2)60℃时,从含有少量NaCl的饱和KNO3溶液中得到KNO3的方法是___________________。
(3)甲同学按图2操作配制20℃时一定质量的NaCl饱和溶液(ρ水=1.0g/mL)。
①最后一步操作中用玻璃棒搅拌的目的是_____________________________。
②乙同学认为甲所配制的溶液是不饱和溶液,理由是______________________________。
15.实验室常会产生含硫酸的废水(假定废水中只含有硫酸),需经处理至中性,某兴趣小组同学配制一定质量分数的氢氧化钠溶液来处理酸性废水。
(1)定性检测废水。检测废水呈酸性的方法是_____。
(2)配制200g质量分数为4%的氢氧化钠溶液。
①计算m(NaOH)=_____g,V(H2O)_____mL(水的密度近似为1.0g?mL﹣1)。
②称取氢氧化钠:调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量然后_____(按操作先后顺序,填字母),直至天平平衡。
A 向烧杯中加氢氧化钠固体
B 按需要添加砝码、移动游码
③量取水;④溶解;⑤转移。
(3)定量检测废水。氢氧化钠溶液和硫酸发生反应但是没有实验现象,兴趣小组同学设计了如图所示实验:
在锥形瓶中加入10g上述(2)中配制的氢氧化钠溶液,滴入几滴酚酞溶液,用滴定管(滴定管为一细长的管状容器,一端具有活栓开关,其上具有刻度指示量度)慢慢滴入废水,并不断振荡,至溶液颜色恰好变为无色为止。请回答:
①酚酞溶液的作用是_____。
②边滴加废水,边不断振荡的目的是_____。
③当滴定管中废水读数为20mL时,锥形瓶溶液中一定存在的阳离子有_____(填离子符号)。
④当b中溶液颜色恰好变为无色时,共用去了废水10mL,则兴趣小组想算出酸性废水中硫酸的质量分数,除了要用到已有数据外,你认为还需要的数据是_____。
(4)兴趣小组同学在滴加废水一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,它的可能原因是_____。请用化学方程式表示其变质的原因_____;若要除去溶液中变质生成的杂质,请简要写出你的实验方案:_____。
三、推断题
16.甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙丙+丁。
(1)若甲、丙为化合物,乙、丁为单质,写出一个符合该反应要求的化学方程式____。
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则甲的化学式为_____,反应发生时能观察到的实验现象是 _________________________。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应 ______(“一定”或“不一定”)是中和反应,理由是______________________。
17.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式:__________;
(2)操作1的名称为__________;
(3)反应3中会有气体生成,该气体是_________;
(4)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为________;
(5)若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水________g。
四、计算题
18.某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g,放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)样品中Na2CO3的质量分数;
(3)反应后所得溶液中溶质的质量分数。
19.某化学兴趣小组同学们与老师一起探究铝的化学性质时发现, 铝还能与氢氧化钠溶液反应,其反应的化学方程式为:2A1+ 2NaOH+ 2H2O=2NaAlO2 +3H2↑。现取某氢氧化钠溶液样品50g例入烧杯中,再向其中放入足量打磨好的铝片,生成气体质量与加入铝片质量的变化关系如图所示。
试回答下列问题:
(1)反应完成后生成氢气的质量为__________g。
(2)求原氢氧化钠溶液中氢氧化钠的质量分数为_______。(请写出计算过程)
20.现有200g10%的氯化钾溶液,分为两等份。
(1)每分溶液的溶质质量分数______,这体现了溶液的______。
(2)将其中一份溶液溶质的质量分数增大到20%,应向此溶液中加入_____氯化钾(假设所甲氯化钾全部溶解)。
参考答案
1.C 2.B 3.D 4.D 5.A 6.D 7.D 8.D 9.B 10.C 11.D 12.A 13.B
14.溶质与溶剂的性质 降温结晶 加快NaCl的溶解 由溶解度曲线可知,20℃时,50g水中最多溶解NaCl的质量为18g,而甲在50g水中加入了16g NaCl
15.取少量溶液于试管中,滴加石蕊试液,石蕊试液变红色,说明溶液显酸性 8 192 B、A 判断是否恰好完全反应 使反应物充分反应 Na+ 废水密度 氢氧化钠和二氧化碳反应生成了碳酸钠和水 2NaOH+CO2═Na2CO3+H2O 向废水中加入氢氧化钙溶液,直至不产生沉淀时为止,过滤
16.Fe+ 2HCl = FeCl2 + H2↑(合理即可) CuCl2(可溶性铜盐即可) 有蓝色沉淀生成 不一定 某些金属氧化物与酸反应也能生成盐和水(或某些非金属氧化物与碱反应也能生成盐和水)
17.Fe + H2SO4 = Fe SO4 + H2↑ 过滤 CO2 7 : 9 1290
18.(1)2.2 g;
(2)88.3%;
(3)13.1%。
19.0.6 16%
20.10% 均一性 12.5g
