人教版高中化学选修四第四章《第一节 原电池》公开课(15张)
文档属性
| 名称 | 人教版高中化学选修四第四章《第一节 原电池》公开课(15张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-22 19:46:22 | ||
图片预览




文档简介
(共16张PPT)
组织建设
化学 · 选修4《化学反应原理》
原电池
【课标要求】
课标要求
1.以铜锌原电池为例,熟悉原电池的工作原理。
2.会正确判断原电池的正极和负极。
3.掌握原电池电极反应式的书写方法。
【探究活动一】原电池知识回顾
温故知新
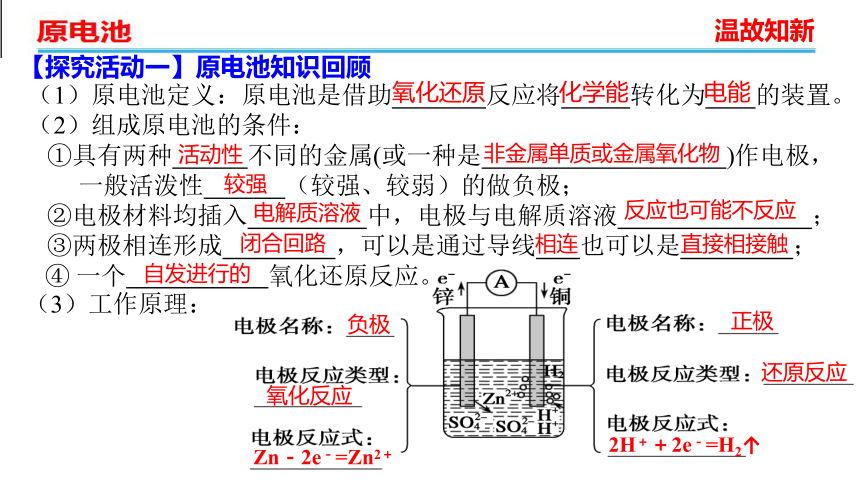
(1)原电池定义:原电池是借助 反应将 转化为 的装置。
(2)组成原电池的条件:
①具有两种 不同的金属(或一种是 )作电极,
一般活泼性 (较强、较弱)的做负极;
②电极材料均插入 中,电极与电解质溶液 ;
③两极相连形成 ,可以是通过导线 也可以是 ;
④ 一个 氧化还原反应。
(3)工作原理:
氧化还原
化学能
电能
活动性
非金属单质或金属氧化物
较强
电解质溶液
反应也可能不反应
闭合回路
相连
直接相接触
自发进行的
负极
正极
氧化反应
还原反应
Zn-2e-=Zn2+
2H++2e-=H2↑
【注意】①原电池中电子和电流沿导线流向相反。
②形成原电池后化学反应速率明显加快。
【问题】以下哪些装置可以形成原电池?
问题导学
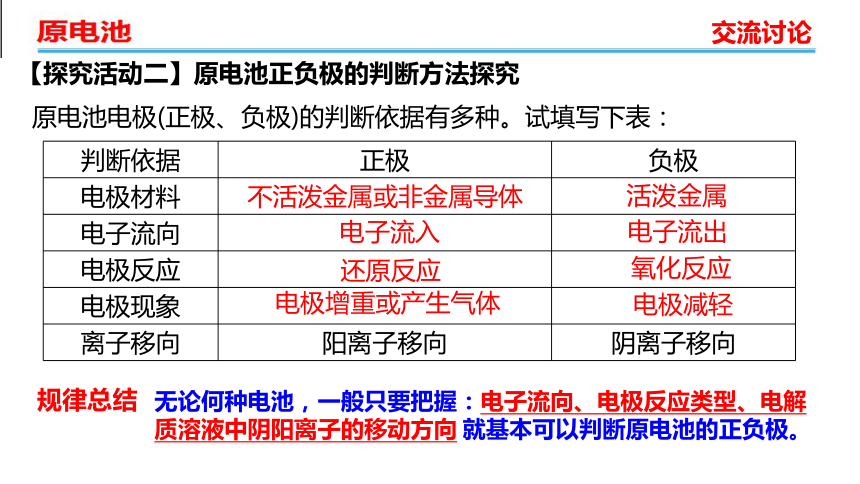
【探究活动二】原电池正负极的判断方法探究
交流讨论
原电池电极(正极、负极)的判断依据有多种。试填写下表:
电极减轻
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
规律总结
无论何种电池,一般只要把握:电子流向、电极反应类型、电解质溶液中阴阳离子的移动方向 就基本可以判断原电池的正负极。
判断依据 正极 负极
电极材料
电子流向
电极反应
电极现象
离子移向 阳离子移向 阴离子移向
问题导学
【探究活动三】盐桥(双液)原电池与单液原电池比较
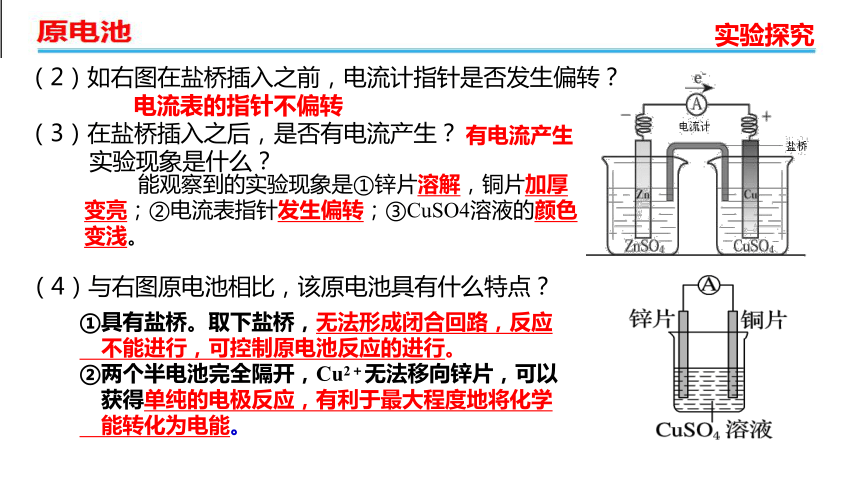
(1)我们已所学过的原电池(如右图),是为了便于说明原电池化学原理的一种最简单的装置。如果用它作电源,不但效率低,而且时间稍长,电流就不断减弱,因此不适合于实际应用。这是什么原因呢?如何改进?
造成的主要原因:
由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。
【问题】
(2)如右图在盐桥插入之前,电流计指针是否发生偏转?
(3)在盐桥插入之后,是否有电流产生?
实验现象是什么?
(4)与右图原电池相比,该原电池具有什么特点?
实验探究
电流表的指针不偏转
能观察到的实验现象是①锌片溶解,铜片加厚变亮;②电流表指针发生偏转;③CuSO4溶液的颜色变浅。
①具有盐桥。取下盐桥,无法形成闭合回路,反应
不能进行,可控制原电池反应的进行。
②两个半电池完全隔开,Cu2+无法移向锌片,可以
获得单纯的电极反应,有利于最大程度地将化学
能转化为电能。
有电流产生
思考交流
(5)什么是盐桥?盐桥的作用是什么?
盐桥的成分:饱和的KCl溶液和琼脂
盐桥的作用:
①可使由它连接的两溶液保持电中性。
②保障整个电路闭合,维持反应进行。
③转移离子,沟通内电路。
认识盐桥
盐桥原电池的工作原理
锌半电池
铜半电池
交流总结
盐桥原电池把氧化反应和还原反应分开在不同区域进行,由于盐桥中的盐溶液是电解质溶液,能成为连接两个烧杯中溶液的一个通路。由于锌失去电子变成Zn2+进入溶液,电子通过导线流向铜片,硫酸铜溶液中的Cu2+从铜片上获得电子变成铜原子沉积在铜片上。
一定时间后,溶液会因带电离子的积累(ZnSO4溶液中的Zn2+离子过多,CuSO4溶液中的SO42-离子过多)而阻碍电子的转移。而盐桥存在,允许溶液中离子迁移,以中和过剩的电荷,起了沟通电路的作用,使传递电子的反应能继续进行。于是,锌和CuSO4的氧化还原反应的化学能转变成外电路上电子流动的电能。
【小试牛刀】
依据氧化还原反应:2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq)设计的
原电池如下图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是 。
(2)银电极为电池的_______极,发生的电极反应式为 ;
X电极上发生的电极反应式为__________________________。
(3)外电路中的电子是从________电极流向__________电极。
思考交流
【探究活动四】原电池工作原理应用之设计原电池
Cu
AgNO3溶液
正
Ag++e-=Ag
Cu-2e-=Cu2+
Cu(负)
Ag(正)
思考交流
原电池的设计的一般规律与方法总结
1、基本方法:
从理论上讲,可自发进行的氧化还原反应都可以设计成原电池,还原剂在负极上发生氧化反应,失去的电子通过导线转移到正极上,氧化剂在正极上得到电子发生还原反应,从而形成闭合回路,外电路中则有电流产生。
2、电解质溶液的选择
电解质是使负极放电的物质。因此电解质溶液一般要能够与负极发生反应。若为两个半反应则:两个容器中的电解质溶液选择与电极材料相同的阳离子的盐溶液。
3、电极材料的选择
一般情况下,活泼金属做负极,较弱金属或非金属单质或金属氧化物作正极
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
D
课堂巩固
【再试牛刀】
1.某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法
中正确的是( )
A.用HNO3作电解质溶液 B.用锌作原电池正极
C.用铁作负极,铁的质量不变 D.用铜作原电池正极
2.如图所示的装置中有电流产生,则以下说法不正确的是( )
A.Fe是负极,C是正极
B.负极反应式为Fe-3e-=Fe3+
C.内电路中阴离子移向FeCl2溶液
D.电流由石墨电极流向Fe电极
B
C
课堂巩固
3.一个电池反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电
池正确组合是 ( )
4.下列叙述正确的是( )
A.反应AlCl3+4NaOH=NaAlO2+3NaCl+2H2O可以设计成原电池
B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu
片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
B
选项 A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
5.利用反应Cu+2FeCl3 = CuCl2+2FeCl2设计成如下图所示的原电池,
回答下列问题:
①写出电极反应式:
正极_________________________;
负极__________________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方
向移动。
课堂巩固
2Fe3++2e-= 2Fe2+
Cu-2e-= Cu2+
FeCl3
CuCl2
阳
组织建设
化学 · 选修4《化学反应原理》
原电池
【课标要求】
课标要求
1.以铜锌原电池为例,熟悉原电池的工作原理。
2.会正确判断原电池的正极和负极。
3.掌握原电池电极反应式的书写方法。
【探究活动一】原电池知识回顾
温故知新
(1)原电池定义:原电池是借助 反应将 转化为 的装置。
(2)组成原电池的条件:
①具有两种 不同的金属(或一种是 )作电极,
一般活泼性 (较强、较弱)的做负极;
②电极材料均插入 中,电极与电解质溶液 ;
③两极相连形成 ,可以是通过导线 也可以是 ;
④ 一个 氧化还原反应。
(3)工作原理:
氧化还原
化学能
电能
活动性
非金属单质或金属氧化物
较强
电解质溶液
反应也可能不反应
闭合回路
相连
直接相接触
自发进行的
负极
正极
氧化反应
还原反应
Zn-2e-=Zn2+
2H++2e-=H2↑
【注意】①原电池中电子和电流沿导线流向相反。
②形成原电池后化学反应速率明显加快。
【问题】以下哪些装置可以形成原电池?
问题导学
【探究活动二】原电池正负极的判断方法探究
交流讨论
原电池电极(正极、负极)的判断依据有多种。试填写下表:
电极减轻
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
规律总结
无论何种电池,一般只要把握:电子流向、电极反应类型、电解质溶液中阴阳离子的移动方向 就基本可以判断原电池的正负极。
判断依据 正极 负极
电极材料
电子流向
电极反应
电极现象
离子移向 阳离子移向 阴离子移向
问题导学
【探究活动三】盐桥(双液)原电池与单液原电池比较
(1)我们已所学过的原电池(如右图),是为了便于说明原电池化学原理的一种最简单的装置。如果用它作电源,不但效率低,而且时间稍长,电流就不断减弱,因此不适合于实际应用。这是什么原因呢?如何改进?
造成的主要原因:
由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。
【问题】
(2)如右图在盐桥插入之前,电流计指针是否发生偏转?
(3)在盐桥插入之后,是否有电流产生?
实验现象是什么?
(4)与右图原电池相比,该原电池具有什么特点?
实验探究
电流表的指针不偏转
能观察到的实验现象是①锌片溶解,铜片加厚变亮;②电流表指针发生偏转;③CuSO4溶液的颜色变浅。
①具有盐桥。取下盐桥,无法形成闭合回路,反应
不能进行,可控制原电池反应的进行。
②两个半电池完全隔开,Cu2+无法移向锌片,可以
获得单纯的电极反应,有利于最大程度地将化学
能转化为电能。
有电流产生
思考交流
(5)什么是盐桥?盐桥的作用是什么?
盐桥的成分:饱和的KCl溶液和琼脂
盐桥的作用:
①可使由它连接的两溶液保持电中性。
②保障整个电路闭合,维持反应进行。
③转移离子,沟通内电路。
认识盐桥
盐桥原电池的工作原理
锌半电池
铜半电池
交流总结
盐桥原电池把氧化反应和还原反应分开在不同区域进行,由于盐桥中的盐溶液是电解质溶液,能成为连接两个烧杯中溶液的一个通路。由于锌失去电子变成Zn2+进入溶液,电子通过导线流向铜片,硫酸铜溶液中的Cu2+从铜片上获得电子变成铜原子沉积在铜片上。
一定时间后,溶液会因带电离子的积累(ZnSO4溶液中的Zn2+离子过多,CuSO4溶液中的SO42-离子过多)而阻碍电子的转移。而盐桥存在,允许溶液中离子迁移,以中和过剩的电荷,起了沟通电路的作用,使传递电子的反应能继续进行。于是,锌和CuSO4的氧化还原反应的化学能转变成外电路上电子流动的电能。
【小试牛刀】
依据氧化还原反应:2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq)设计的
原电池如下图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是 。
(2)银电极为电池的_______极,发生的电极反应式为 ;
X电极上发生的电极反应式为__________________________。
(3)外电路中的电子是从________电极流向__________电极。
思考交流
【探究活动四】原电池工作原理应用之设计原电池
Cu
AgNO3溶液
正
Ag++e-=Ag
Cu-2e-=Cu2+
Cu(负)
Ag(正)
思考交流
原电池的设计的一般规律与方法总结
1、基本方法:
从理论上讲,可自发进行的氧化还原反应都可以设计成原电池,还原剂在负极上发生氧化反应,失去的电子通过导线转移到正极上,氧化剂在正极上得到电子发生还原反应,从而形成闭合回路,外电路中则有电流产生。
2、电解质溶液的选择
电解质是使负极放电的物质。因此电解质溶液一般要能够与负极发生反应。若为两个半反应则:两个容器中的电解质溶液选择与电极材料相同的阳离子的盐溶液。
3、电极材料的选择
一般情况下,活泼金属做负极,较弱金属或非金属单质或金属氧化物作正极
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
D
课堂巩固
【再试牛刀】
1.某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法
中正确的是( )
A.用HNO3作电解质溶液 B.用锌作原电池正极
C.用铁作负极,铁的质量不变 D.用铜作原电池正极
2.如图所示的装置中有电流产生,则以下说法不正确的是( )
A.Fe是负极,C是正极
B.负极反应式为Fe-3e-=Fe3+
C.内电路中阴离子移向FeCl2溶液
D.电流由石墨电极流向Fe电极
B
C
课堂巩固
3.一个电池反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电
池正确组合是 ( )
4.下列叙述正确的是( )
A.反应AlCl3+4NaOH=NaAlO2+3NaCl+2H2O可以设计成原电池
B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu
片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动
B
选项 A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
5.利用反应Cu+2FeCl3 = CuCl2+2FeCl2设计成如下图所示的原电池,
回答下列问题:
①写出电极反应式:
正极_________________________;
负极__________________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方
向移动。
课堂巩固
2Fe3++2e-= 2Fe2+
Cu-2e-= Cu2+
FeCl3
CuCl2
阳
