人教版高中化学必修2第二章《化学反应与能量》检测题(含答案)
文档属性
| 名称 | 人教版高中化学必修2第二章《化学反应与能量》检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 435.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-23 10:31:21 | ||
图片预览


文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
《化学反应与能量》检测题
一、单选题
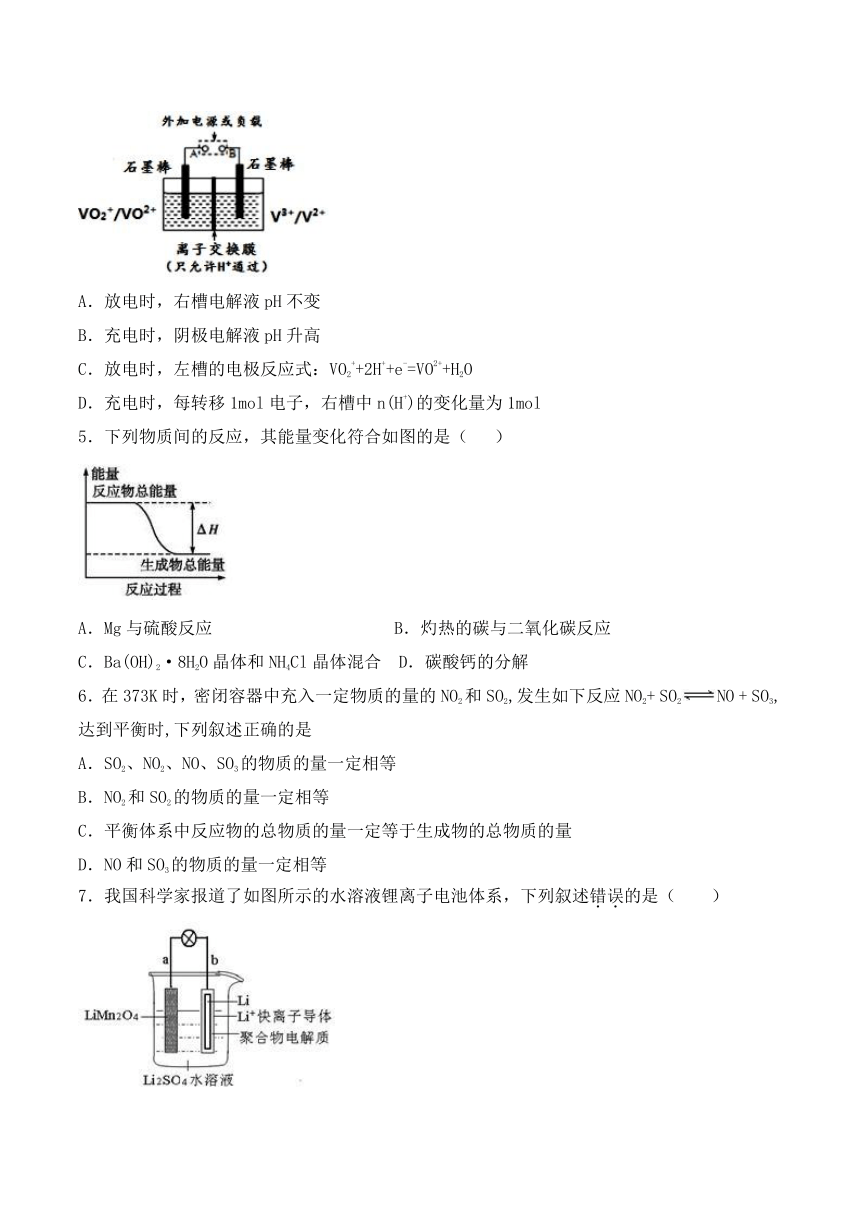
1.根据下图回答,下列说法不正确的是
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.燃料电池中正极反应为O2+4e?+4H+===2H2O
C.电子经导线流入a电极
D.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼
2.右图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是
A.Fe用作正极 B.Cu片质量减少
C.电子由Fe并经导线流向Cu片 D.实现了电能向化学能的转化
3.下列变化过程属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③稀释浓硫酸 ④固体氢氧化钠溶于水 ⑤碳和水蒸气在高温条件下反应生成水煤气 ⑥和盐酸反应
A.②③④ B.①⑤⑥ C.②⑥ D.①③④
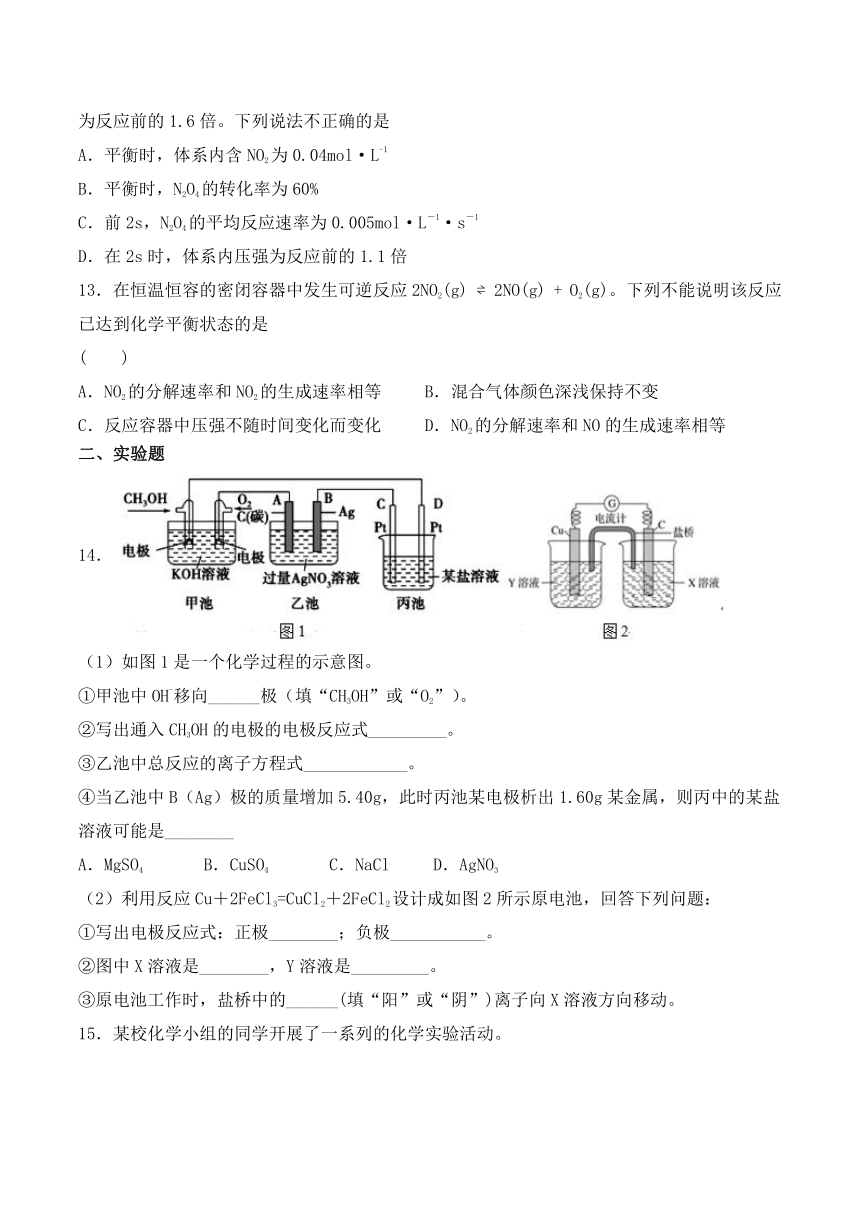
4.全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是 ( )
A.放电时,右槽电解液pH不变
B.充电时,阴极电解液pH升高
C.放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
D.充电时,每转移1mol电子,右槽中n(H+)的变化量为1mol
5.下列物质间的反应,其能量变化符合如图的是( )
A.Mg与硫酸反应 B.灼热的碳与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解
6.在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应NO2+ SO2NO + SO3,达到平衡时,下列叙述正确的是
A.SO2、NO2、NO、SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D.NO和SO3的物质的量一定相等
7.我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是(??)
A.放电时,a极锂的化合价发生变化 B.电流的方向为a到b
C.a为电池的正极 D.放电时,溶液中Li+从b向a迁移
8.一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
A.10min时,反应达到平衡
B.曲线a表示NO2的物质的量随反应时间的变化
C.0~20min内平均反应速率v(N2O5)=0.1mol?L-1?min-1
D.达到平衡时,N2O5的转化率为60%
9.一定温度下在容积恒定的密闭容器中,可逆反应A(s)+2B(g)C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
A.v(B)正=2v(C)逆 B.容器内每消耗1molA,同时消耗1molD
C.容器内气体的密度不变 D.向容器中加入少量A,平衡正向移动,K不变
10.在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)3C(g),只有反应到达平衡时才具有的性质是
A.各物质的浓度之比为2:3:3 B.混合物各物质的浓度相等
C.A、B、C三种物质的浓度不随时间变化而变化 D.ν(A)、ν(B)、ν(C)之比为2:3:3
11.铝-空气电池具有体积小、能量大,污染少等优点,是电动自行车和电动汽车比较理想的电源。电池以食盐水为电解液,总反应为:4Al+3O2+6H2O=4Al(OH)3↓,下列说法中正确的是
A.电池工作时,铝做正极
B.电池负极的电极反应式为:3O2+6H2O+12e-=12OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过1mol e—,铝的质量理论上减小9g
12.在100℃时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A.平衡时,体系内含NO2为0.04mol·L-1
B.平衡时,N2O4的转化率为60%
C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
D.在2s时,体系内压强为反应前的1.1倍
13.在恒温恒容的密闭容器中发生可逆反应2NO2(g) ? 2NO(g) + O2(g)。下列不能说明该反应已达到化学平衡状态的是 ( )
A.NO2的分解速率和NO2的生成速率相等 B.混合气体颜色深浅保持不变
C.反应容器中压强不随时间变化而变化 D.NO2的分解速率和NO的生成速率相等
二、实验题
14.
(1)如图1是一个化学过程的示意图。
①甲池中OH-移向______极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_________。
③乙池中总反应的离子方程式____________。
④当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图2所示原电池,回答下列问题:
①写出电极反应式:正极________;负极___________。
②图中X溶液是________,Y溶液是_________。
③原电池工作时,盐桥中的______(填“阳”或“阴”)离子向X溶液方向移动。
15.某校化学小组的同学开展了一系列的化学实验活动。
请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g 锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录______得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是_____。
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于___、__仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是___;
③仪器甲、乙接口的连接方式如下:A连接__,B连接___,C连接___(填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差___,请你分析其中使测定结果可能偏大的主要原因___。
三、推断题
16.A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,各物质之间的转化关系如图所示部分反应条件略去.
若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
若组成A的元素在短周期中原子半径最大稀有气体除外,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______ 填“增大”、“减小”或“不变”.
若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
将的X溶液与的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
17.固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H= -49.0 kJ/mol
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):
回答下列问题:
(1)该反应在_____条件下能自发进行(填编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0~8 min内CO2的平均反应速率是_________mol/(L?min)。
(3)该反应的平衡常数K=_______。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是__________,曲线Ⅱ改变的条件可能是_______________。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是______________。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
四、计算题
18.常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
(1)原混合溶液中NaCl和CuSO4的物质的量浓度。
(2)电解至t3时,消耗水的质量。
19.某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求:
(1)该反应的化学方程式为_________________________________。
(2)反应开始至4 min时,A的平均反应速率为_________________。(要求写出计算过程)
(3)第4min末时A、B的物质的量浓度依次为________、________。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
20.将铜片、锌片和250mL稀硫酸组成原电池,当在铜片上放出6.72L(标准状况下)的气体时,H2SO4恰好反应完全。
(1)该原电池的负极反应式为__________________________。
(2)原稀硫酸的物质的量浓度是_________mol·L-1。
(3)列式计算锌片减少的质量。____________
参考答案
1.C 2.C 3.C 4.C 5.A 6.D 7.A 8.B 9.D 10.C 11.D 12.A 13.D
14.阳 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O 4Ag++2H2O4Ag+O2↑+4H+ BD 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2
15.反应时间 关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气 甲 乙 碱式滴定管 D E F 上下移动滴定管,使左右两边液面相平 偏大 CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中
16.CO 半导体、芯片、太阳能电池板等 减小
17.B 0.125 mol/(L?min) 0.5 升高温度 增大压强 K1<K2=K BD
18.c(CuSO4)=0. 1 mol/L。(2)0.72 g
19.3A2B 0.05mol/(L· min) 0.2mol/L 0.2mol/L > =
20.Zn-2e-=Zn2+ 1.2 19.5g
答案第2页,总2页
《化学反应与能量》检测题
一、单选题
1.根据下图回答,下列说法不正确的是
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.燃料电池中正极反应为O2+4e?+4H+===2H2O
C.电子经导线流入a电极
D.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼
2.右图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是
A.Fe用作正极 B.Cu片质量减少
C.电子由Fe并经导线流向Cu片 D.实现了电能向化学能的转化
3.下列变化过程属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③稀释浓硫酸 ④固体氢氧化钠溶于水 ⑤碳和水蒸气在高温条件下反应生成水煤气 ⑥和盐酸反应
A.②③④ B.①⑤⑥ C.②⑥ D.①③④
4.全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是 ( )
A.放电时,右槽电解液pH不变
B.充电时,阴极电解液pH升高
C.放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
D.充电时,每转移1mol电子,右槽中n(H+)的变化量为1mol
5.下列物质间的反应,其能量变化符合如图的是( )
A.Mg与硫酸反应 B.灼热的碳与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解
6.在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应NO2+ SO2NO + SO3,达到平衡时,下列叙述正确的是
A.SO2、NO2、NO、SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D.NO和SO3的物质的量一定相等
7.我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是(??)
A.放电时,a极锂的化合价发生变化 B.电流的方向为a到b
C.a为电池的正极 D.放电时,溶液中Li+从b向a迁移
8.一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
A.10min时,反应达到平衡
B.曲线a表示NO2的物质的量随反应时间的变化
C.0~20min内平均反应速率v(N2O5)=0.1mol?L-1?min-1
D.达到平衡时,N2O5的转化率为60%
9.一定温度下在容积恒定的密闭容器中,可逆反应A(s)+2B(g)C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
A.v(B)正=2v(C)逆 B.容器内每消耗1molA,同时消耗1molD
C.容器内气体的密度不变 D.向容器中加入少量A,平衡正向移动,K不变
10.在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)3C(g),只有反应到达平衡时才具有的性质是
A.各物质的浓度之比为2:3:3 B.混合物各物质的浓度相等
C.A、B、C三种物质的浓度不随时间变化而变化 D.ν(A)、ν(B)、ν(C)之比为2:3:3
11.铝-空气电池具有体积小、能量大,污染少等优点,是电动自行车和电动汽车比较理想的电源。电池以食盐水为电解液,总反应为:4Al+3O2+6H2O=4Al(OH)3↓,下列说法中正确的是
A.电池工作时,铝做正极
B.电池负极的电极反应式为:3O2+6H2O+12e-=12OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过1mol e—,铝的质量理论上减小9g
12.在100℃时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A.平衡时,体系内含NO2为0.04mol·L-1
B.平衡时,N2O4的转化率为60%
C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
D.在2s时,体系内压强为反应前的1.1倍
13.在恒温恒容的密闭容器中发生可逆反应2NO2(g) ? 2NO(g) + O2(g)。下列不能说明该反应已达到化学平衡状态的是 ( )
A.NO2的分解速率和NO2的生成速率相等 B.混合气体颜色深浅保持不变
C.反应容器中压强不随时间变化而变化 D.NO2的分解速率和NO的生成速率相等
二、实验题
14.
(1)如图1是一个化学过程的示意图。
①甲池中OH-移向______极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_________。
③乙池中总反应的离子方程式____________。
④当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图2所示原电池,回答下列问题:
①写出电极反应式:正极________;负极___________。
②图中X溶液是________,Y溶液是_________。
③原电池工作时,盐桥中的______(填“阳”或“阴”)离子向X溶液方向移动。
15.某校化学小组的同学开展了一系列的化学实验活动。
请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g 锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录______得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是_____。
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于___、__仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是___;
③仪器甲、乙接口的连接方式如下:A连接__,B连接___,C连接___(填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差___,请你分析其中使测定结果可能偏大的主要原因___。
三、推断题
16.A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,各物质之间的转化关系如图所示部分反应条件略去.
若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
若组成A的元素在短周期中原子半径最大稀有气体除外,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______ 填“增大”、“减小”或“不变”.
若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
将的X溶液与的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
17.固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H= -49.0 kJ/mol
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):
回答下列问题:
(1)该反应在_____条件下能自发进行(填编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0~8 min内CO2的平均反应速率是_________mol/(L?min)。
(3)该反应的平衡常数K=_______。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是__________,曲线Ⅱ改变的条件可能是_______________。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是______________。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
四、计算题
18.常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
(1)原混合溶液中NaCl和CuSO4的物质的量浓度。
(2)电解至t3时,消耗水的质量。
19.某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求:
(1)该反应的化学方程式为_________________________________。
(2)反应开始至4 min时,A的平均反应速率为_________________。(要求写出计算过程)
(3)第4min末时A、B的物质的量浓度依次为________、________。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
20.将铜片、锌片和250mL稀硫酸组成原电池,当在铜片上放出6.72L(标准状况下)的气体时,H2SO4恰好反应完全。
(1)该原电池的负极反应式为__________________________。
(2)原稀硫酸的物质的量浓度是_________mol·L-1。
(3)列式计算锌片减少的质量。____________
参考答案
1.C 2.C 3.C 4.C 5.A 6.D 7.A 8.B 9.D 10.C 11.D 12.A 13.D
14.阳 CH3OH CH3OH-6e-+8OH-=CO32-+6H2O 4Ag++2H2O4Ag+O2↑+4H+ BD 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2
15.反应时间 关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气 甲 乙 碱式滴定管 D E F 上下移动滴定管,使左右两边液面相平 偏大 CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中
16.CO 半导体、芯片、太阳能电池板等 减小
17.B 0.125 mol/(L?min) 0.5 升高温度 增大压强 K1<K2=K BD
18.c(CuSO4)=0. 1 mol/L。(2)0.72 g
19.3A2B 0.05mol/(L· min) 0.2mol/L 0.2mol/L > =
20.Zn-2e-=Zn2+ 1.2 19.5g
答案第2页,总2页
