人教版高二化学选修四第一章第一节化学反应与能量变化 (共28张PPT)
文档属性
| 名称 | 人教版高二化学选修四第一章第一节化学反应与能量变化 (共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-23 11:11:39 | ||
图片预览






文档简介
(共39张PPT)
一飞冲天:“神舟”五号发射实况回放
这一烟火表演消耗了大量的化学能,烟火中不同的色彩是燃烧不同的化学物质产生的。
第一章 化学反应与能量
第一节 化学反应与能量的变化
一、焓、焓变
1、焓:与内能有关的物理量 符号:H
2、焓变:生成物与反应物的焓值差
符号:△H
单位: kJ/mol 或 kJ·mol-1
3、在一定条件下,判断某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
△H = H生成物-H反应物
二、反应热
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,
(焓变)
符号:△H
单位: kJ/mol 或 kJ·mol-1
在恒温、恒压的条件下:反应热=焓变
化学反应有新物质生成,反应物的总能量与生成物的总能量不可能完全相等.
本质:
ΔH=生成物能量-反应物能量
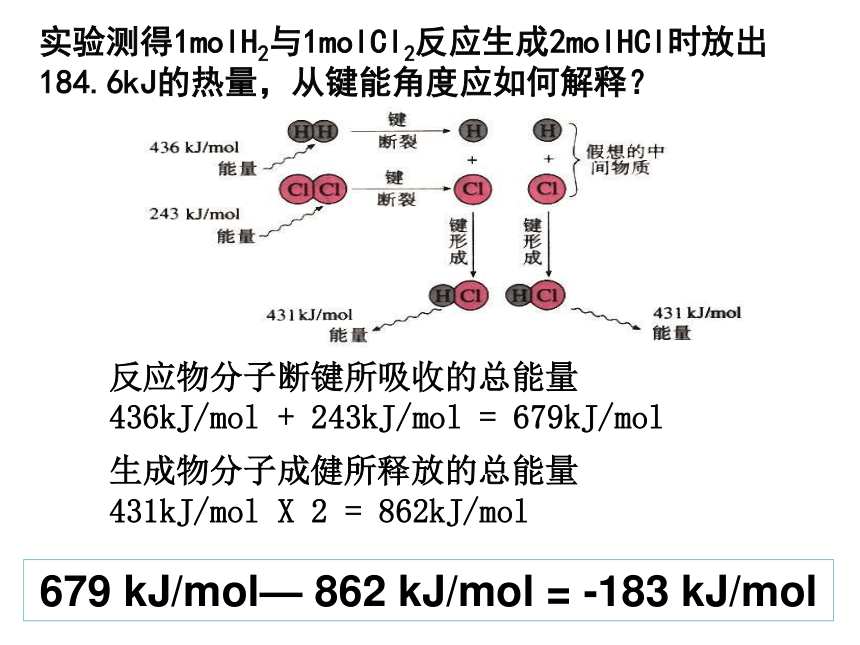
实验测得1molH2与1molCl2反应生成2molHCl时放出184.6kJ的热量,从键能角度应如何解释?
679 kJ/mol— 862 kJ/mol = -183 kJ/mol
生成物分子成健所释放的总能量
431kJ/mol X 2 = 862kJ/mol
反应物分子断键所吸收的总能量
436kJ/mol + 243kJ/mol = 679kJ/mol
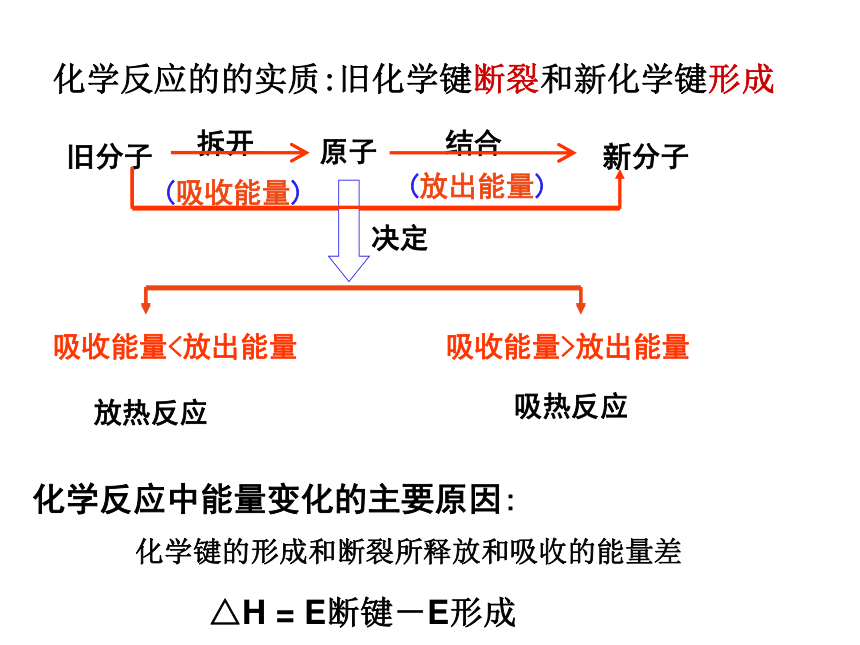
化学反应的的实质:旧化学键断裂和新化学键形成
化学反应中能量变化的主要原因:
化学键的形成和断裂所释放和吸收的能量差
△H = E断键-E形成
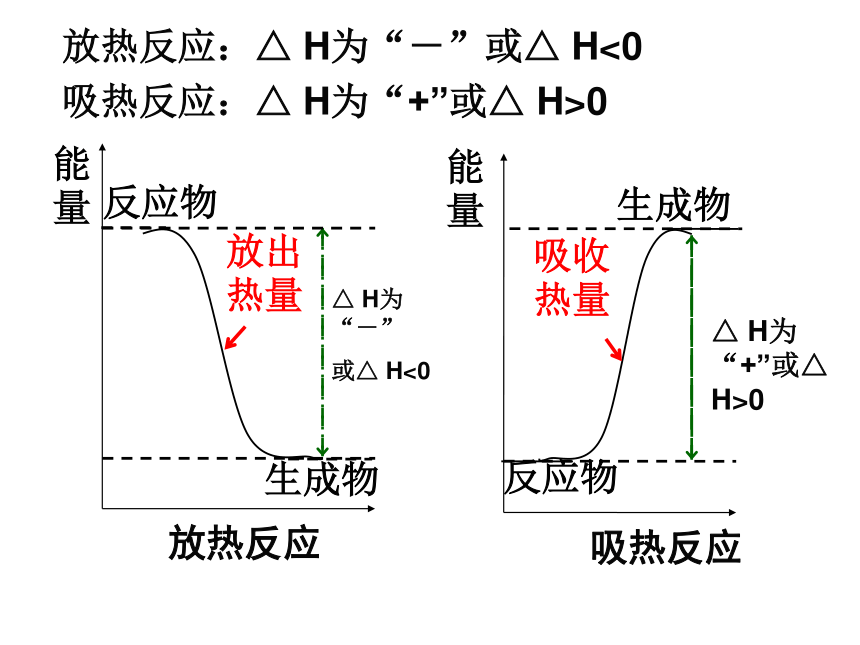
放热反应:△ H为“-”或△ H<0
吸热反应:△ H为“+”或△ H>0
生成物
能量
放热反应
吸热反应
燃料的燃烧
酸碱中和反应
金属与酸
大多数化合反应
C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大多数分解反应
常见的放热反应和吸热反应
小 结
一、反应热、焓变
从焓变角度看:
ΔH=生成物的焓-反应物的焓
从反应热角度看:
ΔH=生成物能量-反应物能量
从键能角度看:
ΔH=反应物总键能-生成物总键能
这两个方程式与我们通常所见的方程式有何不同?
CO (g) + O2(g)=CO2(g) ΔH=-283.0kJ/mol
CH4 (g) + 2O2(g)=CO2(g) +H2O(l) ΔH=-890.31kJ/mol
热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式
物质变化
能量变化
★书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,
并用“空格”隔开,
△H:吸热用“+”,放热用:“-”,
单位是kJ/mol或J/mol
注意:“+”不能省写
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
热化学方程式需注明测定时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。
如不注明条件,即指: 25℃ 1.01×105Pa;
★书写热化学方程式的注意事项
例2∶在250C、101KPa时,有两个由氢气和氧气化合成1mol水的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为∶
H2(g)+1/2O2(g)=H2O(g) △H=一241.8KJ/mol
H2(g)+1/2O2(g)=H2O(l) △H=一285.8KJ/mol
请同学们分析为什么二者的产物同样是水,而释出的能量却不同?
结论:物质所具有的能量与它们的聚集状态有关。
液态水变成水蒸气要吸收热量
注:物质后需标聚集状态
s(固体)、l (液体) 、g (气体) 、aq (稀溶液)
例2∶在250C、101KPa时,有两个由氢气和氧气化合成1mol水的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为∶
若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
★书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol
2、需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa;
3、物质后需标聚集状态(s、l、g、aq)
4、热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数
5、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
热化学方程式表示的意义
1)表示什么物质参加反应,结果生成什么物质
2)反应物和生成物之间的质量比、物质的量比
3)反应物完全变成生成物后所放出或吸收的热量。
质→能
总结:热化学方程式既表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
H2(g)+ O2(g)=====H2O(g) △H =-241.8 KJ/mol
4)热化学方程式具有加和性,化学式前面的计量数必须与△H 相对应;反应逆向进行时,△H 值不变,符号相反。
1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。
H2(g)+Cl2(g)=2HCl(g) ?H =-184.6KJ/mol
而这些书写也是对的!!!
(1)正确写出配平的化学方程式;
(2)注明反应物和生成物的状态;
(3)标明反应的焓变△H(注意单位和+、-);
(4)注明反应的温度和压强(若不注明则表示在298K、101kPa下) ;
书写步骤:
写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol
2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol
250C (1.01×105)Pa下,4g CO在氧气中燃烧生成CO2,
放出 9. 6kJ热量,写出CO燃烧的热化学反应方程式。
2CO ( g) + O2 (g) = 2CO2 ( g ) △H = - 134.4 kJ/mol
2CO + O2 = 2CO2
2×28g/mol
△H
-9.6kJ
4 g
2×28g/mol : 4g = △H :- 9.6 kJ
△H =-134.4 kJ/mol
放热
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H=-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+4b kJ/mol
E. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-b kJ/mol
已知充分燃烧 a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量 b kJ,则乙炔燃烧的热化学方程式正确的是( )
B
点拨:热化学方程式书写正误的判断可从△H的正负号、物质的聚集状态、物质的量的大小、单位等主要方面入手
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A. 2CH4 ( g )+4O2 ( g )=2CO2 ( g )+4H2O ( l ) ΔH = +890 kJ/mol
B . CH4 +2 O2 = CO2 + H2O ΔH = -890 kJ/mol
C . CH4 ( g )+2 O2 ( g )=CO2 ( g )+2 H2O ( l ) ΔH = -890 kJ/mol
D . 1/2CH4 ( g )+O2 ( g )=1/2CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/mol
C
实验:中和热的测定
整个装置:
量热计
主要仪器:
温度计
环形玻璃搅拌棒
大小烧杯
辅助用品:
碎泡沫塑料泡沫塑料板
录像
实验注意事项:
①保温效果一定要好,小烧杯和大烧杯的杯口要相平.
②盐酸和氢氧化钠溶液的浓度要准确.所用NaOH溶液稍过量
③宜用有0.1分度的温度计,温度计水解球应浸没在溶液中
④测量完盐酸的温度后,应将温度计用蒸馏水洗后,再去测NaOH溶液的温度.
⑤每次实验仅可能测得反应混合液的最高温度;平行做2-3次实验,其温度采用平均值进行计算;
一飞冲天:“神舟”五号发射实况回放
这一烟火表演消耗了大量的化学能,烟火中不同的色彩是燃烧不同的化学物质产生的。
第一章 化学反应与能量
第一节 化学反应与能量的变化
一、焓、焓变
1、焓:与内能有关的物理量 符号:H
2、焓变:生成物与反应物的焓值差
符号:△H
单位: kJ/mol 或 kJ·mol-1
3、在一定条件下,判断某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
△H = H生成物-H反应物
二、反应热
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,
(焓变)
符号:△H
单位: kJ/mol 或 kJ·mol-1
在恒温、恒压的条件下:反应热=焓变
化学反应有新物质生成,反应物的总能量与生成物的总能量不可能完全相等.
本质:
ΔH=生成物能量-反应物能量
实验测得1molH2与1molCl2反应生成2molHCl时放出184.6kJ的热量,从键能角度应如何解释?
679 kJ/mol— 862 kJ/mol = -183 kJ/mol
生成物分子成健所释放的总能量
431kJ/mol X 2 = 862kJ/mol
反应物分子断键所吸收的总能量
436kJ/mol + 243kJ/mol = 679kJ/mol
化学反应的的实质:旧化学键断裂和新化学键形成
化学反应中能量变化的主要原因:
化学键的形成和断裂所释放和吸收的能量差
△H = E断键-E形成
放热反应:△ H为“-”或△ H<0
吸热反应:△ H为“+”或△ H>0
生成物
能量
放热反应
吸热反应
燃料的燃烧
酸碱中和反应
金属与酸
大多数化合反应
C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大多数分解反应
常见的放热反应和吸热反应
小 结
一、反应热、焓变
从焓变角度看:
ΔH=生成物的焓-反应物的焓
从反应热角度看:
ΔH=生成物能量-反应物能量
从键能角度看:
ΔH=反应物总键能-生成物总键能
这两个方程式与我们通常所见的方程式有何不同?
CO (g) + O2(g)=CO2(g) ΔH=-283.0kJ/mol
CH4 (g) + 2O2(g)=CO2(g) +H2O(l) ΔH=-890.31kJ/mol
热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式
物质变化
能量变化
★书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,
并用“空格”隔开,
△H:吸热用“+”,放热用:“-”,
单位是kJ/mol或J/mol
注意:“+”不能省写
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
热化学方程式需注明测定时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。
如不注明条件,即指: 25℃ 1.01×105Pa;
★书写热化学方程式的注意事项
例2∶在250C、101KPa时,有两个由氢气和氧气化合成1mol水的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为∶
H2(g)+1/2O2(g)=H2O(g) △H=一241.8KJ/mol
H2(g)+1/2O2(g)=H2O(l) △H=一285.8KJ/mol
请同学们分析为什么二者的产物同样是水,而释出的能量却不同?
结论:物质所具有的能量与它们的聚集状态有关。
液态水变成水蒸气要吸收热量
注:物质后需标聚集状态
s(固体)、l (液体) 、g (气体) 、aq (稀溶液)
例2∶在250C、101KPa时,有两个由氢气和氧气化合成1mol水的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为∶
若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
★书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol
2、需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa;
3、物质后需标聚集状态(s、l、g、aq)
4、热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数
5、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
热化学方程式表示的意义
1)表示什么物质参加反应,结果生成什么物质
2)反应物和生成物之间的质量比、物质的量比
3)反应物完全变成生成物后所放出或吸收的热量。
质→能
总结:热化学方程式既表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
H2(g)+ O2(g)=====H2O(g) △H =-241.8 KJ/mol
4)热化学方程式具有加和性,化学式前面的计量数必须与△H 相对应;反应逆向进行时,△H 值不变,符号相反。
1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。
H2(g)+Cl2(g)=2HCl(g) ?H =-184.6KJ/mol
而这些书写也是对的!!!
(1)正确写出配平的化学方程式;
(2)注明反应物和生成物的状态;
(3)标明反应的焓变△H(注意单位和+、-);
(4)注明反应的温度和压强(若不注明则表示在298K、101kPa下) ;
书写步骤:
写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol
2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol
250C (1.01×105)Pa下,4g CO在氧气中燃烧生成CO2,
放出 9. 6kJ热量,写出CO燃烧的热化学反应方程式。
2CO ( g) + O2 (g) = 2CO2 ( g ) △H = - 134.4 kJ/mol
2CO + O2 = 2CO2
2×28g/mol
△H
-9.6kJ
4 g
2×28g/mol : 4g = △H :- 9.6 kJ
△H =-134.4 kJ/mol
放热
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-4b kJ/mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H=-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+4b kJ/mol
E. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-b kJ/mol
已知充分燃烧 a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量 b kJ,则乙炔燃烧的热化学方程式正确的是( )
B
点拨:热化学方程式书写正误的判断可从△H的正负号、物质的聚集状态、物质的量的大小、单位等主要方面入手
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A. 2CH4 ( g )+4O2 ( g )=2CO2 ( g )+4H2O ( l ) ΔH = +890 kJ/mol
B . CH4 +2 O2 = CO2 + H2O ΔH = -890 kJ/mol
C . CH4 ( g )+2 O2 ( g )=CO2 ( g )+2 H2O ( l ) ΔH = -890 kJ/mol
D . 1/2CH4 ( g )+O2 ( g )=1/2CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/mol
C
实验:中和热的测定
整个装置:
量热计
主要仪器:
温度计
环形玻璃搅拌棒
大小烧杯
辅助用品:
碎泡沫塑料泡沫塑料板
录像
实验注意事项:
①保温效果一定要好,小烧杯和大烧杯的杯口要相平.
②盐酸和氢氧化钠溶液的浓度要准确.所用NaOH溶液稍过量
③宜用有0.1分度的温度计,温度计水解球应浸没在溶液中
④测量完盐酸的温度后,应将温度计用蒸馏水洗后,再去测NaOH溶液的温度.
⑤每次实验仅可能测得反应混合液的最高温度;平行做2-3次实验,其温度采用平均值进行计算;
