第一章《水》复习课件
图片预览






文档简介
(共43张PPT)
七下第一章《水》复习
华师大版 初中
海洋占地球表面积的71%
一、地球上的水
1. 海洋水: 陆地水:
大气水和生物体内的水:极少量
可以说明大气中有水的现象:
不同生物体含水量不同,同一生物体各个部分含水量也不同
2. 咸水:97.5% 淡水:2.5%
3. 人类可利用的淡水存在于河流湖泊和沼泽土壤中,仅占地球全部淡水资源的0.3%
4. 人体的含水量约占体重的60%,
排出水的途径:排汗,排尿,呼吸
每天至少应饮水2~2.5L。
各种水的比例
清晨的露珠等
96.5%
3.5%
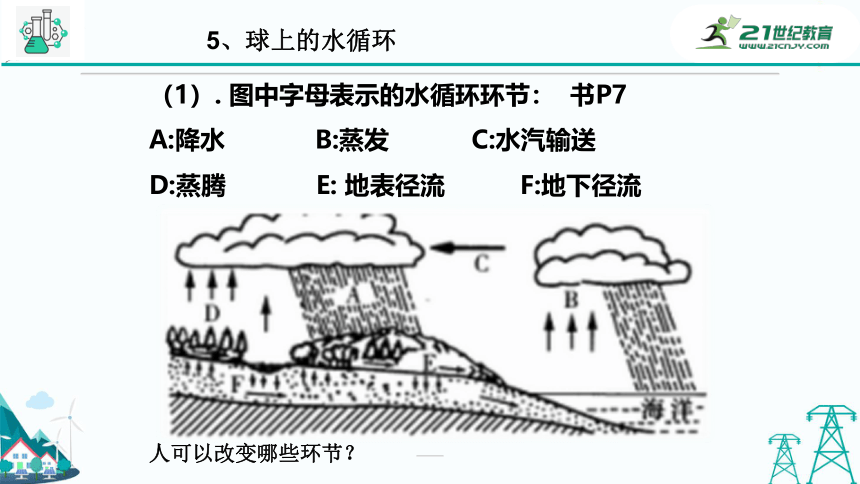
5、球上的水循环
(1). 图中字母表示的水循环环节: 书P7
A:降水 B:蒸发 C:水汽输送
D:蒸腾 E: 地表径流 F:地下径流
人可以改变哪些环节?
(2). 水循环的形成:
内因:水的温度不同,水的状态不同
外因:太阳辐射、重力
(3). 水循环类型:
小循环:①陆上内循环:陆地 — 大气
②海上内循环:海洋 — 大气
大循环:海陆间循环:海洋 — 陆地 — 大气
(4). 水循环的意义:
①水循环使地球上各水体之间相互联系,使水圈成为一个动态的系统;
②通过水循环,使海洋资源源源不断的向陆地供应淡水,滋润土地,哺育生命。
(5). 水循环时水的总量变吗?
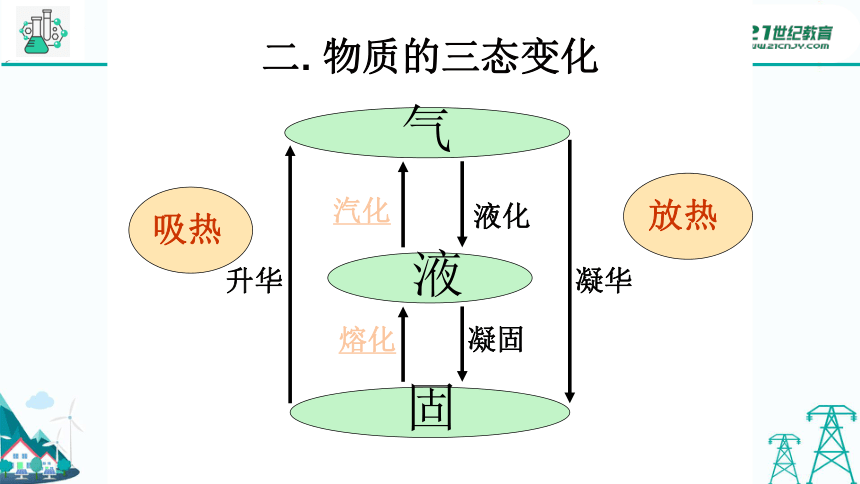
二. 物质的三态变化
固
气
液
熔化
汽化
凝固
液化
升华
凝华
吸热
放热
云
雪
露
雾
雨
霜
(液化)
(液化)
(液化)
(液化)
(凝华)
(凝华)
常见的自然现象
判断下列物态变化过程
1)夏天,打开冰棍纸看到“白气”;
2)洒在地上的水变干;
3)冬天,冰冻的衣服逐渐变干;
4)冬天的早晨,北方房屋玻璃窗内结冰花;
5)樟脑球过几个月消失了;
6)下雪不冷、化雪冷;
7)很冷的冬天,戴眼镜的人从室外走进温暖的室内,眼镜变模糊了
8)雾凇
9)结冰
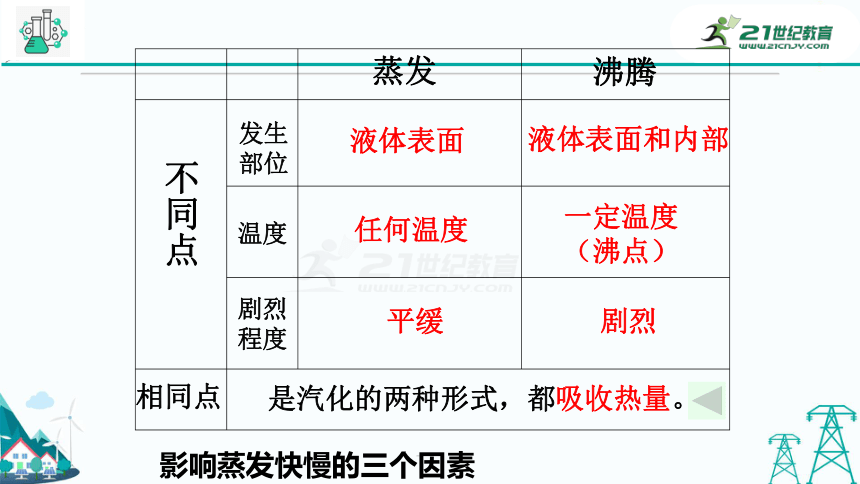
不同点
相同点
蒸发
沸腾
是汽化的两种形式,都吸收热量。
发生部位
温度
剧烈程度
液体表面
液体表面和内部
任何温度
一定温度
(沸点)
平缓
剧烈
影响蒸发快慢的三个因素
温度/℃
时间/分
0
2
4
6
8
10
12
14
40
45
50
55
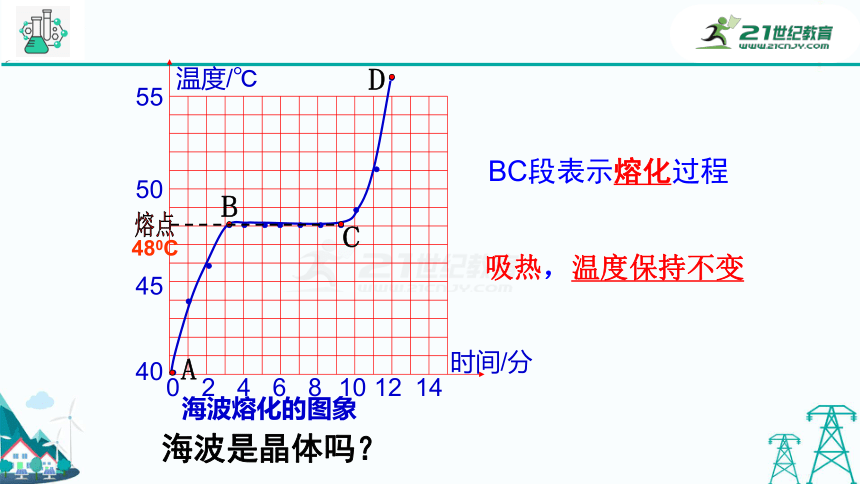
海波熔化的图象
A
B
C
D
BC段表示熔化过程
熔点
吸热,温度保持不变
480C
海波是晶体吗?
1.冰放入水中,一定熔化吗?
2.冰吸收热量,温度一定上升吗?
3.做冰熔化实验用碎冰块还是大冰块?快速加热还是缓慢加热?
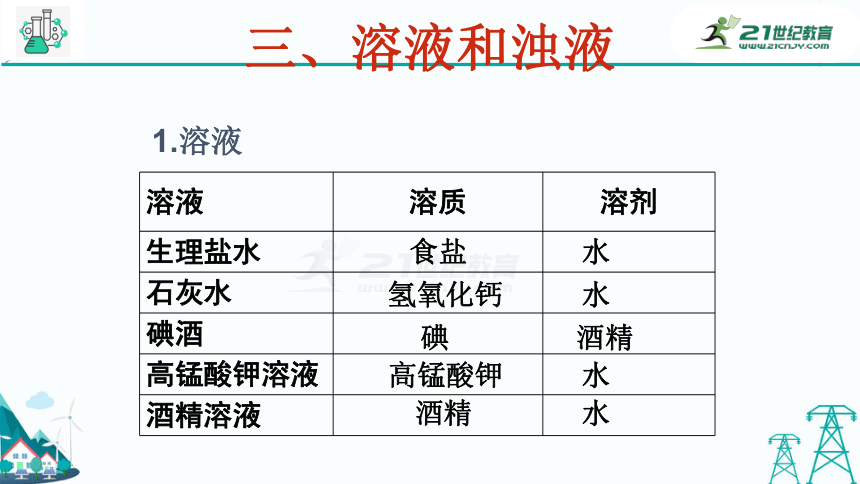
三、溶液和浊液
溶液 溶质 溶剂
生理盐水
石灰水
碘酒
高锰酸钾溶液
酒精溶液
食盐
碘
高锰酸钾
酒精
水
水
水
水
酒精
氢氧化钙
1.溶液
项目 溶液 悬浊液 乳浊液
溶解状态
物质状态
特点
久置
例子
溶
不溶
不溶
固体、液体、
气体 + 液体
固体+ 液体
液体+ 液体
均一、稳定
不均一、
不稳定
不均一、
不稳定
不分层
分层
分层
食盐水
泥水,
石灰浆
牛奶,
油水混合物
三、溶液和浊液
(1)溶液的溶质可以是固体、液体、气体。
溶剂不一定是水。
(2)同一种溶液中允许有多种溶质。
(3)溶液不一定是无色的。
(4)溶液的特点是:均一、稳定、混合物。
1.溶液
溶质的
名称 溶于水后的
温度变化 溶于水后的
吸\放热情况
氢氧化钠
氧化钙
浓硫酸
硝酸铵
氯化钙
温度升高
温度降低
放热
吸热
几乎不变
能量变化很小
2.溶液中溶质的溶解情况
判断:
1. 溶液一定是无色的。( )
2. 溶质一定是固体。( )
3. 均一、稳定的液体一定是溶液。( )
4. 溶液是均一、稳定的混合物。( )
5. 食盐溶液的全称是食盐的水溶液。( )
6. 溶剂一定是水。( )
7. 水是常用的溶剂。( )
√
×
×
×
×
√
√
8.溶液的体积等于溶剂和溶质体积之和( )
×
取用固体药品通常用( ),块状固体用( ),往试管里加固体粉末还可以用( )。
药匙
镊子
纸槽
3.溶解度:
在一定温度下,某固体物质在100克水中达到饱和状态时所溶解的质量。
20℃时,硝酸钾的溶解度是32克/100克水,表示的意义是:
①20℃时,32克硝酸钾溶解在100克水中恰好达到饱和状态。
②20℃时,100克水中最多只能溶解32克硝酸钾。
20 ℃时,20克水中放入9克食盐完全溶解,并恰好达到了饱和。求:20 ℃时,食盐的溶解度。
20℃时硝酸钾的溶解度是32克。求:20℃时100克水中放入100克的硝酸钾,溶液质量是多少?
算一算
(1)固体的溶解度—— 溶解度曲线
① 的溶解度随着温度
的升高而增大。
② 的溶解度随着温度
的升高而减小。
③ M点表示:
④T1℃时溶解度大小关系是
⑤T2℃时溶解度大小关系是
温度(℃)
溶解度(克)
A
B
C
T1
T2
a
b
M
A、B
在T1℃配成三种物质的饱和溶液升温至T2℃,比较溶质质量分数大小
C
T1℃时,A、B的溶解度相等。
A=B>C
A>B>C
影响气体溶解度的因素
想一想:为什么可乐瓶刚打开时会冒很多气泡?
气压越高,溶解度越大;
温度越高,溶解度越小。
(2)影响固体溶解度的因素
溶解度和溶解速度一样吗?
影响物质溶解速度的因素是:
水的温度;物质颗粒的大小;是否搅拌等。
溶解度:溶解物质的多少
溶解速度:溶解的快慢
影响物质溶解度的因素是:
溶质性质;溶剂性质;温度等。
不饱和 饱和
继续加入溶质、
恒温蒸发溶剂、
升温
饱和 不饱和
加入溶剂、
降温
4. 饱和溶液与不饱和溶液
饱和溶液不一定是浓溶液;
不饱和溶液也不一定是稀溶液。
思考:
1、要把硝酸钾的不饱和溶液变成饱和溶液,应该怎么做?
继续加入硝酸钾;恒温蒸发溶剂;降低温度。
继续加入氢氧化钙;恒温蒸发溶剂;升高温度。
2、要把氢氧化钙的不饱和溶液变成饱和溶液,应该怎么做?
1、冷却热饱和溶液
2、蒸发溶剂
结晶的方法
溶液浓稀的表示方法
-------溶液溶质的质量分数
溶液中溶质质量与溶液质量的比值
公式:
溶质的质量
溶液的质量
×100﹪
四、配制溶液
溶液溶质质量分数的意义:
溶质质量在溶液中所占的比例,溶质质量分数越大,溶液越浓。
例1:
请你判断下面两句话,是否正确?
①在100g溶剂里溶解了5g 溶质,则该溶液中溶质的质量分数为5% 。
②在100mL 的溶液中有5mL的溶质,则溶液中该溶质的质量分数为5% 。
某食盐溶液的溶质质量分数为5%,有什么含义?
1、50克5%的氯化钠溶液中,含有溶质氯化钠 克,水 克。
请 你完成:
思考:
需要配制50g 质量分数为5%的食盐溶液, 而实验室没有现成配制好的,要我们自己配制,该怎么做呢?
完成实验所需要的试剂:
食盐
蒸馏水
完成实验所需要的仪器:
烧杯
玻璃棒
天平、
量筒
配制一定溶质质量分数的溶液的步骤:
1、计算:
2、称量:
3、溶解:
思考:
2、用98%的浓硫酸(密度2g/cm3 )和水配制100克10%的稀硫酸,下列仪器中一般比需要使用的是( )
A、100毫升的量筒 B、天平
C、10毫升量筒 D、250毫升的烧杯
思考3:
3、用浓盐酸配制一定质量分数的稀盐酸,用量筒量取浓盐酸时,视线仰视读数;量水时,视线俯视,则所配的溶液的质量分数将( )
A、偏高 B、偏低
C、不变 D、无法判断
思考:
1、10g食盐溶于90g水中,求氯化钠溶液的溶质质量分数?
2、倒出一半上述溶液,剩余溶液的溶质质量分数?
3、剩下溶液加入100g的水,此时溶液的溶质质量分数?
4、向另一半中加入10g食盐,此时溶液的溶质质量分数?
5、要变为原溶液溶质质量分数的两倍,蒸发水多少?
思考:
20℃时,食盐溶液的溶解度为36g,求此温度下120克饱和食盐溶液的溶质质量分数?
1、怎样区分浓溶液和稀溶液?
2、溶液的浓和稀可以改变吗?
五、水的电解
装置、现象及原理
(1)阳极:氧气(使带火星的木条复燃)
阴极:氢气(点燃形成蓝色火焰,干燥烧杯内壁有水珠生成)
(2)体积比:V(氧气) : V(氢气 )= 1: 2
(3)原理:水 氢气 + 氧气
(4)结论:水由氢元素和氧元素组成
通直流电
六、水资源的利用和保护
1、水荒
地区分布不均匀
时间分配不均匀
水体污染 :
造成水体污染的原因
水体污染的危害
什么是富营养化污染
家庭节水:
1、一水多用
2、推广节水器具
3、少使用洗涤剂和清洁剂
讨论:在生活中我们该怎样节水?
在山区峡谷中一条河流,夏季经常洪水泛滥,而其他季节的流量很少.如何把夏季的洪水保存起来,并且免遭洪涝灾害呢?
在平原中有一条河流,水量充足,但是离河流较远的地区却缺少水源,如何解决这一问题?
有一家造纸厂排放污水非常严重,使工厂附近河流严重污染,应该采取哪些措施?
有一大片需水量很大的农作物需要灌溉,当地农民习惯开渠引水漫灌,结果有很多水白白流失.可以采取哪些灌溉措施以达到节约用水的目的?
大家都来说一说
举世瞩目的长江三峡工程
https://www.21cnjy.com/help/help_extract.php
七下第一章《水》复习
华师大版 初中
海洋占地球表面积的71%
一、地球上的水
1. 海洋水: 陆地水:
大气水和生物体内的水:极少量
可以说明大气中有水的现象:
不同生物体含水量不同,同一生物体各个部分含水量也不同
2. 咸水:97.5% 淡水:2.5%
3. 人类可利用的淡水存在于河流湖泊和沼泽土壤中,仅占地球全部淡水资源的0.3%
4. 人体的含水量约占体重的60%,
排出水的途径:排汗,排尿,呼吸
每天至少应饮水2~2.5L。
各种水的比例
清晨的露珠等
96.5%
3.5%
5、球上的水循环
(1). 图中字母表示的水循环环节: 书P7
A:降水 B:蒸发 C:水汽输送
D:蒸腾 E: 地表径流 F:地下径流
人可以改变哪些环节?
(2). 水循环的形成:
内因:水的温度不同,水的状态不同
外因:太阳辐射、重力
(3). 水循环类型:
小循环:①陆上内循环:陆地 — 大气
②海上内循环:海洋 — 大气
大循环:海陆间循环:海洋 — 陆地 — 大气
(4). 水循环的意义:
①水循环使地球上各水体之间相互联系,使水圈成为一个动态的系统;
②通过水循环,使海洋资源源源不断的向陆地供应淡水,滋润土地,哺育生命。
(5). 水循环时水的总量变吗?
二. 物质的三态变化
固
气
液
熔化
汽化
凝固
液化
升华
凝华
吸热
放热
云
雪
露
雾
雨
霜
(液化)
(液化)
(液化)
(液化)
(凝华)
(凝华)
常见的自然现象
判断下列物态变化过程
1)夏天,打开冰棍纸看到“白气”;
2)洒在地上的水变干;
3)冬天,冰冻的衣服逐渐变干;
4)冬天的早晨,北方房屋玻璃窗内结冰花;
5)樟脑球过几个月消失了;
6)下雪不冷、化雪冷;
7)很冷的冬天,戴眼镜的人从室外走进温暖的室内,眼镜变模糊了
8)雾凇
9)结冰
不同点
相同点
蒸发
沸腾
是汽化的两种形式,都吸收热量。
发生部位
温度
剧烈程度
液体表面
液体表面和内部
任何温度
一定温度
(沸点)
平缓
剧烈
影响蒸发快慢的三个因素
温度/℃
时间/分
0
2
4
6
8
10
12
14
40
45
50
55
海波熔化的图象
A
B
C
D
BC段表示熔化过程
熔点
吸热,温度保持不变
480C
海波是晶体吗?
1.冰放入水中,一定熔化吗?
2.冰吸收热量,温度一定上升吗?
3.做冰熔化实验用碎冰块还是大冰块?快速加热还是缓慢加热?
三、溶液和浊液
溶液 溶质 溶剂
生理盐水
石灰水
碘酒
高锰酸钾溶液
酒精溶液
食盐
碘
高锰酸钾
酒精
水
水
水
水
酒精
氢氧化钙
1.溶液
项目 溶液 悬浊液 乳浊液
溶解状态
物质状态
特点
久置
例子
溶
不溶
不溶
固体、液体、
气体 + 液体
固体+ 液体
液体+ 液体
均一、稳定
不均一、
不稳定
不均一、
不稳定
不分层
分层
分层
食盐水
泥水,
石灰浆
牛奶,
油水混合物
三、溶液和浊液
(1)溶液的溶质可以是固体、液体、气体。
溶剂不一定是水。
(2)同一种溶液中允许有多种溶质。
(3)溶液不一定是无色的。
(4)溶液的特点是:均一、稳定、混合物。
1.溶液
溶质的
名称 溶于水后的
温度变化 溶于水后的
吸\放热情况
氢氧化钠
氧化钙
浓硫酸
硝酸铵
氯化钙
温度升高
温度降低
放热
吸热
几乎不变
能量变化很小
2.溶液中溶质的溶解情况
判断:
1. 溶液一定是无色的。( )
2. 溶质一定是固体。( )
3. 均一、稳定的液体一定是溶液。( )
4. 溶液是均一、稳定的混合物。( )
5. 食盐溶液的全称是食盐的水溶液。( )
6. 溶剂一定是水。( )
7. 水是常用的溶剂。( )
√
×
×
×
×
√
√
8.溶液的体积等于溶剂和溶质体积之和( )
×
取用固体药品通常用( ),块状固体用( ),往试管里加固体粉末还可以用( )。
药匙
镊子
纸槽
3.溶解度:
在一定温度下,某固体物质在100克水中达到饱和状态时所溶解的质量。
20℃时,硝酸钾的溶解度是32克/100克水,表示的意义是:
①20℃时,32克硝酸钾溶解在100克水中恰好达到饱和状态。
②20℃时,100克水中最多只能溶解32克硝酸钾。
20 ℃时,20克水中放入9克食盐完全溶解,并恰好达到了饱和。求:20 ℃时,食盐的溶解度。
20℃时硝酸钾的溶解度是32克。求:20℃时100克水中放入100克的硝酸钾,溶液质量是多少?
算一算
(1)固体的溶解度—— 溶解度曲线
① 的溶解度随着温度
的升高而增大。
② 的溶解度随着温度
的升高而减小。
③ M点表示:
④T1℃时溶解度大小关系是
⑤T2℃时溶解度大小关系是
温度(℃)
溶解度(克)
A
B
C
T1
T2
a
b
M
A、B
在T1℃配成三种物质的饱和溶液升温至T2℃,比较溶质质量分数大小
C
T1℃时,A、B的溶解度相等。
A=B>C
A>B>C
影响气体溶解度的因素
想一想:为什么可乐瓶刚打开时会冒很多气泡?
气压越高,溶解度越大;
温度越高,溶解度越小。
(2)影响固体溶解度的因素
溶解度和溶解速度一样吗?
影响物质溶解速度的因素是:
水的温度;物质颗粒的大小;是否搅拌等。
溶解度:溶解物质的多少
溶解速度:溶解的快慢
影响物质溶解度的因素是:
溶质性质;溶剂性质;温度等。
不饱和 饱和
继续加入溶质、
恒温蒸发溶剂、
升温
饱和 不饱和
加入溶剂、
降温
4. 饱和溶液与不饱和溶液
饱和溶液不一定是浓溶液;
不饱和溶液也不一定是稀溶液。
思考:
1、要把硝酸钾的不饱和溶液变成饱和溶液,应该怎么做?
继续加入硝酸钾;恒温蒸发溶剂;降低温度。
继续加入氢氧化钙;恒温蒸发溶剂;升高温度。
2、要把氢氧化钙的不饱和溶液变成饱和溶液,应该怎么做?
1、冷却热饱和溶液
2、蒸发溶剂
结晶的方法
溶液浓稀的表示方法
-------溶液溶质的质量分数
溶液中溶质质量与溶液质量的比值
公式:
溶质的质量
溶液的质量
×100﹪
四、配制溶液
溶液溶质质量分数的意义:
溶质质量在溶液中所占的比例,溶质质量分数越大,溶液越浓。
例1:
请你判断下面两句话,是否正确?
①在100g溶剂里溶解了5g 溶质,则该溶液中溶质的质量分数为5% 。
②在100mL 的溶液中有5mL的溶质,则溶液中该溶质的质量分数为5% 。
某食盐溶液的溶质质量分数为5%,有什么含义?
1、50克5%的氯化钠溶液中,含有溶质氯化钠 克,水 克。
请 你完成:
思考:
需要配制50g 质量分数为5%的食盐溶液, 而实验室没有现成配制好的,要我们自己配制,该怎么做呢?
完成实验所需要的试剂:
食盐
蒸馏水
完成实验所需要的仪器:
烧杯
玻璃棒
天平、
量筒
配制一定溶质质量分数的溶液的步骤:
1、计算:
2、称量:
3、溶解:
思考:
2、用98%的浓硫酸(密度2g/cm3 )和水配制100克10%的稀硫酸,下列仪器中一般比需要使用的是( )
A、100毫升的量筒 B、天平
C、10毫升量筒 D、250毫升的烧杯
思考3:
3、用浓盐酸配制一定质量分数的稀盐酸,用量筒量取浓盐酸时,视线仰视读数;量水时,视线俯视,则所配的溶液的质量分数将( )
A、偏高 B、偏低
C、不变 D、无法判断
思考:
1、10g食盐溶于90g水中,求氯化钠溶液的溶质质量分数?
2、倒出一半上述溶液,剩余溶液的溶质质量分数?
3、剩下溶液加入100g的水,此时溶液的溶质质量分数?
4、向另一半中加入10g食盐,此时溶液的溶质质量分数?
5、要变为原溶液溶质质量分数的两倍,蒸发水多少?
思考:
20℃时,食盐溶液的溶解度为36g,求此温度下120克饱和食盐溶液的溶质质量分数?
1、怎样区分浓溶液和稀溶液?
2、溶液的浓和稀可以改变吗?
五、水的电解
装置、现象及原理
(1)阳极:氧气(使带火星的木条复燃)
阴极:氢气(点燃形成蓝色火焰,干燥烧杯内壁有水珠生成)
(2)体积比:V(氧气) : V(氢气 )= 1: 2
(3)原理:水 氢气 + 氧气
(4)结论:水由氢元素和氧元素组成
通直流电
六、水资源的利用和保护
1、水荒
地区分布不均匀
时间分配不均匀
水体污染 :
造成水体污染的原因
水体污染的危害
什么是富营养化污染
家庭节水:
1、一水多用
2、推广节水器具
3、少使用洗涤剂和清洁剂
讨论:在生活中我们该怎样节水?
在山区峡谷中一条河流,夏季经常洪水泛滥,而其他季节的流量很少.如何把夏季的洪水保存起来,并且免遭洪涝灾害呢?
在平原中有一条河流,水量充足,但是离河流较远的地区却缺少水源,如何解决这一问题?
有一家造纸厂排放污水非常严重,使工厂附近河流严重污染,应该采取哪些措施?
有一大片需水量很大的农作物需要灌溉,当地农民习惯开渠引水漫灌,结果有很多水白白流失.可以采取哪些灌溉措施以达到节约用水的目的?
大家都来说一说
举世瞩目的长江三峡工程
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
