鲁科版高中化学高二选修《物质结构与性质》第3节离子键、配位键与金属键第1课时 离子键学案(共22张PPT)
文档属性
| 名称 | 鲁科版高中化学高二选修《物质结构与性质》第3节离子键、配位键与金属键第1课时 离子键学案(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 552.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-23 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第1课时 离子键
鲁科版高中化学高二选修《物质结构与性质》第2章第3节离子键、配位键与金属键第2课时配位键与金属键
键型 离子键
定义
成键微粒
成键方式
成键元素
存在物质
实例
阴阳离子间通过静电作用形成的化学键
阴、阳离子
活泼的金属元素原子与
活泼的非金属元素原子
通过得失电子达到稳定结构
大部分盐、活泼金属氧化物、强碱
NaCl、 NH4Cl 、 NaOH 、 MgO 、 Na2O2等
特例:铵盐NH4Cl
特例:AlCl3
复习1
复习2
1. 化学键的实质就是成键原子之间的_____作用。
2. 共价键的形成条件:
成键原子所属元素电负性差别_____;
当差别为0时,形成的共价键就是 _______键。
电负性差值越大,形成的共价键的_____越强;当差值很大时(大于1.7以上),就认为是_____键。
电性
较小
非极性
极性
离子
核心素养
1.认识离子键的实质,并能结合具体实例说明
离子键的形成过程。
2.知道成键原子所属元素电负性差值较大通常
形成离子键。
3.认识离子键的特征:没有方向性和饱和性。
重点:离子键的实质、形成过程
难点:离子键的特征——没有方向性和饱和性
重 难 点
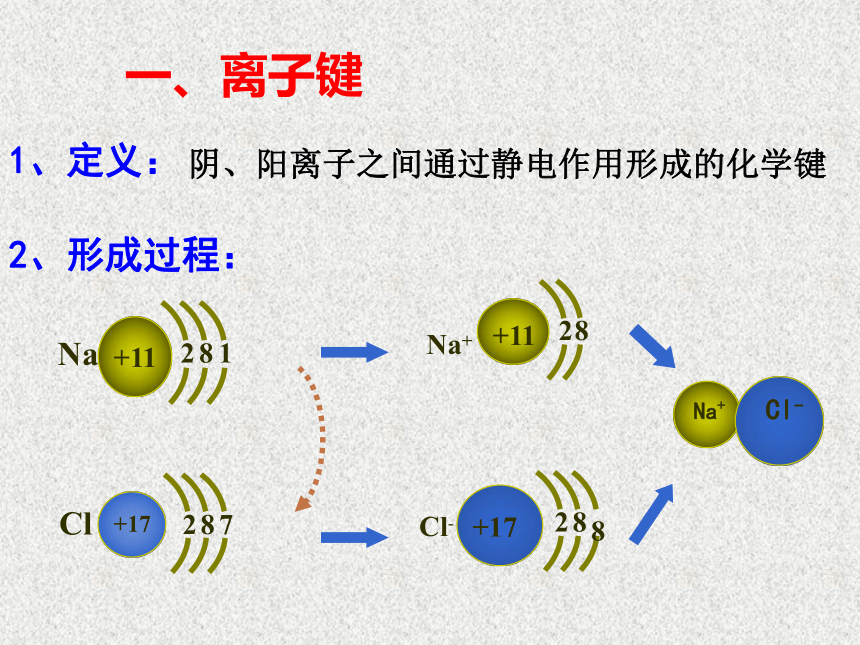
一、离子键
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
1、定义:
阴、阳离子之间通过静电作用形成的化学键Zxxk
2、形成过程:
5、成键微粒:阴阳离子
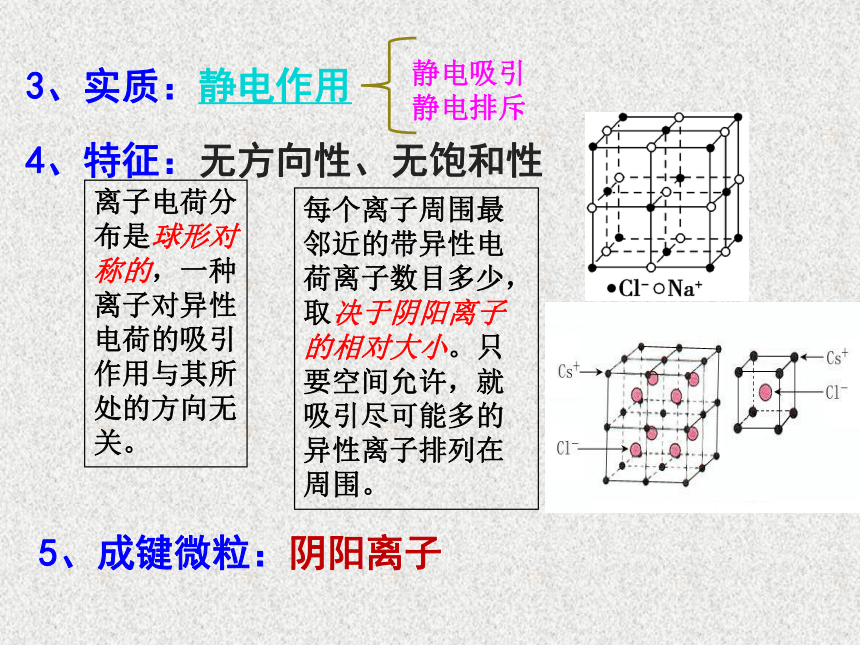
3、实质:静电作用
4、特征:无方向性、无饱和性
静电吸引
静电排斥
离子电荷分布是球形对称的,一种离子对异性电荷的吸引作用与其所处的方向无关。
每个离子周围最邻近的带异性电荷离子数目多少,取决于阴阳离子的相对大小。只要空间允许,就吸引尽可能多的异性离子排列在周围。
6 、形成条件:
活泼的金属与活泼的非金属元素之间电负性差值
(△X 〉1.7)
下列各数值表示有关元素的原子序数, 其所 表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C.11与17 D.6与14
针对练习1
C
怎样理解离子键的实质?
提示 离子键的实质是静电作用,它包括阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态,从而形成了稳定的离子化合物。
【思考】
1. 形成离子键的微粒一定含有金属元素吗?含有金属元素的化合物一定存在离子键吗?
【提示】 都不一定。如NH4Cl中只有非金属元素,但其含有离子键;AlCl3中含有金属元素,但不含离子键。
2.离子化合物溶于水或熔化时离子键是否发生变化?
【提示】转化成自由移动的离子,离子键即被破坏。
3.如何用实验来判断一种物质是离子化合物?
【提示】熔融状态下是否导电
深度思考:
[思考与讨论]
由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系?
(提示:Ca2+半径略大于Na+半径)
离子化合物 NaF NaCl NaBr NaI
熔点 988℃ 801℃ 740℃ 660℃
离子化合物 NaF CaF2 CaO
熔点 988℃ 1360℃ 2614℃
离子半径同,离子电荷越大,熔点越高,离子键越强
离子电荷数同,离子半径越大,熔点越低,离子键越弱
7、离子键强弱的判断:
影响因素:离子电荷和离子半径
规律:
离子半径越 、离子带电荷越 ,离子键就越 。离子键越强,破坏它所需能量就越 。
小
多
强
大
(F=kq+q-/r2 )
2.下列离子键最强的是 ( )
A、 KCl B 、CaCl2
C、 MgO D、 Na2O
C
针对练习2
解析:离子键的强弱与离子本身所带电荷的多少及半径有关,半径越小,离子键越强,离子所带电荷越多,离子键越强,在所给阳离子中,Mg2+带两个正电荷,且半径最小,在阴离子中O2-带两个单位的负电荷,且半径比Cl-小,所以离子键最强的是MgO.
离子及离子化合物 的电子式
(1)阳离子的表示:
(2)阴离子的表示:
8、用电子式表示离子键的形成过程
(3)离子化合物的表示:
Na+ Mg2+
AB型
AB2型
A2B型
Na×
+
`
Na+
Cl
× ×
× ×
[ ]-
× ×
× ×
Cl
× ×
×
× ×
××
S
K
K
S
2
-
K+
K+
1.方法:原子A的电子式 + 原子B的电子式→化合物的电子式
2.不能把“→”写成“=”。
3.在箭号右边,不能把相同离子归在一起。
注
意
离子键的形成过程
2、用电子式表示溴化镁的形成过程
1、用电子式表示氧化镁的形成过程
· Mg ·
+
· O ·
··
··
→
Mg2+
[ O ]2-
··
··
:
:
学以致用
本节小结
阴离子Nn-
阳离子Mm+
用电子式表示
离子化合物
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
静电作用
静电吸引=静电排斥
离 子 键 影响因素
①离子半径 ②离子电荷
离子键:阴、阳离子间通过静电作用所形成的化学键.
Cl
Mg
Cl
Mg
2
Cl
Cl
例
本节小结
离子键与共价键的比较
键型 离子键 共价键
概念 阴、阳离子之间通过静电作用形成的化学键 原子间通过共用电子对形成的化学键
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
成键粒子 阴、阳离子 原子
成键性质 静电作用 静电作用
形成条件 活泼金属元素与活泼非金属元素化合时形成离子键 同种或不同种非金属元素化合时形成共价键(稀有气体元素除外)
特征 没有饱和性和方向性 有饱和性和方向性
存在 离子化合物 绝大多数非金属单质、共价化合物、某些离子化合物
表示方法 电子式,如
离子键的形成过程: ①结构式,如H—Cl
②电子式,如
共价键的形成过程:
1. 下列关于离子键特征的叙述中,正确的是( )
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无
关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律
的,随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个
带异性电荷的离子
A
基础过关
2. 下列叙述错误的是( )
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属元素形成的化合物中也可能含有离子键
解析:离子键是阴、阳离子间强烈的相互作用,不只是吸引;成键原子所属元素的电负性差值大于1.7时才能形成离子键。
基础过关
A
3.具有下列电子排布的原子中最难形成离子键的是
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
A
4. NaF、KI、MgO均为离子化合物,现有下列数据,
据此判断这三种化合物熔点高低的顺序( )
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
物质 ①NaF ②KI ③MgO
离子电荷数 1 1 2
核间距(10-10 m ) 2.31 3.48 2.10
解析:离子化合物中,离子所带电荷数越多、半径越小,离子键越强,其熔、沸点就越高。因为r(F-)B
能力提升
书写下列物质的电子式(并用电子式表示出(3)的形成过程):
(1) H2、O2、N2、Cl2
(2) HF、H2O、 H2O2 、NH3 、N2H4 、
CH4、C2H4 、C2H2 、CCl4
CO2 、HClO
(3) KCl 、MgO、NH4Cl 、NaOH、
CaCl2 、 MgBr2
Na2O、 Na2O2、 K2S
第1课时 离子键
鲁科版高中化学高二选修《物质结构与性质》第2章第3节离子键、配位键与金属键第2课时配位键与金属键
键型 离子键
定义
成键微粒
成键方式
成键元素
存在物质
实例
阴阳离子间通过静电作用形成的化学键
阴、阳离子
活泼的金属元素原子与
活泼的非金属元素原子
通过得失电子达到稳定结构
大部分盐、活泼金属氧化物、强碱
NaCl、 NH4Cl 、 NaOH 、 MgO 、 Na2O2等
特例:铵盐NH4Cl
特例:AlCl3
复习1
复习2
1. 化学键的实质就是成键原子之间的_____作用。
2. 共价键的形成条件:
成键原子所属元素电负性差别_____;
当差别为0时,形成的共价键就是 _______键。
电负性差值越大,形成的共价键的_____越强;当差值很大时(大于1.7以上),就认为是_____键。
电性
较小
非极性
极性
离子
核心素养
1.认识离子键的实质,并能结合具体实例说明
离子键的形成过程。
2.知道成键原子所属元素电负性差值较大通常
形成离子键。
3.认识离子键的特征:没有方向性和饱和性。
重点:离子键的实质、形成过程
难点:离子键的特征——没有方向性和饱和性
重 难 点
一、离子键
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
1、定义:
阴、阳离子之间通过静电作用形成的化学键Zxxk
2、形成过程:
5、成键微粒:阴阳离子
3、实质:静电作用
4、特征:无方向性、无饱和性
静电吸引
静电排斥
离子电荷分布是球形对称的,一种离子对异性电荷的吸引作用与其所处的方向无关。
每个离子周围最邻近的带异性电荷离子数目多少,取决于阴阳离子的相对大小。只要空间允许,就吸引尽可能多的异性离子排列在周围。
6 、形成条件:
活泼的金属与活泼的非金属元素之间电负性差值
(△X 〉1.7)
下列各数值表示有关元素的原子序数, 其所 表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C.11与17 D.6与14
针对练习1
C
怎样理解离子键的实质?
提示 离子键的实质是静电作用,它包括阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态,从而形成了稳定的离子化合物。
【思考】
1. 形成离子键的微粒一定含有金属元素吗?含有金属元素的化合物一定存在离子键吗?
【提示】 都不一定。如NH4Cl中只有非金属元素,但其含有离子键;AlCl3中含有金属元素,但不含离子键。
2.离子化合物溶于水或熔化时离子键是否发生变化?
【提示】转化成自由移动的离子,离子键即被破坏。
3.如何用实验来判断一种物质是离子化合物?
【提示】熔融状态下是否导电
深度思考:
[思考与讨论]
由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系?
(提示:Ca2+半径略大于Na+半径)
离子化合物 NaF NaCl NaBr NaI
熔点 988℃ 801℃ 740℃ 660℃
离子化合物 NaF CaF2 CaO
熔点 988℃ 1360℃ 2614℃
离子半径同,离子电荷越大,熔点越高,离子键越强
离子电荷数同,离子半径越大,熔点越低,离子键越弱
7、离子键强弱的判断:
影响因素:离子电荷和离子半径
规律:
离子半径越 、离子带电荷越 ,离子键就越 。离子键越强,破坏它所需能量就越 。
小
多
强
大
(F=kq+q-/r2 )
2.下列离子键最强的是 ( )
A、 KCl B 、CaCl2
C、 MgO D、 Na2O
C
针对练习2
解析:离子键的强弱与离子本身所带电荷的多少及半径有关,半径越小,离子键越强,离子所带电荷越多,离子键越强,在所给阳离子中,Mg2+带两个正电荷,且半径最小,在阴离子中O2-带两个单位的负电荷,且半径比Cl-小,所以离子键最强的是MgO.
离子及离子化合物 的电子式
(1)阳离子的表示:
(2)阴离子的表示:
8、用电子式表示离子键的形成过程
(3)离子化合物的表示:
Na+ Mg2+
AB型
AB2型
A2B型
Na×
+
`
Na+
Cl
× ×
× ×
[ ]-
× ×
× ×
Cl
× ×
×
× ×
××
S
K
K
S
2
-
K+
K+
1.方法:原子A的电子式 + 原子B的电子式→化合物的电子式
2.不能把“→”写成“=”。
3.在箭号右边,不能把相同离子归在一起。
注
意
离子键的形成过程
2、用电子式表示溴化镁的形成过程
1、用电子式表示氧化镁的形成过程
· Mg ·
+
· O ·
··
··
→
Mg2+
[ O ]2-
··
··
:
:
学以致用
本节小结
阴离子Nn-
阳离子Mm+
用电子式表示
离子化合物
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
静电作用
静电吸引=静电排斥
离 子 键 影响因素
①离子半径 ②离子电荷
离子键:阴、阳离子间通过静电作用所形成的化学键.
Cl
Mg
Cl
Mg
2
Cl
Cl
例
本节小结
离子键与共价键的比较
键型 离子键 共价键
概念 阴、阳离子之间通过静电作用形成的化学键 原子间通过共用电子对形成的化学键
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
成键粒子 阴、阳离子 原子
成键性质 静电作用 静电作用
形成条件 活泼金属元素与活泼非金属元素化合时形成离子键 同种或不同种非金属元素化合时形成共价键(稀有气体元素除外)
特征 没有饱和性和方向性 有饱和性和方向性
存在 离子化合物 绝大多数非金属单质、共价化合物、某些离子化合物
表示方法 电子式,如
离子键的形成过程: ①结构式,如H—Cl
②电子式,如
共价键的形成过程:
1. 下列关于离子键特征的叙述中,正确的是( )
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无
关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律
的,随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个
带异性电荷的离子
A
基础过关
2. 下列叙述错误的是( )
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属元素形成的化合物中也可能含有离子键
解析:离子键是阴、阳离子间强烈的相互作用,不只是吸引;成键原子所属元素的电负性差值大于1.7时才能形成离子键。
基础过关
A
3.具有下列电子排布的原子中最难形成离子键的是
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
A
4. NaF、KI、MgO均为离子化合物,现有下列数据,
据此判断这三种化合物熔点高低的顺序( )
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
物质 ①NaF ②KI ③MgO
离子电荷数 1 1 2
核间距(10-10 m ) 2.31 3.48 2.10
解析:离子化合物中,离子所带电荷数越多、半径越小,离子键越强,其熔、沸点就越高。因为r(F-)
能力提升
书写下列物质的电子式(并用电子式表示出(3)的形成过程):
(1) H2、O2、N2、Cl2
(2) HF、H2O、 H2O2 、NH3 、N2H4 、
CH4、C2H4 、C2H2 、CCl4
CO2 、HClO
(3) KCl 、MgO、NH4Cl 、NaOH、
CaCl2 、 MgBr2
Na2O、 Na2O2、 K2S
