人教版高一化学必修一3.2.1几种重要的金属化合物---《钠和钠的化合物》课件(共31张PPT)
文档属性
| 名称 | 人教版高一化学必修一3.2.1几种重要的金属化合物---《钠和钠的化合物》课件(共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 880.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-23 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
第二节 几种重要的金属化合物
第一课时 钠的化合物
?已有知识储备
钠的化合物有很多,用途也很广泛.在初中已过NaOH和NaCl,其中NaCl是食盐中的主要成分。
在一定条件下钠跟氧气可以分别生成氧化钠和过氧化钠。
4Na +O2 === 2Na2O (白色)
常温
2 Na +O2 Na2O2 (淡黄色)
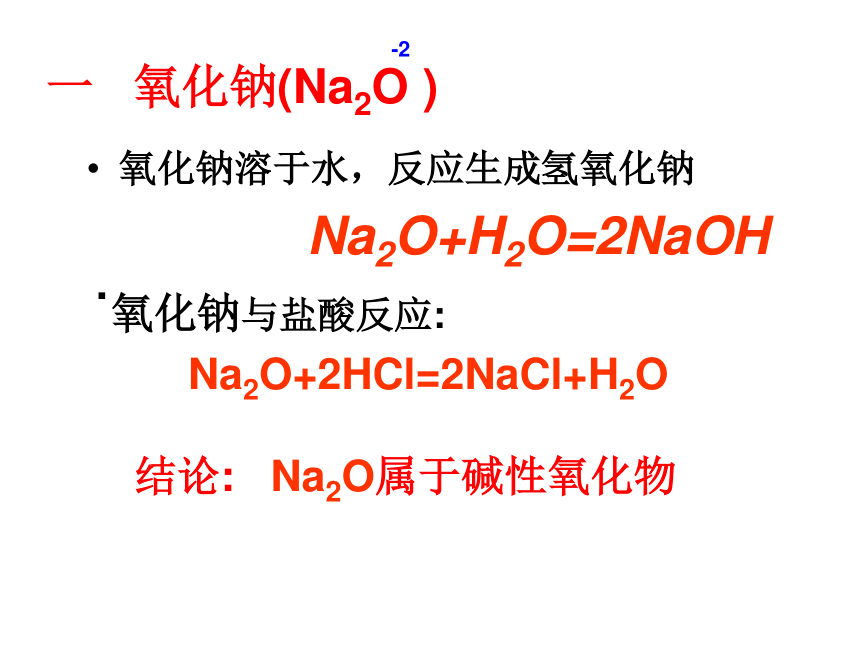
Na2O+H2O=2NaOH
氧化钠溶于水,反应生成氢氧化钠
Na2O+2HCl=2NaCl+H2O
.氧化钠与盐酸反应:
一 氧化钠(Na2O )
结论: Na2O属于碱性氧化物
-2
二 过氧化钠 (Na2O2)
颜色:淡黄色
状态:粉末状固体
钠的另一个含氧化合物——Na2O与水发生化学反应,已经是属于Na2O的化学性质。
Na2O2是否也会表现出类似的性质呢?
退 出
过氧化钠的物理性质
-1
实验3-5
把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管处壁,有什么感觉?然后向反应后的溶液滴入酚酞溶液,有什么现象发生?振荡后又有什么现象?
现象:产生大量气泡;带火星的木条复燃;试管发热;溶液颜色变红,后红色有退去。
Na2O2 + 2H2O = 2NaOH + H2O2 ①
①×2 + ② 得
-1
-1
-2
-2
-1
-2
0
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2H2O2 = 2H2O + O2 ↑ ②
过氧化钠的化学性质
反应生成有O2;
反应放热;
反应生成 NaOH;
Na2O2具有漂白性;
(2)实验结论:
1、试管中发生剧烈反应, 产生大量无色气泡,且此气体能使带火星木条复燃;
2、试管发烫;
3、无色酚酞变红;
4、振荡后红色褪去;
实验现象 结论
Na2O2的用途:
在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂,氧化剂。
2Na2O2 + 2CO2 = 2Na2CO3 + O2
练习:写出过氧化钠与盐酸反应的化学方程式:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
Na2O2 + 2HCl = 2NaCl + H2O2 ①
2H2O2 = 2H2O + O2 ↑ ②
Na2O2不是碱性氧化物
例.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,可观察到的现象为( )
A 溶液仍为紫色
B 溶液最终变为蓝色
C 最终溶液褪色,无其他现象
D 有气泡产生,溶液最终为无色
D
[思考]
???1.根据Na2O2性质,想一想Na2O2应如何保存?
?2.把Na2O2投入到FeSO4溶液中,会观察到哪些现象? 为什么?
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
请思考:
三 碳酸钠和碳酸氢钠
俗 名
纯碱或苏打
小苏打
Na2CO3.10H2O
——
Na2CO3 NaHCO3
俗 名
结晶水合物
思考:
通过滴加酚酞的对比实验,能说明一个什么问题?
Na2CO3
NaHCO3
Na2CO3和NaHCO3在水中的溶解性
Na2CO3和NaHCO3在水中的溶解性 __总结
仍有固体残留
溶液变微红色
白色粉未,加水结块成晶体,放热
白色粉未,加水部分溶解,感受不到热量变化
振荡长时间可溶解
溶液变红色
加水先变成含结晶水的晶体,溶解度大,溶液的碱性比NaHCO3强
加水部分溶解,溶解度相对较小,溶液的碱性比Na2CO3弱
初步结论
步骤 Na2CO3 NaHCO3
①
②
③
(1)Na2CO3和NaHCO3的热稳定性
化学性质
热稳定性
现象:
1号试管: 澄 清石灰水变浑浊
2号试管: 澄 清石灰水不变浑浊
② Na2CO3 稳定, 受热不分解
① NaHCO3不稳定,受热可分解
结论:
2NaHCO3===Na2CO3+H2O+CO2
总结 : 热稳定性:Na2CO3 > NaHCO3
应用: 此性质可鉴别NaHCO3固体和Na2CO3固体
(2)与 酸 反 应
与酸反应
化学性质
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧裂
为什么?
结论:
Na2CO3
NaHCO3
总结
Na2CO3
NaHCO3
小苏打
纯碱 苏打
易溶(比NaHCO3易溶)
可溶
较强
较弱
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
稳定,加热难分解
不稳定,加热可分解
热稳定性
Na2CO3+HCl=NaHCO3+NaCl
与酸反应
与某些碱反应
Na2CO3+ Ca(OH)2=CaCO3
+2NaOH
NaHCO3+NaOH=Na2CO3+H2O
俗 名
水溶性
溶液碱性
续表
Na2CO3 NaHCO3
与氯化钡的反应 Na2CO3+BaCl2=
BaCO3 +2NaCl
〖讨 论〗
1、如何除去Na2CO3中少量的NaHCO3?
2、如何鉴别Na2CO3和NaHCO3固体?
用 途
制玻璃
制皂
造纸
纺织等
发酵剂
灭火剂等
Na2CO3
NaHCO3
制药
请思考:
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
3.焰色反应
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
[实验3—6] 用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。
⑴ 点燃酒精灯(最好用煤气灯,火焰颜色较浅)
操
作
⑵ 铂丝在酒精灯上灼烧至火焰呈原色
⑶ 铂丝蘸取固体或溶液灼烧,观察。
若是钾元素,应透过蓝色钴玻璃,
⑷ 铂丝用稀盐酸洗净,在火焰上灼烧至原色。
(能不能用稀硫酸?)
滤去遮盖紫色的黄光。
问题
1.铂丝为什么要用盐酸洗涤?
2.为什么要用蓝色钴玻璃观察钾的焰色?
观察钾的焰色反应为什么需透过蓝色的钴玻璃?
??? 因为在钾的化合物中往往混有一些钠的化合物(不易分离),在进行焰色反应时,由于钠元素的存在(焰色反应呈黄色)干扰了钾的焰色反应(紫色)的观察,必须把黄色的光滤去,由光的互补色原理可知,黄色与蓝色互为互补色,用蓝色的钴玻璃可将黄色的光滤去,即可清楚地观察到钾的焰色------紫色。
焰色反应的说明:
1.焰色反应是物理变化,不是化学变化。
本质是电子的跃迁而产生
2.并非所有金属都有焰色(Pt、Fe、Al、Ni、 Cr、W等就没有)
注意:1、选择金属丝时,应选择焰色较浅的铂丝或铁丝。
2、灼烧时,应选择火焰颜色较浅的煤气灯或酒精灯。
一些金属及化合物的焰色反应
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
节日燃放的五彩缤纷的烟花,就是碱金属,以及锶、钡等金属化合物所呈现的各种艳丽的色彩。
1. 下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
练习
√
2.下列说法中不正确的是( )
A、Na2CO3比NaHCO3 易溶于水
B、Na2CO3比NaHCO3稳定
C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D、物质的量相等的Na2CO3和NaHCO3分别与盐酸反应得CO2的物质的量之比为2︰1
3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A、加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水
√
√
4.有关Na2CO3和NaHCO3的性质,下列叙述错误的是( )
A、等质量的Na2CO3和NaHCO3与足量的盐酸反应,在相同的条件下NaHCO3产生的CO2气体体积大
B、同一温度下,与等浓度的盐酸反应时,NaHCO3比Na2CO3剧烈
C、与同种酸反应生成等量的CO2时,所消耗的酸的量相等
D、将石灰水加入到NaHCO3溶液中将会产生沉淀
√
第二节 几种重要的金属化合物
第一课时 钠的化合物
?已有知识储备
钠的化合物有很多,用途也很广泛.在初中已过NaOH和NaCl,其中NaCl是食盐中的主要成分。
在一定条件下钠跟氧气可以分别生成氧化钠和过氧化钠。
4Na +O2 === 2Na2O (白色)
常温
2 Na +O2 Na2O2 (淡黄色)
Na2O+H2O=2NaOH
氧化钠溶于水,反应生成氢氧化钠
Na2O+2HCl=2NaCl+H2O
.氧化钠与盐酸反应:
一 氧化钠(Na2O )
结论: Na2O属于碱性氧化物
-2
二 过氧化钠 (Na2O2)
颜色:淡黄色
状态:粉末状固体
钠的另一个含氧化合物——Na2O与水发生化学反应,已经是属于Na2O的化学性质。
Na2O2是否也会表现出类似的性质呢?
退 出
过氧化钠的物理性质
-1
实验3-5
把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管处壁,有什么感觉?然后向反应后的溶液滴入酚酞溶液,有什么现象发生?振荡后又有什么现象?
现象:产生大量气泡;带火星的木条复燃;试管发热;溶液颜色变红,后红色有退去。
Na2O2 + 2H2O = 2NaOH + H2O2 ①
①×2 + ② 得
-1
-1
-2
-2
-1
-2
0
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2H2O2 = 2H2O + O2 ↑ ②
过氧化钠的化学性质
反应生成有O2;
反应放热;
反应生成 NaOH;
Na2O2具有漂白性;
(2)实验结论:
1、试管中发生剧烈反应, 产生大量无色气泡,且此气体能使带火星木条复燃;
2、试管发烫;
3、无色酚酞变红;
4、振荡后红色褪去;
实验现象 结论
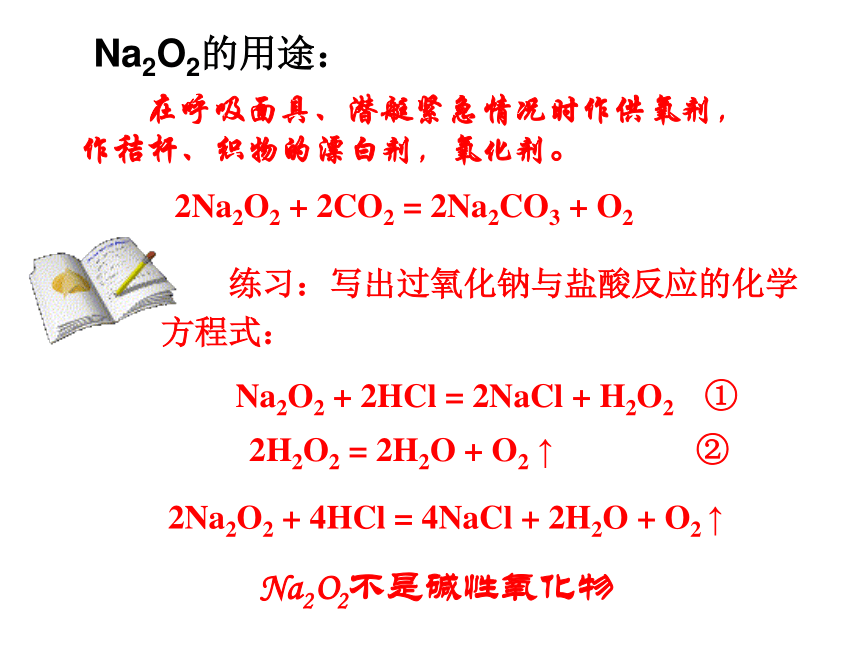
Na2O2的用途:
在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂,氧化剂。
2Na2O2 + 2CO2 = 2Na2CO3 + O2
练习:写出过氧化钠与盐酸反应的化学方程式:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
Na2O2 + 2HCl = 2NaCl + H2O2 ①
2H2O2 = 2H2O + O2 ↑ ②
Na2O2不是碱性氧化物
例.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,可观察到的现象为( )
A 溶液仍为紫色
B 溶液最终变为蓝色
C 最终溶液褪色,无其他现象
D 有气泡产生,溶液最终为无色
D
[思考]
???1.根据Na2O2性质,想一想Na2O2应如何保存?
?2.把Na2O2投入到FeSO4溶液中,会观察到哪些现象? 为什么?
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
请思考:
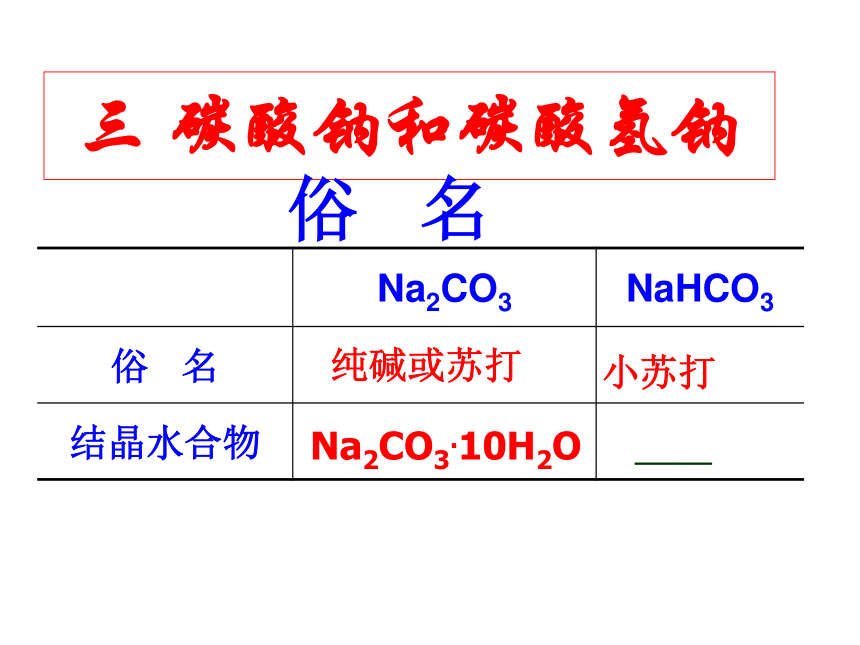
三 碳酸钠和碳酸氢钠
俗 名
纯碱或苏打
小苏打
Na2CO3.10H2O
——
Na2CO3 NaHCO3
俗 名
结晶水合物
思考:
通过滴加酚酞的对比实验,能说明一个什么问题?
Na2CO3
NaHCO3
Na2CO3和NaHCO3在水中的溶解性
Na2CO3和NaHCO3在水中的溶解性 __总结
仍有固体残留
溶液变微红色
白色粉未,加水结块成晶体,放热
白色粉未,加水部分溶解,感受不到热量变化
振荡长时间可溶解
溶液变红色
加水先变成含结晶水的晶体,溶解度大,溶液的碱性比NaHCO3强
加水部分溶解,溶解度相对较小,溶液的碱性比Na2CO3弱
初步结论
步骤 Na2CO3 NaHCO3
①
②
③
(1)Na2CO3和NaHCO3的热稳定性
化学性质
热稳定性
现象:
1号试管: 澄 清石灰水变浑浊
2号试管: 澄 清石灰水不变浑浊
② Na2CO3 稳定, 受热不分解
① NaHCO3不稳定,受热可分解
结论:
2NaHCO3===Na2CO3+H2O+CO2
总结 : 热稳定性:Na2CO3 > NaHCO3
应用: 此性质可鉴别NaHCO3固体和Na2CO3固体
(2)与 酸 反 应
与酸反应
化学性质
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧裂
为什么?
结论:
Na2CO3
NaHCO3
总结
Na2CO3
NaHCO3
小苏打
纯碱 苏打
易溶(比NaHCO3易溶)
可溶
较强
较弱
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
稳定,加热难分解
不稳定,加热可分解
热稳定性
Na2CO3+HCl=NaHCO3+NaCl
与酸反应
与某些碱反应
Na2CO3+ Ca(OH)2=CaCO3
+2NaOH
NaHCO3+NaOH=Na2CO3+H2O
俗 名
水溶性
溶液碱性
续表
Na2CO3 NaHCO3
与氯化钡的反应 Na2CO3+BaCl2=
BaCO3 +2NaCl
〖讨 论〗
1、如何除去Na2CO3中少量的NaHCO3?
2、如何鉴别Na2CO3和NaHCO3固体?
用 途
制玻璃
制皂
造纸
纺织等
发酵剂
灭火剂等
Na2CO3
NaHCO3
制药
请思考:
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
3.焰色反应
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
[实验3—6] 用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。
⑴ 点燃酒精灯(最好用煤气灯,火焰颜色较浅)
操
作
⑵ 铂丝在酒精灯上灼烧至火焰呈原色
⑶ 铂丝蘸取固体或溶液灼烧,观察。
若是钾元素,应透过蓝色钴玻璃,
⑷ 铂丝用稀盐酸洗净,在火焰上灼烧至原色。
(能不能用稀硫酸?)
滤去遮盖紫色的黄光。
问题
1.铂丝为什么要用盐酸洗涤?
2.为什么要用蓝色钴玻璃观察钾的焰色?
观察钾的焰色反应为什么需透过蓝色的钴玻璃?
??? 因为在钾的化合物中往往混有一些钠的化合物(不易分离),在进行焰色反应时,由于钠元素的存在(焰色反应呈黄色)干扰了钾的焰色反应(紫色)的观察,必须把黄色的光滤去,由光的互补色原理可知,黄色与蓝色互为互补色,用蓝色的钴玻璃可将黄色的光滤去,即可清楚地观察到钾的焰色------紫色。
焰色反应的说明:
1.焰色反应是物理变化,不是化学变化。
本质是电子的跃迁而产生
2.并非所有金属都有焰色(Pt、Fe、Al、Ni、 Cr、W等就没有)
注意:1、选择金属丝时,应选择焰色较浅的铂丝或铁丝。
2、灼烧时,应选择火焰颜色较浅的煤气灯或酒精灯。
一些金属及化合物的焰色反应
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
节日燃放的五彩缤纷的烟花,就是碱金属,以及锶、钡等金属化合物所呈现的各种艳丽的色彩。
1. 下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
练习
√
2.下列说法中不正确的是( )
A、Na2CO3比NaHCO3 易溶于水
B、Na2CO3比NaHCO3稳定
C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D、物质的量相等的Na2CO3和NaHCO3分别与盐酸反应得CO2的物质的量之比为2︰1
3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A、加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水
√
√
4.有关Na2CO3和NaHCO3的性质,下列叙述错误的是( )
A、等质量的Na2CO3和NaHCO3与足量的盐酸反应,在相同的条件下NaHCO3产生的CO2气体体积大
B、同一温度下,与等浓度的盐酸反应时,NaHCO3比Na2CO3剧烈
C、与同种酸反应生成等量的CO2时,所消耗的酸的量相等
D、将石灰水加入到NaHCO3溶液中将会产生沉淀
√
