北京版九年级化学下册 第9章《第二节 溶液组成的定量表示》课件(22张PPT)
文档属性
| 名称 | 北京版九年级化学下册 第9章《第二节 溶液组成的定量表示》课件(22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 656.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-23 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
要点回顾
1、溶液的特征是(
)
A
透明
B
无色
C
分层
D
均一、稳定
2、一杯NaCl溶液,其上部测得的密度为5克/cm3
,则下部测得的密度是(
)
A
<5
B
>5
C
等于5
D
小于5或大于5
3、可以作溶质的是(
)
A
固体
B
液体
C
气体
D
固、液、气体均可
★
★
★
溶液的质量=___________+___________
1.把10克硝酸钾完全溶于90克水中,则形成(
)克溶液
2.若100克氯化钾溶液中水的质量为89克,则氯化钾的质量(
)克
3.把25克硫酸钠溶于(
)克水中可形成200克硫酸钠溶液。
100
11
175
溶质质量
溶剂质量
第二节
溶液组成的定量表示
1.3
g食盐溶于20
g水中,形成食盐水的质量是多少呢?
提示:3
g+20
g=23
g
2.将5
g白糖放于15
g水中,将10
g白糖放于40
g水中,哪种糖水更甜呢?
提示:
第一种糖水中糖的含量为:
第二种糖水中糖的含量为:
所以第一种糖水更甜。
溶质的质量分数:
概念:溶质质量和溶液质量的比值
公式:溶质的质量分数
溶质的质量
=
——————
×
100﹪
溶液的质量
溶质的质量
=
———————————
×100﹪
溶质的质量+溶剂的质量
含义:在100份质量的溶液里有多少份质量的溶质。
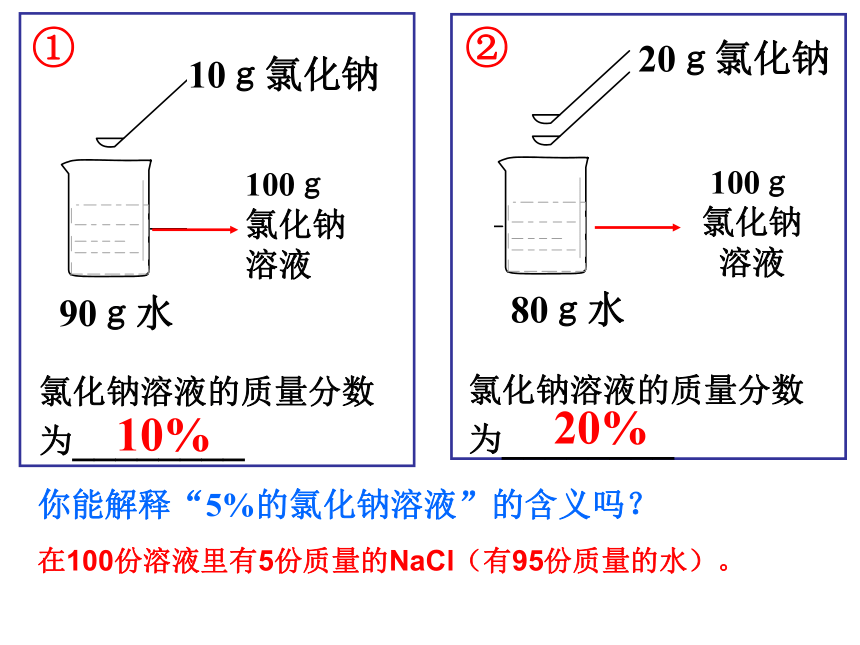
90g水
10g氯化钠
20g氯化钠
80g水
100g
氯化钠
溶液
氯化钠溶液的质量分数为________
氯化钠溶液的质量分数为________
10%
20%
你能解释“5%的氯化钠溶液”的含义吗?
①
②
100g
氯化钠
溶液
在100份溶液里有5份质量的NaCl(有95份质量的水)。
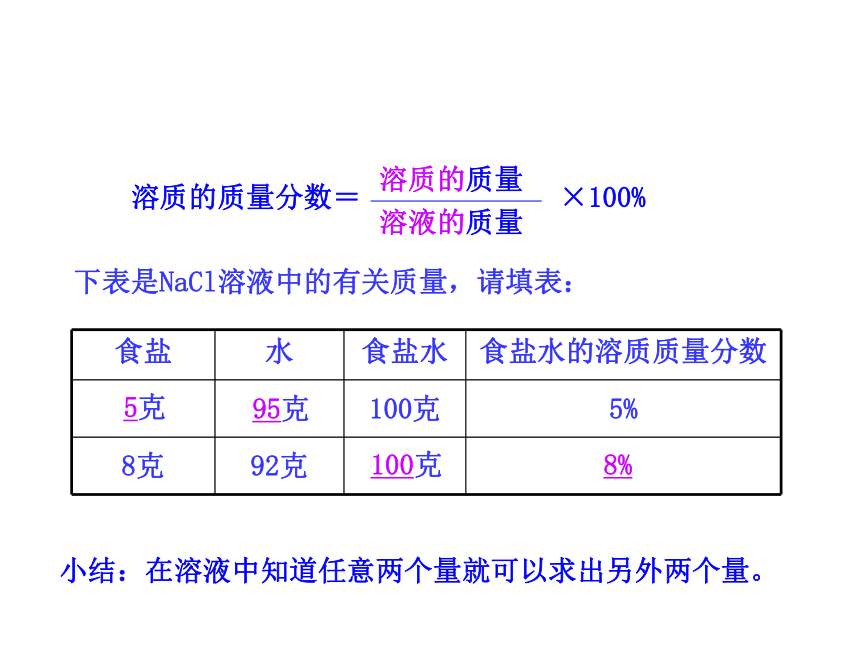
溶质的质量
溶液的质量
×100%
溶质的质量分数=
食盐
水
食盐水
食盐水的溶质质量分数
100克
5%
8克
92克
5克
95克
100克
8%
下表是NaCl溶液中的有关质量,请填表:
小结:在溶液中知道任意两个量就可以求出另外两个量。
请你帮忙
实质:稀释前后溶质的质量不变
现有一杯20%的硝酸钾溶液,你能帮我将它变成质量分数为10%的溶液吗?
稀释
将50g20%的硝酸钾溶液,用水稀释成质量分数为10%的溶液。求稀释时所用水的质量。
50
g
×
20%
稀释前溶质的质量
=稀释后溶质的质量
注意:
两种溶液混合时,质量可以相加,体积不能相加.
实质:稀释前后溶质的质量不变
解:设稀释时所加水的质量为x
50
g
×
20%=(50
g
+x)×
10%
x=50
g
答:稀释时所用水的质量为50
g。
(50
g
+
x
)
=
×
10%
配制50克质量分数为16%的氯化钠溶液。
现欲配制这种氯化钠溶液,请思考该如何操作?并请
归纳实验步骤及相应的实验仪器
二、溶液的配制
活动天地
仪器:
托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
步骤:
(1)计算:按配制要求计算出所需要的溶质和溶剂的量
(固体计算出质量,液体计算出体积)
(2)称量:用托盘天平称出所需的溶质,再用量筒取所需的溶剂。
(3)溶解:把溶质和溶剂混合,搅拌至溶质全部溶解。
(4)装瓶存放,贴标签:把配好的溶液装入试剂瓶中,贴上标签。
配制50g浓度为16%氯化钠溶液
步骤一:计算出需要氯化钠的质量和水的体积。
需要氯化钠的质量:
50g
×
16%
=
8g
需要蒸馏水的质量:
50g
-
8g
=
42
g
需要蒸馏水的体积:
42g/1g/mL=42mL
步骤二:用天平称量8g氯化钠,用量筒量取42mL的水。
步骤三:将称量出的8g氯化钠放入烧杯中,并将量取的42mL水倒入,用玻璃棒搅拌,使氯化钠完全溶解。
50g16%氯化钠溶液便配制完成了。
步骤四:装瓶并贴上标签(注明药品名称和溶质质量分数)。
问题分析
如果所配溶液的溶质质量分数略大于或者小于16%,你认为可能的原因有哪些?
1.氯化钠称量不正确。
2.用量筒量取水时,俯视(或仰视读数)。
3.……
白酒的“度”是怎么回事?
白酒的包装上面都标有“度数”,
如53度的茅台酒。白酒的“度”
实际上指白酒中酒精的含量,
这里的含量不是指质量分数,
而是体积分数,即酒精和水的
体积比为53∶47。
[注意]
①溶质的质量分数一般用百分数来表示,不能用分数表示。
②质量分数是一个比值,它的大小既与溶质质量有
关,也与溶液质量有关,并不是溶质多者其溶质的质量分数一定大。
③未溶解的物质不能计入溶质质量。
关于溶液稀释问题的计算
计算原理:
稀释溶液的过程中,____的质量不会发生变化。
计算公式:
浓溶液质量×浓溶液溶质的质量分数=
稀溶液质量×稀溶液溶质的质量分数。
[注意]
①两种溶液混合时,质量可以相加减,但体积之间不可以相加减。
②稀释的方法可以是用水稀释,也可用稀溶液稀释浓溶液。混合前后有下列相等关系:
浓溶液质量×浓溶液溶质的质量分数+稀溶液质量×稀溶液溶质的质量分数=混合溶液质量×混合溶液溶质的质量分数。
③计算时要保持单位一致。
本课小结
溶质的质量分数
有关溶液中溶质的质量分数的计算
溶液组成的定量表示
要点回顾
1、溶液的特征是(
)
A
透明
B
无色
C
分层
D
均一、稳定
2、一杯NaCl溶液,其上部测得的密度为5克/cm3
,则下部测得的密度是(
)
A
<5
B
>5
C
等于5
D
小于5或大于5
3、可以作溶质的是(
)
A
固体
B
液体
C
气体
D
固、液、气体均可
★
★
★
溶液的质量=___________+___________
1.把10克硝酸钾完全溶于90克水中,则形成(
)克溶液
2.若100克氯化钾溶液中水的质量为89克,则氯化钾的质量(
)克
3.把25克硫酸钠溶于(
)克水中可形成200克硫酸钠溶液。
100
11
175
溶质质量
溶剂质量
第二节
溶液组成的定量表示
1.3
g食盐溶于20
g水中,形成食盐水的质量是多少呢?
提示:3
g+20
g=23
g
2.将5
g白糖放于15
g水中,将10
g白糖放于40
g水中,哪种糖水更甜呢?
提示:
第一种糖水中糖的含量为:
第二种糖水中糖的含量为:
所以第一种糖水更甜。
溶质的质量分数:
概念:溶质质量和溶液质量的比值
公式:溶质的质量分数
溶质的质量
=
——————
×
100﹪
溶液的质量
溶质的质量
=
———————————
×100﹪
溶质的质量+溶剂的质量
含义:在100份质量的溶液里有多少份质量的溶质。
90g水
10g氯化钠
20g氯化钠
80g水
100g
氯化钠
溶液
氯化钠溶液的质量分数为________
氯化钠溶液的质量分数为________
10%
20%
你能解释“5%的氯化钠溶液”的含义吗?
①
②
100g
氯化钠
溶液
在100份溶液里有5份质量的NaCl(有95份质量的水)。
溶质的质量
溶液的质量
×100%
溶质的质量分数=
食盐
水
食盐水
食盐水的溶质质量分数
100克
5%
8克
92克
5克
95克
100克
8%
下表是NaCl溶液中的有关质量,请填表:
小结:在溶液中知道任意两个量就可以求出另外两个量。
请你帮忙
实质:稀释前后溶质的质量不变
现有一杯20%的硝酸钾溶液,你能帮我将它变成质量分数为10%的溶液吗?
稀释
将50g20%的硝酸钾溶液,用水稀释成质量分数为10%的溶液。求稀释时所用水的质量。
50
g
×
20%
稀释前溶质的质量
=稀释后溶质的质量
注意:
两种溶液混合时,质量可以相加,体积不能相加.
实质:稀释前后溶质的质量不变
解:设稀释时所加水的质量为x
50
g
×
20%=(50
g
+x)×
10%
x=50
g
答:稀释时所用水的质量为50
g。
(50
g
+
x
)
=
×
10%
配制50克质量分数为16%的氯化钠溶液。
现欲配制这种氯化钠溶液,请思考该如何操作?并请
归纳实验步骤及相应的实验仪器
二、溶液的配制
活动天地
仪器:
托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
步骤:
(1)计算:按配制要求计算出所需要的溶质和溶剂的量
(固体计算出质量,液体计算出体积)
(2)称量:用托盘天平称出所需的溶质,再用量筒取所需的溶剂。
(3)溶解:把溶质和溶剂混合,搅拌至溶质全部溶解。
(4)装瓶存放,贴标签:把配好的溶液装入试剂瓶中,贴上标签。
配制50g浓度为16%氯化钠溶液
步骤一:计算出需要氯化钠的质量和水的体积。
需要氯化钠的质量:
50g
×
16%
=
8g
需要蒸馏水的质量:
50g
-
8g
=
42
g
需要蒸馏水的体积:
42g/1g/mL=42mL
步骤二:用天平称量8g氯化钠,用量筒量取42mL的水。
步骤三:将称量出的8g氯化钠放入烧杯中,并将量取的42mL水倒入,用玻璃棒搅拌,使氯化钠完全溶解。
50g16%氯化钠溶液便配制完成了。
步骤四:装瓶并贴上标签(注明药品名称和溶质质量分数)。
问题分析
如果所配溶液的溶质质量分数略大于或者小于16%,你认为可能的原因有哪些?
1.氯化钠称量不正确。
2.用量筒量取水时,俯视(或仰视读数)。
3.……
白酒的“度”是怎么回事?
白酒的包装上面都标有“度数”,
如53度的茅台酒。白酒的“度”
实际上指白酒中酒精的含量,
这里的含量不是指质量分数,
而是体积分数,即酒精和水的
体积比为53∶47。
[注意]
①溶质的质量分数一般用百分数来表示,不能用分数表示。
②质量分数是一个比值,它的大小既与溶质质量有
关,也与溶液质量有关,并不是溶质多者其溶质的质量分数一定大。
③未溶解的物质不能计入溶质质量。
关于溶液稀释问题的计算
计算原理:
稀释溶液的过程中,____的质量不会发生变化。
计算公式:
浓溶液质量×浓溶液溶质的质量分数=
稀溶液质量×稀溶液溶质的质量分数。
[注意]
①两种溶液混合时,质量可以相加减,但体积之间不可以相加减。
②稀释的方法可以是用水稀释,也可用稀溶液稀释浓溶液。混合前后有下列相等关系:
浓溶液质量×浓溶液溶质的质量分数+稀溶液质量×稀溶液溶质的质量分数=混合溶液质量×混合溶液溶质的质量分数。
③计算时要保持单位一致。
本课小结
溶质的质量分数
有关溶液中溶质的质量分数的计算
溶液组成的定量表示
